
Замараев - часть 3
.pdf
Зависимость, соответствующую уравнению Михаэлиса–
Ментен, можно спрямить в координатах |
1 |
= |
1 |
+ |
Km × |
1 |
, из |
W |
V |
|
|||||
|
|
|
V |
CS |
|||
которой легко находятся параметры V и Km.
6.5.7. Гетерогенный катализ
Классический гетерогенный катализ состоит в ускорении газофазных или жидкофазных химических реакций функцио- нальными группами поверхности твердого тела. В качестве активных в катализе функциональных групп могут выступать, например,
1)гидроксильные группы ////////OH (это пример бренстедовских кислотных центров);
2)координационно ненасыщенные ионы алюминия (это пример льюисовских кислотных центров);
3)атомы металлов в различных степенях окисления и раз- личном лигандном окружении, например в окружении анионов
кислорода кристаллической решетки для твердых оксидов металлов или в окружении других атомов металла для ме- таллических катализаторов (это примеры активных центров, ведущих реакции по механизмам, аналогичным таковым для катализа комплексами металлов).
1. Строение гетерогенного катализатора
Типичное строение гетерогенного катализатора представ- лено на рис. 6.10.
Рис. 6.10. Типичное строение гранулы гетерогенного катализатора. Заштрихованные области обозначают решетку твердого тела, светлые области — систему пор, черные точки
– активные центры катализатора
Катализатор представляет собой гранулу той или иной формы (сферической, цилиндрической, кольцеобразной и т. п.) и того или иного размера. Объем гранулы пронизан сис-
38
темой тонких пор, наличие которых обеспечивает высокую поверхность катализатора.
Различают внешнюю поверхность катализатора Sвнеш , ко- торая определяется формой и размером его гранулы, и внут- реннюю поверхность катализатора Sвнутр , которая определя-
ется структурой его пор. Обычно выполняется условие
Sвнутр >> Sвнеш ,
т. е. полная поверхность Sп = Sвнеш + Sвнутр ≈ Sвнутр .
Активные центры катализатора, т. е. функциональные группы, ведущие каталитическую реакцию, могут быть распо- ложены как на внешней, так и на внутренней поверхности. Но обычно на внутренней поверхности их значительно больше,
так как сама эта поверхность значительно больше внешней поверхности. Активные центры обозначены на рисунке чер- ными точками.
2. Стадии гетерогенной каталитической реакции
Вследствие такого строения твердого катализатора, гете- рогенные каталитические реакции включают следующие ста- дии:
1. Транспорт молекул реагентов из объема газовой или жидкой фазы к внешней поверхности катализатора. В про- мышленных каталитических реакциях, протекающих в жидко- сти или в газе при нормальном или повышенном давлении, этот транспорт идет путем диффузии. Поэтому данную ста- дию реакции называют внешней диффузией.
2.Диффузия молекул реагентов по порам от внешней поверхности в глубь объема катализатора. Эту стадию назы-
вают внутренней диффузией.
3.Адсорбция молекул хотя бы одного из реагентов на ак- тивных центрах поверхности катализатора.
4.Химическая реакция на поверхности между двумя ад-
сорбированными молекулами или между молекулой, адсор- бированной на поверхности, и молекулой из жидкой или газо- вой фазы.
39
5.Десорбция молекул продуктов реакции.
6.Внутренняя диффузия молекул продуктов.
7.Внешняя диффузия молекул продуктов.
В принципе, любая из этих стадий может лимитировать скорость реакции в целом.
3. Диффузионные стадии
Учет влияния диффузионных стадий 1, 2, 6 и 7 на скорость гетерогенного катализа в принципе проводится точно так же, как и для гомогенных реакций в жидкости (см. разд. 2.3.1). Следует лишь иметь в виду, что коэффициенты внешней и внутренней диффузии могут существенно различаться. На- пример, для гетерогенного катализа в газах длина свободного пробега молекулы (а значит, и коэффициент диффузии) оп- ределяется для внешней диффузии либо частотой ее столк- новений с другими молекулами (если длина свободного про- бега λ << L, где L – размер реакционного сосуда), либо прямо частотой ее столкновений с внешней поверхностью катализа- тора (если λ >> L). В отличие от этого, коэффициент внутрен- ней диффузии в порах достаточно малого размера (d ≈ 10 Å)
может определяться частотой столкновений молекулы со стенками поры.
Существует простой прием, позволяющий установить, кон- тролируется ли гетерогенная каталитическая реакция диффу- зией. Для этого надо сравнить скорости реакций в присутст- вии одного и того же количества (по массе) катализатора, но приготовленного в виде гранул разного размера. Если реак- ция контролируется диффузией, то ее скорость возрастет при уменьшении размера гранул, так как при этом возрастут ско- рости как внешней диффузии (вследствие увеличения сум- марной внешней поверхности гранул), так и внутренней диф- фузии (вследствие уменьшения расстояния, на которое при- ходится диффундировать). Если же реакция контролируется не диффузией, а стадиями 3–5, то при фиксированной массе
катализатора скорость реакции не будет зависеть от размера гранул.
40
4. Стадии адсорбции и десорбции. Изотермы адсорбции Лэнгмюра
а) Для описания кинетики адсорбции воспользуемся зако- ном действующих масс для взаимодействия частиц с поверх- ностью (см. разд. 2.1.2, пункт «а»). Напомним, что в упомяну-
том выше разделе мы получили для скорости реакции
A + |
|
¾¾® X |
(6.45) |
s |
между молекулами А из газовой фазы с поверхностью s сле- дующее выражение:
dCA |
= - kS × |
S |
× CA , |
(2.4) |
|
V |
|||
dt |
|
|
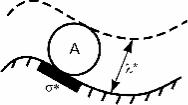
||
где S – площадь поверхности, V – объем системы, а константа скорости kS = k1 × l * имеет размерность [kS ]= [t−1 ×l]= [см с]. Здесь k1 – константа скорости мономолекулярной реакции между А и s в реакционном слое толщиной l* вблизи поверх- ности (рис. 6.11).
с]. Здесь k1 – константа скорости мономолекулярной реакции между А и s в реакционном слое толщиной l* вблизи поверх- ности (рис. 6.11).
Рис. 6.11. Схематическое пред-
ставление использования закона действующих масс для взаимодейст-
вия частиц с поверхностью
На этом рисунке через s* обозначена площадь элемента поверхности, взаимодействующего с частицей А.
Очевидно, что V* = l*×s* – это реакционный объем вокруг элемента поверхности s*.
Для процесса адсорбции (6.45) частиц А газовой или жид-
кой фазы на поверхности твердого тела в соответствии с только что сказанным имеем
|
æ dC |
A |
ö |
|
|
|
S |
|
|
|
|
|
S |
|
|
|
|
W |
= -ç |
|
÷ |
= k |
|
× |
|
× C |
|
= k |
|
× |
|
× C |
|
, (6.46) |
|
|
|
|
|
|
|
|
|
||||||||||
адс |
è |
dt |
øадс |
|
S |
|
V |
|
A |
|
адс |
|
V |
|
A |
|
|
41
где kадс – значение kS для процесса адсорбции.
Очевидно, что в этом выражении S – это свободная ак- тивная поверхность катализатора, т. е. поверхность, не заня- тая частицами Aадс .
Число NA частиц А в газовой (или жидкой) фазе связано с
их концентрацией соотношением
|
|
|
NA = CA × V . |
|
|
||
При V = const |
из уравнения для Wадс получаем следующее |
||||||
уравнение для |
dNA |
: |
|
|
|
|
|
|
|
|
|
|
|
||
|
dt |
|
|
|
|
|
|
|
|
æ dN ö |
|
|
|
||
|
-ç |
A |
÷ |
= kадс |
×S ×CA . |
(6.47) |
|
|
|
||||||
|
è |
dt øадс |
|
|
|
||
Введем следующие обозначения:
1) s*A – площадь поверхности, занимаемая одной частицей
– площадь активной поверхности, занятой части- цами Aадс , So – полная площадь активной поверхности; 2) No
– полное число центров адсорбции, NAадс |
– число адсорби- |
||||||||||||
рованных частиц Aадс , N – число свободных центров адсорб- |
|||||||||||||
ции; |
|
|
|
|
|
|
|
|
|
|
|
|
|
3) q A – |
|
доля активной поверхности, |
занятой частицами |
||||||||||
Aадс . |
|
|
|
|
|
|
|
|
|
|
|
|
|
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
No = N + NAадс |
, |
|
|
|
|
|||||
|
|
|
So = S + Sадс , |
|
|
|
|||||||
S |
o |
= N × s * , S = N× s * |
, S |
адс |
= N ×s |
* , |
|||||||
|
o A |
|
|
|
|
A |
|
|
|
адс |
A |
||
|
|
æ dN |
ö |
æ dNA |
адс ö |
|
|
||||||
|
|
- ç |
|
A |
÷ |
= ç |
|
|
|
÷ |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
è |
dt øадс |
ç |
|
dt |
÷ |
|
|
||||
|
|
è |
|
|
øадс |
|
|
||||||
42

|
|
|
|
|
|
|
|
æ dN |
ö |
|
|
|
|
|||||
и выражение (6.47) для ç |
|
|
|
A |
÷ преобразуется к виду |
|||||||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
è |
|
|
dt |
|
øадс |
|
|
|
|
||
|
|
|
|
æ dN |
A |
ö |
|
|
|
|
|
|
||||||
|
|
|
- ç |
|
|
|
÷ |
|
= kадс × S × CA , |
|
|
|
||||||
|
|
|
|
|
dt |
|
|
|
|
|||||||||
|
|
|
è |
|
|
|
øадс |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ß |
|
|
|
|
|
|
|
|
æ dN |
|
|
ö |
|
|
|
|
|
|
||||||
|
|
|
ç |
|
|
|
|
Aадс |
÷ |
|
= kадс × S × CA , |
|
|
|
||||
|
|
|
ç |
|
|
|
dt |
|
|
|
÷ |
|
|
|
|
|||
|
|
|
è |
|
|
|
|
|
|
øадс |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ß |
|
|
|
|
|
æ dq |
A |
ö |
|
|
|
|
= k(адс) × l * ×(N - N |
)×s* |
×C |
|
|
|||||||
N ç |
|
÷ |
|
|
|
|
|
, |
||||||||||
|
|
|
|
|
|
|||||||||||||
oè |
dt |
øадс |
|
|
|
|
1 |
|
o адс |
A |
|
A |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ß |
|
|
|
|
|
|
|
æ dq |
|
|
ö |
|
|
|
|
k(адс)V *× (1- qA )× CA . |
|
|
||||||
|
|
ç |
|
|
A |
÷ |
|
|
= |
|
(6.48) |
|||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
è |
dt |
|
øадс |
|
|
14243 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k(адс) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
В этих выражениях k1(адс) – константа скорости мономолеку-
лярной реакции между частицей А и центром адсорбции с площадью s*A ; V *=l * × s*A – элементарный реакционный объ- ем для процесса адсорбции; k(2адс) =k1(адс) × V * – константа ско-
рости бимолекулярного процесса взаимодействия частиц А с поверхностью, приводящего к адсорбции.
æ dq |
ö |
|
æ dNAадс |
ö |
æ dN |
ö |
|||||
Индекс «адс» у членов ç |
|
A |
÷ |
, |
ç |
|
÷ |
и ç |
|
A |
÷ |
è |
dt øадс |
|
ç |
dt |
÷ |
è |
dt øадс |
||||
|
è |
øадс |
|||||||||
означает, что рассматривается изменение величин qA , NAадс
и NA , обусловленное только процессом адсорбции.
б) Десорбцию можно рассматривать как мономолекуляр-
ную реакцию |
|
Aадс ¾¾® A + s |
(6.49) |
43

Тогда выражения для скорости десорбции имеет вид
|
|
|
|
æ dC |
A |
ö |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
W |
дес |
= - ç |
|
|
|
|
адс |
÷ |
|
|
= k(дес) |
×C |
Aадс |
; |
|
|
|
|
|
(6.50) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
ç |
|
|
|
dt |
÷ |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
è |
|
|
|
ø |
дес |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
ß |
¬¾ |
|
умножаем на V обе части пре- |
|||||||||||||||||||
|
|
|
|
|
|
|
|
дыдущего уравнения |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
æ dN |
|
|
|
|
ö |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
- ç |
|
A |
адс |
÷ |
|
|
= k(дес) |
×N |
; |
|
|
|
|
|
|
|
(6.51) |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
ç |
|
dt |
|
|
÷ |
|
|
|
|
|
1 |
Aадс |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
è |
|
|
|
øдес |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
ß |
¬¾ |
|
делим на No обе части преды- |
|||||||||||||||||||
|
|
|
|
|
|
|
|
дущего уравнения |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
æ dq |
A |
ö |
|
= |
|
- k1(дес) × qA . |
|
|
|
|
|
|
|
|
(6.52) |
||||||||||||
|
|
ç |
|
|
÷ |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
è |
|
øдес |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
æ dq |
|
ö |
æ dN |
ö |
|
æ dCA |
адс |
ö |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
, ç |
|
Aадс |
|
÷ |
|
ç |
|
|
÷ |
|
||||||||
Индекс «дес» у членов ç |
|
|
A |
÷ |
|
|
|
и |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
è |
|
dt |
|
øдес |
ç |
dt |
÷ |
|
ç |
|
dt |
|
÷ |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
è |
ø |
дес |
è |
|
|
ø |
дес |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
означает, что рассматривается изменение величин qA , NAадс и CAадс , обусловленное только процессом десорбции.
в) Изотерма адсорбции
В ходе адсорбции при малых qA сначала выполняется ус-
ловие
Wадс > Wдес .
Однако по мере увеличения qA , Wадс непрерывно падает, а Wдес возрастает. Это происходит до тех пор, пока не достига-
ется условие адсорбционного равновесия |
|
|||||||
|
Wадс |
|
= |
|
Wдес |
|
, |
(6.53) |
|
|
|
|
|||||
ß |
|
|
|
|
|
|||
k2(адс) × (1- qA )×CA - k1(дес) × qA |
= 0 , |
|||||||
ß |
|
|
|
|
|
|||
44

k(2адс) × CA - (k1(дес) + k(2адс) × CA )× qA = 0 ,
ß
qA = |
|
|
k2(адс) × CA |
, |
|
||||
k1(дес) + k(2адс) × CA |
|
||||||||
|
|
|
|
||||||
|
|
|
|
ß |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
qA |
= |
|
|
Kадс×CA |
|
, |
(6.54) |
|
|
1 |
+ Kадс×CA |
|||||||
|
|
|
|
|
|
||||
k(адс)
где Kадс = k(2дес) – константа равновесия адсорбции.
2
Последнее выражение называют изотермой адсорбции Лэнгмюра.
Если в системе имеются два вещества A и B, конкурирую- щие друг с другом за одни и те же места адсорбции, то сис- тема кинетических уравнений, описывающая адсорбцию- десорбцию, принимает вид
dqA |
= k2(адсA |
) × (1 |
- qA - qB )× CA - k1A(дес) × qA ; |
||||||
dt |
|||||||||
|
|
|
|
|
|
|
|
||
dqB |
= k(адс) × (1 |
- q |
A |
- q )×C |
B |
- k(дес) × q . |
|||
|
|||||||||
dt |
2B |
|
|
B |
1B |
B |
|||
|
|
|
|
|
|
|
|
||
В условиях адсорбционного равновесия
dqA
dt
(1- qA - qB )
qB
= 0 , |
|
|
dqB |
= 0 , |
|
|
|||||||
|
|
dt |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
ß |
|
|
|
|
|
|
|
|
|
|
|
k(дес) × q |
|
|
|
|
k(дес) × q |
|
||||||
= |
|
1A |
|
|
A |
|
= |
|
1B |
B |
, |
||
|
k(адс) × C |
A |
|
k(адс) ×C |
|
||||||||
|
|
2A |
|
|
|
|
2B |
B |
|
||||
|
|
|
ß |
|
|
|
|
|
|
|
|
|
|
= q |
|
× |
K(B) |
|
×C |
|
|
|
|
||||
A |
адс |
|
|
B |
|
|
|
||||||
|
|
|
Kадс(A) |
×CA |
|
|
|||||||
(6.55)
(6.56)
45
(K(A)адс и K(B)адс – константы равновесия адсорбции для ве-
ществ A и B),
æ
k(2адсA ) × çç1- qA
è
ß
|
|
K(B) |
×C ö |
|
|
|
|
|
|
-q |
A |
адс |
B |
÷ |
×C |
A |
- k(дес) × q |
A |
= 0 , |
(A) |
|
||||||||
|
÷ |
|
1А |
|
|||||
|
|
Kадс |
×CA ø |
|
|
|
|
|
|
ß
|
|
|
é |
|
K(B) |
× C |
ù |
|
|
|
|
|
|||
K(A)адс ×CA |
- K(A)адс |
× qA × ê1+ |
|
адс |
B |
ú |
×CA - qA = 0, |
|
|||||||
|
K(A)адс |
|
|
||||||||||||
14243 |
|
|
ê |
|
× CA ú |
|
|
|
|
|
|||||
|
|
|
ë |
|
|
|
|
|
û |
|
|
|
|
|
|
|
144444424444443 |
|
|||||||||||||
|
|
|
ß |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
qA = |
|
Kадс(A) |
×CA |
|
|
|
|
. |
(6.57) |
||||
|
|
1+ K(A) |
×C |
A |
+ K(B) |
×C |
B |
||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
адс |
|
|
|
адс |
|
|
|
||||
Аналогичным образом из соображений симметрии имеем
qB= |
|
|
K(B)адс |
× CA |
|
|
. |
(6.58) |
||
1 |
+ K(A) |
× C |
A |
+ K(B) |
×C |
|
||||
|
|
|
|
|||||||
|
|
|
адс |
|
адс |
B |
|
|
|
|
Доля незанятых центров адсорбции
1- qA - qB = |
|
|
|
1 |
|
|
|
. |
(6.59) |
|
+ K(A) |
× C |
|
+ K(B) |
×C |
|
|||
1 |
A |
|
|
|
|||||
|
|
адс |
|
адс |
B |
|
|
|
|
Для случая совместной адсорбции трех веществ A, B и P
нетрудно получить
qA = |
|
|
|
Kадс(A) ×CA |
|
|
|
; |
(6.60) |
|
1+ K(A) |
×C |
A |
+ K(B) |
× C |
+ K(P) |
× C |
||||
|
адс |
|
адс |
B |
адс |
P |
|
|
||
|
|
|
|
K(B) × C |
|
|
|
|
|
|
qB= |
|
|
|
адс |
B |
|
|
|
; |
(6.61) |
1+ K(A) |
×C |
A |
+ K(B) |
× C |
+ K(P) |
×C |
||||
|
адс |
|
адс |
B |
адс |
P |
|
|
||
|
|
|
|
K(P) × C |
|
|
|
|
|
|
qP= |
|
|
|
адс |
P |
|
|
. |
(6.62) |
|
1+ K(A) |
×C |
A |
+ K(B) |
× C |
+ K(P) |
×C |
||||
|
адс |
|
адс |
B |
адс |
P |
|
|
||
46

5. Стадия химической реакции на поверхности
а) Мономолекулярные реакции на поверхности
1) |
Aадс ¾¾® Pадс |
(6.63) |
||
или |
|
|
|
|
2) |
Aадс ¾¾® P + |
|
. |
(6.64) |
s |
||||
В обоих случаях изменение qA во времени описывается вы-
ражением
W = -ddtqA = k1 × qA .
Для изменения концентрации продукта имеем в первом случае
|
|
|
|
|
|
|
|
|
|
|
dqP |
= - |
dqA |
|
= k1 × qA , |
|
|
|
|
(6.65) |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
dt |
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
во втором случае |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
dCP |
|
dNP |
|
|
1 |
|
|
|
|
|
|
dN |
Aадс |
|
1 |
|
|
|
|
|
( |
|
|
) |
|
1 |
|
||||||||
|
= |
× |
|
= - |
|
|
× |
= - |
d No × qA |
|
× |
= |
||||||||||||||||||||||||
|
dt |
|
dt |
|
V |
|
|
|
|
|
|
dt |
V |
|
|
|
|
|
dt |
|
|
V |
|
|||||||||||||
|
|
|
|
dq |
A |
|
|
N |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
NAадс |
|
|
|
|
|||||||||
|
|
= - |
|
|
× |
|
o |
|
= k1 |
× qA |
× |
|
|
o |
|
= k1 × |
|
|
. |
|
|
|
||||||||||||||
|
|
|
|
|
|
V |
|
V |
|
V |
|
|
|
|||||||||||||||||||||||
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Итак, получили следующие выражения для |
dCP |
: |
|
|
||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dCP |
|
= k1 |
× qA × |
No |
|
|
|
|
|
|
(6.66a) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NAадс |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
= k1 |
× |
|
|
|
|
|
|
. |
|
|
|
|
|
(6.66б) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
б) Бимолекулярная реакция между молекулой газа (жидко- сти) и адсорбированной молекулой
Такая реакция имеет вид |
|
A + Bадс ¾¾® P . |
(6.67) |
47
