
Замараев - часть 3
.pdf
сия и термализация, т. е. тепловое выравнивание энергии всех частиц вдоль треков.
Вторичные радиационно-химические реакции – это, глав- ным образом, термические реакции ионов, возбужденных мо- лекул и свободных радикалов.
В качестве примера приведем одну из простейших радиа- ционно-химических реакций – реакцию радиолиза O2:
|
β, γ |
∙ |
|
|
|
+ |
− |
, |
|
O2 ¾¾® O2 |
+ e |
|||
O2 |
β, γ |
* |
, |
|
¾¾® O2 |
|
|||
|
|
|
∙ |
|
O2 + e− |
¾¾® O2− , |
|
||
∙ |
|
|
|
|
O+2 + e– |
¾¾® O + O*, |
|||
∙ |
∙ |
|
|
|
O+2 + O2− |
¾¾® O + O3, |
|||
∙ |
∙ |
|
|
|
O+2 + O2− |
¾¾® O2* + O2, |
|||
∙ |
∙ |
|
O2+ + O2− |
¾¾® O2 + O * + O, |
|
O + O2 + M ¾¾®O3 + M, |
||
O2* |
¾¾® 2O, |
|
O2* |
+ O2 |
¾¾® O + O3, |
O + O3 ¾¾® O2 + O*2, O + O3 ¾¾® O2 + O + O.
§ 6.5. Катализ
6.5.1. Сущность катализа
Катализом называется явление, состоящее в ускорении химических реакций под влиянием специальных ве- ществ-катализаторов, многократно вступающих в промежуточное химическое взаимодействие с участниками реакции и восстанавливающих свой химический состав после каждого цикла промежуточных взаимодействий.
Отметим следующие принципиально важные черты ката- литических реакций:
1.Катализатор вступает в химическое взаимодействие с реагентами. При этом образуются более реакционноспособ- ные промежуточные частицы (комплексы, ионы, свободные радикалы), чем исходные вещества.
2.Активные промежуточные частицы реагируют в даль- нейшем таким образом, что их превращения приводят в итоге
18
к образованию конечных продуктов и регенерации частиц ка- тализатора.
3.Таким образом, каталитические реакции являются цик- лическими по отношению к катализатору. Первоначальное
состояние катализатора регенерируется после каждого цикла промежуточных взаимодействий катализатора с реагентами.
4.Количество катализатора в системе остается неизмен- ным в ходе каталитической реакции. Этим он отличается от инициатора химической реакции, который расходуется в ходе реакции.
5.Вследствие того что в результате каталитической реак- ции катализатор не изменяет свое химическое состояние, т. е. он не входит в состав конечных продуктов реакции), он не оказывает влияния на положение равновесия между конеч- ными продуктами реакции и исходными веществами.
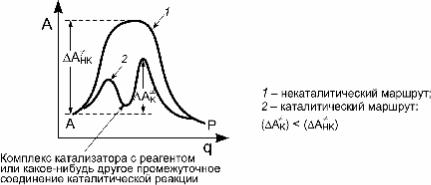
6.Как показано в § 6.1, ускорение реакции в присутствии катализатора достигается за счет того, что максимальное значение свободной энергии, которое реагирующая система достигает при движении от начального состояния к конечно-
му, для каталитического маршрута ( AК¹ ) ниже, чем для нека- талитического ( AНК¹ ) (рис. 6.4).
Рис. 6.4. Понижение макси-
мального значения свободной энергии для каталитического маршрута реакции:
19
Катализ обычно формально делят на гомогенный и гетерогенный. Если все участники каталитической реакции нахо- дятся в одной фазе (например, в жидком растворе), то гово- рят о гомогенном катализе. Если катализатор представляет собой фазу, отличную от фазы, образуемой реакционной средой, то говорят о гетерогенном катализе.
Принципиального отличия между этими двумя формами катализа нет, однако у каждой из них имеются кинетические особенности, на которых мы остановимся ниже.
В отдельную форму выделяют также ферментативный катализ, т. е. катализ под действием биологических катализа- торов – ферментов.
Принципиального отличия в механизмах действия обычных гомогенных и гетерогенных катализаторов, с одной стороны, и ферментов, с другой стороны, также нет. Однако благодаря
длительному отбору в процессе эволюции живой природы ферменты на сегодня являются, как правило, более активны- ми и селективными катализаторами, чем гомогенные и гете- рогенные катализаторы небиологического происхождения.
6.5.2. Гомогенный катализ
В простейшем случае каталитическая реакция состоит из двух стадий:
1) образования реакционноспособной формы АК исходного реагента А при его взаимодействии с катализатором К:
k1
А + К 
 АК (6.9)
АК (6.9)
k–1
и
2) превращения АК в продукт реакции Р с регенерацией начальной формы катализатора К:
k2
АК 
 Р + К. (6.10)
Р + К. (6.10)
k–2
Случай 1. Рассмотрим сначала наиболее общий случай, когда стадии 1 и 2 обратимы, а скорости прямых и обратных реакций близки по величине.
20
Кинетические уравнения для Р и АК имеют вид
|
|
|
|
|
|
|
dCP = k |
|
× C |
|
- k− |
|
× C × C , |
|
|
|
|
|||||||
|
|
|
|
|
|
|
dt |
|
|
|
2 |
|
|
AK |
|
2 |
|
P |
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
dCAK = (k |
|
× C |
|
× C |
|
+ k− |
|
× C |
|
× C |
) - (k− |
× C |
|
+ k |
|
× C |
|
). (6.11) |
||||||
dt |
|
1 |
|
A |
|
K |
|
|
2 |
|
|
P |
|
K |
|
|
1 |
|
AK |
|
2 |
|
AK |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Пусть реакционная способность АК достаточно велика для того, чтобы можно было применить метод стационарных кон- центраций. Тогда
|
|
|
|
dCAK |
= 0 , |
|
|
|
|
|
|
dt |
|
||
|
|
|
|
|
|
|
|
|
|
ß |
|
|
|
||
C |
AK |
= |
k1 × CA + k−2 × CP |
× C . |
(6.12) |
||
|
|||||||
|
|
|
|
|
K |
|
|
|
|
|
|
k−1 + k2 |
|
||
Учтем далее уравнение материального баланса по катали-
затору
C(K0) = CK + CAK ,
т. е.
CK = C(K0) - CAK .
Подставляя это выражение для CK в правую часть выраже- ния (6.12) для САК, находим
CAK = k1 × CA + k−2 × CP × CK(0) - |
k1 × CA + k−2 × CP × C¢AK , |
|||||||
|
k−1 + k2 |
|
|
|
k−1 + k2 |
|||
|
|
|
|
ß |
|
|
|
|
CAK |
= k1 × CA + k−2 × CP × CK(0) |
1+ k1 × CA + k−2 × CP = |
||||||
|
k−1 + k2 |
|
|
|
k−1 + k2 |
|||
|
(0) |
|
|
k1 × CA |
+ k−2 |
× CP |
|
|
|
= C |
× |
|
|
|
|
|
(6.13) |
|
k−1 |
+ k2 + k1 × CA |
+ k−2 |
|
||||
|
K |
|
× CP |
|||||
|
|
|
1444442444443 |
|
||||
(эта дробь равна вероятности найти частицу катализатора в форме АК )
21

Найдем теперь выражение для СК:
C |
= C(0) |
- C |
|
= C(0) × |
é 1- |
|
k1 × CA |
+ k−2 × CP |
|
|
ù |
= |
|||||||||||
AK |
|
|
|
|
|
ú |
|||||||||||||||||
K |
K |
|
|
|
K |
ê |
k− |
+ k |
|
+ k |
|
× C |
|
+ k− |
|
× C |
|
||||||
|
|
|
|
|
|
|
|
ë |
2 |
1 |
A |
2 |
P û |
|
|||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
(0) |
|
|
|
|
k−1 + k2 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
= C |
× |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(6.14) |
|||
|
|
|
|
k−1 |
+ k2 |
+ k1 × CA |
+ k−2 × CP |
|
|
||||||||||||||
|
|
|
|
K |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
1444442444443 |
|
|
|
|
|
|
|||||||||||
( эта дробь равна вероятности найти частицу катализатора в форме К)
Теперь подставим найденные выражения для САК и СК в вы-
ражение (6.11) для dCdtP :
dCP |
= k |
|
× C(0) |
× |
|
|
|
|
|
k1 × CA + k−2 × CP |
|
|
|
- |
|||||||||||||||||||||
dt |
|
|
|
2 |
|
K |
|
|
k− |
|
+ k |
2 |
+ k |
1 |
× C |
A |
+ k− |
2 |
× C |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|||||||
- k |
2 |
× C(0) |
|
× C |
× |
|
|
|
|
|
|
|
|
|
|
|
k−1 + k2 |
|
|
|
|
|
|
|
= |
||||||||||
k− |
|
+ k |
|
|
|
|
|
|
+ k |
− |
|
|
× C |
|
|
||||||||||||||||||||
|
|
|
K |
|
|
P |
|
|
2 |
|
+ k |
1 |
× C |
A |
2 |
P |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
= k2 × k1 × CA + k2 × k−2 × CP - k−1 ×k−2 × CP - k2 × k−2 × CP × C(0) , |
|||||||||||||||||||||||||||||||||||
|
|
|
k−1 + k2 + k1 × CA + k−2 × CP |
|
|
|
|
|
|
K |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ß |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
dC |
|
|
|
|
|
|
|
k |
1 |
× k |
2 |
|
× C(0) |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
P |
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
×CA - |
|
||||||||||
|
|
dt |
|
k−1 + k2 + k1 ×CA + k−2 ×CP |
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
k− |
1 |
× k |
− |
2 |
× C(0) |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
× CP . |
(6.15) |
||||||||||
|
|
|
|
|
|
k−1 + k2 + k1 |
× CA + k−2 × CP |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
Таким образом, для каталитической реакции |
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
|
K |
|
|
Р |
|
|
|
|
|
|
|
|
|
(6.16) |
|||||
получаем, что |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
dCP |
= k |
прямая |
× C |
A |
- k |
обратная |
× C ; |
(6.17) |
||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
где
22

|
|
|
|
|
|
|
|
|
k1 × k2 |
|
|
(0) |
|
||||
k |
прямая |
= |
|
|
|
|
|
|
|
|
|
|
|
×C ; |
(6.18) |
||
k |
|
× C |
|
+ k− |
|
× C + k− |
|
+ k |
|
||||||||
|
|
|
1 |
A |
2 |
1 |
2 |
|
K |
|
|||||||
|
|
|
|
|
|
|
|
P |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
k−1 × k−2 |
|
|
(0) |
|
||||
k |
обратная |
= |
|
|
|
|
|
|
|
|
|
|
|
× C . |
(6.19) |
||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
||
|
|
|
|
|
k1 × CA + k−2 × CP + k−1 + k2 |
|
|||||||||||
Как видим, эффективные константы скорости как для пря- мой реакции, kпрямая, так и для обратной реакции, kобратная, пря- мо пропорциональны концентрации катализатора C(K0) . Сле-
довательно, скорость реакции в целом
W = |
dCP |
= W |
- W |
(6.20) |
|
||||
|
dt |
прямая |
обратная |
|
|
|
|
|
также прямо пропорциональна C(K0) .
В то же время обе эффективные константы скорости слож- ным (но сходным) образом зависят от концентраций CA и CP .
Убедимся, что присутствие катализатора не влияет на рав- новесие реакции (6.16). Для этого подставим в выражение
для скорости |
каталитической |
реакции |
(6.17) равновесные |
|||||||||||||||||
|
~ |
|
~ |
|
и учтем, |
|
что в условиях равновесия |
|||||||||||||
концентрации СА и СР |
|
|||||||||||||||||||
для каталитической реакции |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
dCP |
= 0 , |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
т. е. |
~ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
kпрямая |
|
k |
|
|
|
|
k |
|
|
|
|||||||
|
|
С |
|
|
|
1 |
|
|
|
2 |
|
= Kравн(1) ×Kравн(2) . |
||||||||
Kравн |
= |
~P |
= |
|
|
|
|
|
|
= |
|
|
|
× |
|
|
|
|||
|
kобратная |
|
|
|
|
|
|
|
||||||||||||
|
|
СA |
|
|
|
k−1 k−2 |
|
|||||||||||||
В последнем выражении |
|
|
|
|
|
|
|
|
~ |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
k1 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
(1) |
|
|
|
|
|
СAK |
|
|||||||||
|
|
|
Kравн = |
|
|
|
= |
|
~ |
|
|
|
|
~ |
|
|
||||
|
|
|
|
k−1 |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
С |
A |
× С |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
|||||
и
23

|
k2 |
|
~ |
~ |
(2) |
|
СP |
× СK |
|
Kравн = |
|
= |
~ |
|
k−2 |
|
|||
|
|
СAK |
||
–константы равновесия стадий каталитической реакции. Нетрудно видеть, что выражение для Kравн
|
~ |
|
|
~ |
~ |
|
~ |
(1) (2) |
СAK |
|
СP |
× СK |
|
СP |
|
Kравн = Kравн ×Kравн = |
~ |
~ |
× |
~ |
|
= |
~ |
|
СA |
×СK |
|
СAK |
|
СA |
|
не содержит множителей, которые зависели бы от концентра- ции катализатора. Таким образом, константа равновесия ка- талитической реакции не зависит от концентрации катализа- тора: она равна константе равновесия некаталитической ре- акции.
Случай 2. Рассмотрим теперь частный случай, когда вто- рая стадия каталитической реакции необратима, т. е. k−2 = 0 .
В этом случае
dC |
k |
1 |
× k |
2 |
× C |
A |
× C(0) |
|
||
P |
= kпрямая × CA = |
|
|
|
K |
. |
(6.21) |
|||
|
|
|
|
|
|
|
|
|||
dt |
k−1 + k2 + k1 × CA |
|
||||||||
Это уравнение для скорости реакции было впервые получено Михаэлисом и Ментен при изучении катализа ферментами.
Если обозначить через Km кинетическую константу
Km = k−1k+ k2
1
(ее называют константой Михаэлиса), то уравнение (6.21)
примет вид
dC |
k C(0)C |
A |
|
|
|
P |
= |
2 K |
. |
(6.22) |
|
|
|
|
|||
dt |
Km + CA |
|
|||
Это так называемое уравнение Михаэлиса–Ментен.
Случай 3. Рассмотрим еще один частный случай, когда стадия 1 быстра и равновесна, а стадия 2 – медленна и необ- ратима, т. е.
24

k2 << k1CA , k2 << k−1 ,
В этом случае выражение
dCdtP = kпрямая
k−2 = 0 . |
|
|
|
||
(6.17) принимает вид |
|
||||
× CA = |
(k |
1 |
k− |
)×k C C(0) |
, |
|
1 |
2 A K |
|||
|
(k1 k−1)× CA +1 |
|
|||
ß
dC |
k2Kравн(1) ×CACK(0) |
|
|||
P |
= |
|
|
. |
(6.23) |
|
1+ Kравн(1) |
|
|||
dt |
× CA |
|
|||
Нетрудно видеть, что порядок реакции по реагенту изме- няется от первого при малых (K(1)равн ×CA <<1) концентрациях А
до нулевого при больших (K(1)равн ×CA >> 1) концентрациях А. Случай 4. Если K(1)равн ×CA >> 1, то порядок реакции по реа-
генту А становится нулевым и
dCdtP = k2 ×C(K0) .
Это кинетическое уравнение имеет простой физический смысл: в рассматриваемых условиях равновесие первой ста- дии смещено вправо, практически весь катализатор находит- ся в форме АК, т. е.
CAK = C(K0) .
При этом скорость реакции в целом, лимитируемая второй стадией, равняется
dCP |
= k2 ×CAK = k2 ×CK(0) . |
(6.24) |
|
||
dt |
|
|
Случай 5. Противоположная ситуация наблюдается, если (K(1)равн ×CA <<1). В этом случае равновесие первой стадии
25
сдвинуто влево, концентрация комплекса АК мала по сравне-
нию с концентрацией свободного катализатора К и
|
C |
AK |
= K(1) |
|
× C = K(1) |
×C(0) . |
|
|
|
|
|||||||
|
|
|
|
равн |
|
K |
|
равн |
|
K |
|
|
|
|
|||
При этом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dCP |
= k |
2 |
×C |
AK |
= k |
2 |
×K(1) |
|
×C(0) |
× C |
A |
, |
(6.25) |
|||
|
|
|
|||||||||||||||
|
dt |
|
|
|
|
|
равн |
K |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
т. е. наблюдается первый порядок по реагенту А.
6.5.3. Бренстедовский кислотно-основный катализ
В бренстедовском кислотно-основном катализе катализа- торами являются бренстедовские кислоты HA и бренстедов- ские основания B. Они активируют реагенты путем их прото- нирования или депротонирования.
Примеры |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
А. Кислотный катализ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
I. Гидролиз сложных эфиров: |
|
|
|
|
|
|
O |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
1. |
R'COOR + AH |
|
|
|
|
|
|
|
R' |
|
C |
|
OHR + A- ; |
|||||||||
|
|
|
|
|
||||||||||||||||||
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2. |
H2O + C |
|
OHR |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
R' |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H2O1/2+ ... C ... O1/2+ HR  H2O+ C + ROH ;
H2O+ C + ROH ;
R' |
|
|
|
|
R' |
||
26
|
|
|
|
O |
|
A- |
|
|
|
|
|
|
3. |
H2O+ |
|
|
|
|
|
R'COOH + AH . |
|||||
|
C + |
|
|
|||||||||
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
|
|
|
|
|
II. Дегидратация спирта: |
|
+ |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
+ A− ; |
|
1. CH CH OH + AH ¾¾® CH CH OH |
||||||||||||
|
3 |
2 |
|
|
|
3 |
2 |
2 |
|
|||
|
|
+ |
|
|
|
|
|
|
+ |
|
||
2. |
CH3CH2 OH2 |
|
¾¾® H2O + CH3 CH2 ; |
|
||||||||
3. |
|
+ |
|
|
|
− |
¾¾® CH = CH + AH . |
|||||
CH CH + A |
||||||||||||
|
3 |
2 |
|
|
|
2 |
|
2 |
|
|
||
Б. Основный катализ
III. Разложение нитрамида:
1. NH2NO2 + B ¾¾® NHNO2− + BH+ ; 2. NHNO−2 ¾¾® N2O + OH− ;
3. OH− + BH+ ¾¾® H2O + B .
6.5.3.1. Общий и специфический кислотно-основный
катализ
В растворе слабой кислоты одновременно присутствуют несколько видов частиц, являющихся кислотами и основа- ниями: растворитель (например, H2O), неионизированная
форма кислоты AH, анион A− , протонированный раствори- тель (например, H3O+ ), гидроксильный ион OH− и т. д.
Если каждая из этих частиц является катализатором для превращения исходного вещества – субстрата S, то скорость необратимого превращения S в конечный продукт P описыва-
ется уравнением
W = kэф × CS , |
(6.26) |
где эффективная константа скорости Kэф равняется |
|
kэф = kH2O × CH2O + kH3O+ ×CH3O+ + kAH × CAH + |
|
+ kA− × CA − + kOH− ×COH− . |
(6.27) |
27
