
Лекции - часть 3
.pdf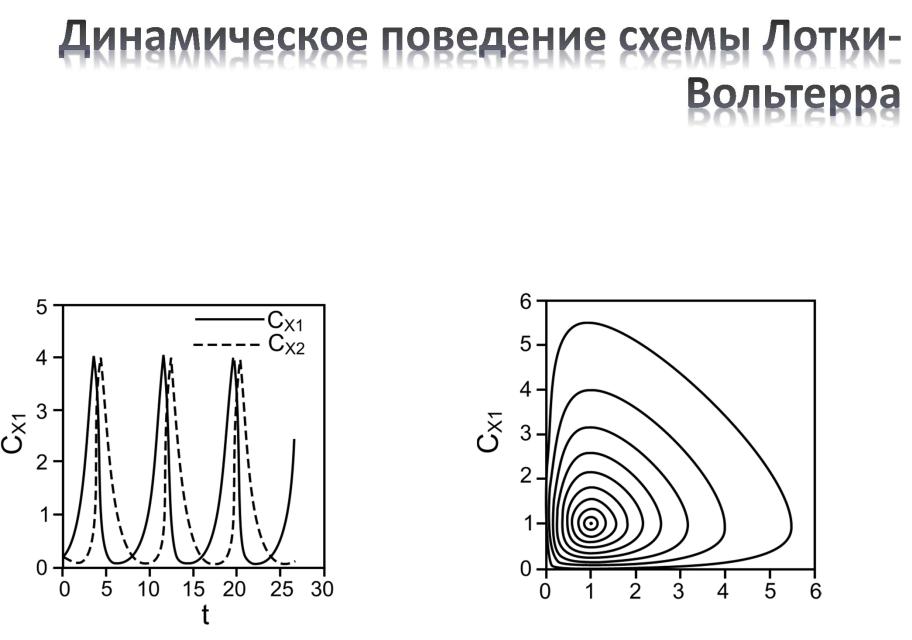
Зависимость [X], [Y] от времени |
Динамика системы на фазовой |
|
плоскости |
|
|
|
[X] |
|
|
|
|
|
[Y] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Концентрация |
|
|
|
[X] |
[Y]
61

1.Составляем систему кинетических уравнений
2.Находим стационарные состояния
3.Анализируем каждое стационарное состояние:
а. Вводим малое отклонение от стационара
b.Линеаризуем систему
c.Находим собственные значения
62

Собственные значения |
Тип особой точки |
Устойчивость |
|
|
|
|
|
Re( )=0, |
Im( ) 0 |
центр |
нет |
|
|
|
|
Re( )<0, |
Im( ) 0 |
устойчивый фокус |
ДА |
|
|
|
|
Re( )>0, |
Im( ) 0 |
неустойчивый фокус |
нет |
|
|
|
|
Re( )<0, |
Im( )=0 |
устойчивый узел |
ДА |
|
|
|
|
Re( )>0, |
Im( )=0 |
неустойчивый узел |
нет |
|
|
|
|
Re( 1)>0, |
Re( 2)<0 |
седло |
нет |
|
|
|
|
63

http://en.wikipedia.org/wiki/Belousov%E2%80%93Zhabotinsky_reaction
64

Орегонатор Филда-Нойеса
BrO |
Br 2H HBrO HOBr |
|
||||
3 |
|
|
2 |
|
|
|
HBrO Br H |
2HOBr |
|
|
|||
|
2 |
|
|
|
|
|
|
|
|
|
|
||
HBrO2 H |
H2O |
|||||
BrO3 |
|
2BrO2 |
||||
Ce3 BrO H Ce4 HBrO |
|
|||||
|
||||||
|
2 |
|
|
2 |
|
|
2HBrO2 BrO3 HOBr H MA Ce4 Ce3 H MA
A Y X P |
A BrO |
|
|
3 |
|
X Y 2P |
X HBrO2 |
|
A X 2X 2Z |
Y Br |
|
X X A P |
Z Ce4 |
|
B Z 0.5 f Y |
B MA, |
P HOBr |
65

1951 г. Открытие колебаний в реакции окисления лимонной кислоты броматом калия в присутствии Ce3+
1951 г. Статья отвергнута в «Журнале общей химии» с рецензией
«такого быть не может».
1955 г. Статья не принята в «Кинетика и катализ». Белоусов:
«нынешние учёные утратили уважение к фактам»
1961 г. Анатолий Жаботинский начинает аспирантскую работу по исследованию реакции Белоусова.
Реакция |
|
|
|
Реагенты продукты |
|
|
|
без автокаталитической стадии |
G |
|
Борис Павлович |
G |
|
Белоусов, 1893-1970. |
|
|
|
|
Сложная реакция |
|
|
|
Реагенты продукты |
|
|
|
с интермедиатами x, y и |
|
|
[y] |
автокаталитической |
t |
[x] |
стадией |
|
|
66 |
||
|
|
||
|
|
|

Катализ – изменение скорости химической реакции под действием веществ - катализаторов, многократно вступающих в промежуточное химическое взаимодействие с реагентами и восстанавливающих свой химический состав после каждого взаимодействия.
Без катализатора
R k P
k
|
d RK |
|
d K |
0 |
|
dt |
dt |
||
|
|
|
||
RK |
K const |
|||
С катализатором
k1 |
k2 |
|
|
R K RK P K |
|
k 1 |
k 2 |
Обычно катализатора << чем реагентов.
Полное количество катализатора неизменно (по определению)
67

k1 |
k2 |
|
|
R K RK P K |
|
k 1 |
k 2 |
ddtRK k1 R K k 2 P K k 1 RK k2 RK 0
RK K K 0
RK |
|
k1 R k 2 P |
|
|
|
|
K 0 , |
|
|
|
K |
|
|
|
|
k 1 k2 |
|
|
|
|
|
K 0 |
|
|
|
|
|
|
|
||||||||||||||
k |
R k |
1 |
k |
2 |
k |
2 |
P |
|
|
|
|
k |
R k |
1 |
k |
2 |
k |
2 |
P |
|
|
|
|
|
|
|
|||||||||||||||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
W k2 RK k 2 P K k2 |
|
|
k1 R k 2 P |
|
|
K 0 k 2 P |
|
|
|
k 1 k2 |
|
|
|
K 0 |
|||||||||||||||||||||||||||||
k |
R k |
1 |
k |
2 |
k |
2 |
P |
k |
R k |
1 |
k |
2 |
k |
2 |
P |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
||||||||
|
|
|
|
|
W |
|
|
|
k1k2 R k 1k 2 P |
|
K 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
k |
R k |
1 |
k |
2 |
k |
2 |
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
68

|
|
|
k1 |
|
|
|
|
k2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||||||
|
R K RK P K |
|
|
|
|
|
||||||||||
|
|
|
k 1 |
|
k 2 |
|
|
|
|
|
|
|||||
1. В стационарном режиме реакция имеет первый |
|
W |
k1k2 R k 1k 2 P |
K 0 |
|
|||||||||||
порядок по концентрации катализатора |
|
|
|
k1 R k 1 k2 k 2 P |
|
|||||||||||
2. Катализатор не |
W 0, |
|
k1k2 R k 1k 2 P 0 |
|
|
|
||||||||||
смещает равновесие |
|
P ec |
|
k1k2 |
|
K1c K2c exp RK0 |
K0 R0 exp P0 K0 |
|
|
|||||||
реакции |
|
|
|
RK0 |
||||||||||||
|
R ec |
k 1k 2 |
||||||||||||||
(но может селективно |
|
|
|
|
|
|
|
|
|
|
|
|||||
направлять реакцию |
|
|
|
|
|
|
|
|
|
P e |
|
|
|
|
|
|
по необходимому пути) |
|
|
0 |
0 |
|
|
|
|
|
|
|
|
||||
|
exp P |
R K |
R e |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Взаимодействие с |
|
|
пусть реакции необратимы, |
|
|
|
||||||||||
катализатором |
|
|
k 1 k 2 |
0 |
|
|
|
|
|
|
|
|
||||
уменьшает |
|
|
|
|
|
k1k2 R |
K |
|
|
|
|
|
|
|||
активационный барьер |
|
|
W |
|
|
|
|
|
|
|
||||||
лимитирующей стадии |
|
|
|
|
|
k1 R k2 |
|
0 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
69

ферменты – белковые молекулы с каталитически активным центром.
Схема Михаэлиса-Ментен
k1 |
k |
2 |
|
|
S E ES P E k 1
Уравнение Михаэлиса-Ментен
|
|
|
|
k k |
2 |
S |
|
|
E |
|
|
|
k2 |
E |
0 |
|
|
|
W |
|
||||
W |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
max |
|
||||
k |
S k |
|
k |
|
|
|
|
k 1 k2 |
|
|
|
|||||||||||||
|
|
|
0 |
|
|
|
|
|
|
|
KM |
|
||||||||||||
|
|
1 |
|
|
|
|
|
1 |
|
2 |
|
|
1 |
|
k S |
|
|
1 S |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
W |
|
k |
2 |
E |
, |
|
|
K |
M |
|
k 1 k2 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
max |
|
|
|
|
0 |
|
|
|
|
|
|
|
k1 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аналогично предыдущей схеме с k-2=0
Первый порядок по S – фермент в форме E.
Нулевой порядок по S – фермент в форме ES
70
