
- •Особенности строения пнс
- •Типы периферических нервных волокон
- •Клинические проявления поражений пнс
- •Кровоснабжение нервных волокон
- •Патоморфологические особенности заболеваний пнс
- •Для проверки своих знаний дайте ответы на следующие вопросы – в каждом вопросе можно выбрать только один ответ.
- •Правильные ответы:
- •Основные биологические эндогенные процессы и эндогенная защитная активность
- •Нейропротекция
- •Эксайтотоксичность
- •Воспаление
- •Апоптоз и апоптозоподобные процессы
- •Нейропластичность и восстановление нервной ткани при неврологических заболеваниях
- •Биологические аспекты восстановления нервной ткани
- •Фармакологическая поддержка процессов восстановления нервной ткани
Воспаление
Для большинства неврологических нарушений патологическая роль воспаления общепризнанна. Тщательно контролируемый процесс, занимающий пограничное состояние между физиологическими и патологическими механизмами, может стать достаточно деструктивным в случаях длительного течения или недостаточной регуляции. В то же время воспалительные клетки, как и медиаторы воспаления, играют важную роль в процессах репарации ткани.
Основными медиаторами положительного влияния воспаления на процессы нейропротекции и нейропластичности являются нейротрофические факторы. Masson et al. продемонстрировали участие нейротрофических факторов, выделяемых активированными клетками иммунной системы, в процессах нейропротекции и нейропластичности. Эти факторы способны действовать как напрямую, связываясь со специфическими рецепторами, так и посредством модуляции локального иммунного ответа. Arnett et al. и Marchetti et al. считают, что даже молекулы с выраженным провоспалительным действием, такие как фактор некроза опухоли a (ФНОa), обладают нейропротекторным и нейротрофическим действием (в случае активации R2субъединиц рецепторов).
Гематоэнцефалический барьер имеет очень низкую проницаемость для иммунокомпетентных клеток и молекул. Обычно в ЦНС иммунная реактивность регулируется клетками микроглии и астроцитами. Другие вещества могут проникать в ЦНС лишь в результате высокорегулируемых процессов, медиаторами которых выступают молекулы адгезии, хемокины, цитокины и матриксные металлопротеазы.
Апоптоз и апоптозоподобные процессы
Апоптоз – естественный физиологический процесс, направленный на поддержание определенного количества и качества клеток. При повреждении ДНК в клетке активируется ген р53. Такая клетка либо останавливается в фазе G1 клеточного цикла (при активации противоапоптозного белка bcl2) до восстановления поврежденной ДНК и затем повторяет свой клеточный цикл, либо при невозможности репарации ДНК происходит активация проапоптозного белка bax с последующей индукцией апоптоза. Если апоптоз не наступает, такая клетка начинает бесконтрольно делиться, в конечном счете формируя злокачественное новообразование.
Исходя из вышеизложенных утверждений о существовании взаимосвязи между патофизиологическими процессами и ЭЗА, можно сделать такие выводы.
1. Активация NMDAрецепторов оказывает положительное влияние на процессы нейропротекции и нейропластичности (при физиологически нормальной активации) и отрицательное (при гиперактивации) – путем усиления эксайтотоксичности, что приводит к развитию таких патологических процессов, как инсульт, травматические повреждения, нейродегенеративные заболевания.
2. Воспаление в целом оказывает негативное влияние, однако также может положительно воздействовать на процессы нейропротекции и нейропластичности посредством выделения нейротрофических факторов.
3. Апоптоз – естественный физиологический процесс, в то время как апоптозоподобная гибель – всегда патологический. Контроль апоптозоподобных процессов происходит как при помощи эндогенных механизмов, так и медикаментозно.
Таким образом, наилучшей стратегией терапевтической нейропротекции является применение плейотропных препаратов, модулирующих (но не подавляющих) патологические нарушения. Такие препараты должны подавлять эксайтотоксичность, развивающуюся при стимуляции внесинаптических NMDAрецепторов, уменьшать отрицательные и потенцировать положительные эффекты воспаления, а также предотвращать развитие апоптозоподобных процессов.
Разработка препаратов затруднена по ряду причин. Вопервых, применяются синтетические молекулы, не используемые при ЭЗА, обладающие лишь одним механизмом действия на сложные каскадные процессы. Поскольку такие молекулы ингибируют как отрицательные, так и положительные биологические механизмы патофизиологических процессов, представляется маловероятным создавать препараты на их основании с широким нейропротекторным действием. Вовторых, следует ужесточить методологию клинических исследований нейропротекторных средств. Grotta считает, что, несмотря на отсутствие согласующихся данных относительно эффективности нейропротекторных препаратов на основе таких синтетических молекул, в некоторых клинических исследованиях была показана их эффективность (в частности эритропоэтина, церебролизина и цитихолина).
Все вышеперечисленные молекулы с доказанной эффективностью обладают сходным действием: вследствие плейотропности механизмов действия они способны контролировать многие патофизиологические процессы биологических каскадных механизмов. Из всех таких молекул лишь нейротрофические факторы способны модулировать (но не подавлять) патофизиологические процессы, потенцируя их положительные эффекты.
Еще
одним преимуществом нейротрофических
факторов являются их уникальность
стимуляции процессов нейропротекции
и возможное переключение на стимуляцию
нейропластичности. Такое переключение
на стимуляцию пластических процессов
– необычайно важный терапевтический
эффект в лечении пациентов. Препараты,
обладающие таким свойством, называются
«мультимодальными», они способны
одновременно регулировать два и более
основных биологических процесса ЭЗА.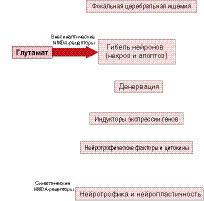
Применяемый в клинической практике мультимодальный препарат церебролизин содержит в своем составе активные фрагменты различных нейротрофических факторов. Известно, что при инсульте глутамат оказывает пагубное влияние от первых минут до нескольких часов после приступа (рисунок). Спустя 4872 часов глутамат становится главным индуктором процессов восстановления нервной ткани. Таким образом, мультимодальные средства должны быть способны переключаться с контроля процессов нейропротекции на контроль нейропластичности в пределах одного процесса ЭЗА.
