
- •Методическое указание по курсу “Физика”
- •2008 Г.
- •Введение
- •Как вести себя на зачетах и экзамене
- •Основные понятия и определения
- •1М 1650763,73λ0,
- •1С 9192631770t0,
- •Производные единицы системы си
- •Определения основных понятий в соответствии с din
- •Скалярные и векторные величины
- •Десятичные кратные и дольные единицы
- •Физические величины и единицы измерения
- •Методы измерений
- •Аналоговые и цифровые методы измерения
- •Непрерывные и дискретные методы
- •Метод отклонения и компенсационный метод
- •Погрешности измерений и причины погрешностей
- •Методы обработки экспериментальных результатов
- •Введение в практикум
- •Примеры оформления задач
- •Советы и указания
- •Выполнение работы и оформление отчета
- •20__ Г. План проведения занятия в лаборатории
- •Правила оформления раздела отчета по лабораторной работе
- •Таблицы
- •Построение графиков
- •Электроизмерительные приборы
- •Вспомогательные электрические приборы
- •Источники тока
- •Шкала приборов
- •Чувствительность и цена деления электроизмерительного прибора
- •Оценка погрешностей приборов
- •Пример оформления таблицы при использовании электроизмерительных приборов
- •Методические указания к выполнению лабораторных работ
- •Обработка результатов физических измерений Понятие об измерении
- •Виды погрешностей
- •Вычисление случайных погрешностей при измерениях
- •Вычисление погрешностей косвенных измерений
- •Приближенные вычисления
- •Графическое представление результатов измерений
- •Некоторые советы и указания
- •Описание приборов
- •Штангенциркуль
- •Микрометр
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № 2 Определение момента инерции махового колеса
- •Краткая теория
- •Порядок выполнения работы
- •Контрольные вопросы
- •Упражнение 1
- •Порядок выполнения работы
- •Упражнение 2
- •Упражнение 3
- •Порядок выполнения работы
- •Упражнение 4
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № 4 Определение момента инерции махового колеса методом колебаний
- •Краткая теория
- •Порядок выполнения работы
- •Контрольные вопросы
- •Порядок выполнения работы
- •Контрольные вопросы
- •Измерения и обработка результатов изменений
- •Порядок выполнения работы
- •Контрольные вопросы
- •Порядок выполнения работы
- •Контрольные вопросы
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № 9
- •Краткая теория
- •Описание установки и методика измерений
- •Порядок выполнения работы
- •Задачи уирс
- •Контрольные вопросы
- •Описание установки и методика измерений
- •Порядок выполнения работы
- •Контрольные вопросы
- •Поверхностное натяжение
- •Теория метода
- •Порядок выполнения работы
- •Контрольные вопросы
- •Описание метода
- •Порядок выполнения работы
- •Задачи уирс
- •Устройство вискозиметра впж–2
- •Порядок выполнения работ
- •Задачи уирс
- •Устройство вискозиметра вз-4
- •Порядок выполнения работ
- •Задачи уирс
- •Контрольные вопросы
- •Литература
- •Основные формулы
- •Пример оформления отчета по лабораторной работе Лабораторная работа № 6
- •Краткая теория
- •Вычисление искомых величин и расчет погрешностей
- •Графики
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа №2 Изучение резонанса напряжений
- •Краткая теория
- •§1 Вынужденные электрические колебания.
- •§2 Изменение амплитуды в контуре при изменении частоты внешнего воздействия.
- •§3 Фазовые резонансные кривые.
- •§4. Резонанс напряжений.
- •§5. Резонансные кривые.
- •Изучение резонанса напряжений.
- •Порядок выполнения работы
- •Обработка результатов
- •Контрольные вопросы
- •Литература
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Порядок выполнения
- •Контрольные вопросы
- •Порядок выполнения работы
- •Контрольные вопросы
- •2. Разрядка конденсатора
- •3. Схема экспериментальной установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Порядок выполнения работы
- •Контрольные вопросы
- •Порядок выполнения работы Проверка технического амперметра
- •Контрольные вопросы
- •Метод определения точки Кюри
- •Порядок выполнения работы
- •Контрольные вопросы
- •Метод тангенс–гальванометра
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Основные формулы
- •Пример оформления отчета по лабораторной работе Лабораторная работа № 1
- •Краткая теория
- •Вычисление искомых величин и расчет погрешностей
- •Графики
- •Описание поляриметра см
- •Принцип действия прибора
- •Порядок выполнения работы
- •Длины волн светофильтров
- •Контрольные вопросы
- •Литература
- •Лабораторная работа №2 Определение концентрации сахара
- •Краткая теория
- •Порядок выполнения работы
- •Контрольные вопросы
- •Описание установки использующей оптическую скамью
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа №4 Определения главного фокусного расстояния оптических систем
- •Краткая теория
- •Упражнение 1 Определение фокусного расстояния собирающей линзы
- •Порядок выполнения работы
- •Упражнение 2 Определение фокусного расстояния системы линз и рассеивающей линзы
- •Задачи уирс
- •Контрольные вопросы
- •Литература
- •Лабораторная работа №5 Определение показателя преломления с помощью рефрактометра
- •Краткая теория
- •Порядок выполнения работы
- •Контрольные вопросы
- •Описание метода
- •Порядок выполнения работы
- •Длины волн светофильтров
- •Контрольные вопросы
- •Литература
- •Лабораторная работа №7 Определение постоянной Стефана-Больцмана
- •Краткая теория
- •Закон Кирхгофа
- •Закон Вина
- •Формула Релея – Джинса
- •Формула Планка
- •Экспериментальная часть
- •Описание пирометра и подготовка к работе
- •Оценка температуры
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа №8 Определение относительной энергии абсолютно чёрного тела при различных температурах
- •Краткая теория
- •Закон Вина
- •Экспериментальная часть
- •Порядок выполнения работы
- •Контрольные вопросы
- •Экспериментальная часть
- •Порядок выполнения работы
- •Контрольные вопросы:
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа №11 Исследование температурной зависимости сопротивления металла и полупроводника
- •Краткая теория
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа №12 Изучение статических характеристик транзистора
- •Краткая теория
- •Вольтамперные статистические характеристики полупроводниковых транзисторов
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Основные формулы
- •Графики
- •Пример оформления отчета по лабораторной работе Лабораторная работа № 9
- •Краткая теория
- •Вычисление искомых величин и расчет погрешностей
- •Графики
- •Физические постоянные
- •Литература Основная
- •Дополнительная
- •Содержание
Литература
Трофимова Т.И. Курс физики: Учеб. пособие для вузов. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1990. – 478с.
Конспект лекций.
Лабораторная работа № 9
Определение отношений теплоемкостей методом Клемана–Дезорма
Цель работы:1.Определение отношения теплоемкостей для воздуха.
2.Сравнение полученных значений.
3. Проведение УИРС.
4.Вычислить погрешность измерения.
Приборы и принадлежности: закрытый стеклянный баллон, манометр, насос.
Краткая теория
Согласно молекулярно–кинетической теории, молярные теплоемкости идеальных газов при постоянном объеме Cv и при постоянном давлении Cp соответственно равны:
![]() (1)
(1)
![]() (2)
(2)
где i – суммарное число степеней свободы одной молекулы газа;
R – универсальная газовая постоянная.
Отсюда:
![]() .
(3)
.
(3)
Описание установки и методика измерений
Установка для опыта состоит из стеклянного баллона C, соединенного с открытым U–образным водяным манометром M и насосом N (рис.1). Накачать баллон воздухом, пока разность уровней жидкости в обоих коленах манометра не станет равной некоторому значению H. По истечению 2–3 минут температура воздуха в баллоне становится равной температуре окружающей среды. При этом объем моля газа будет V1, давление p1 и температура T1 (состояние 1 на рис.2). Открывая затем быстро кран В (зажим), на короткое время соединим баллон с окружающей средой. После этого давление в баллоне должно стать равным атмосферному давлению. Если процесс происходит достаточно быстро, его можно считать адиабатическим. Молярный объем теперь будет V2, давление p2 и температура T2 (состояние 2 на рис.2). При этом T2<T1, так как работа расширения газа совершается за счет его внутренней энергии.
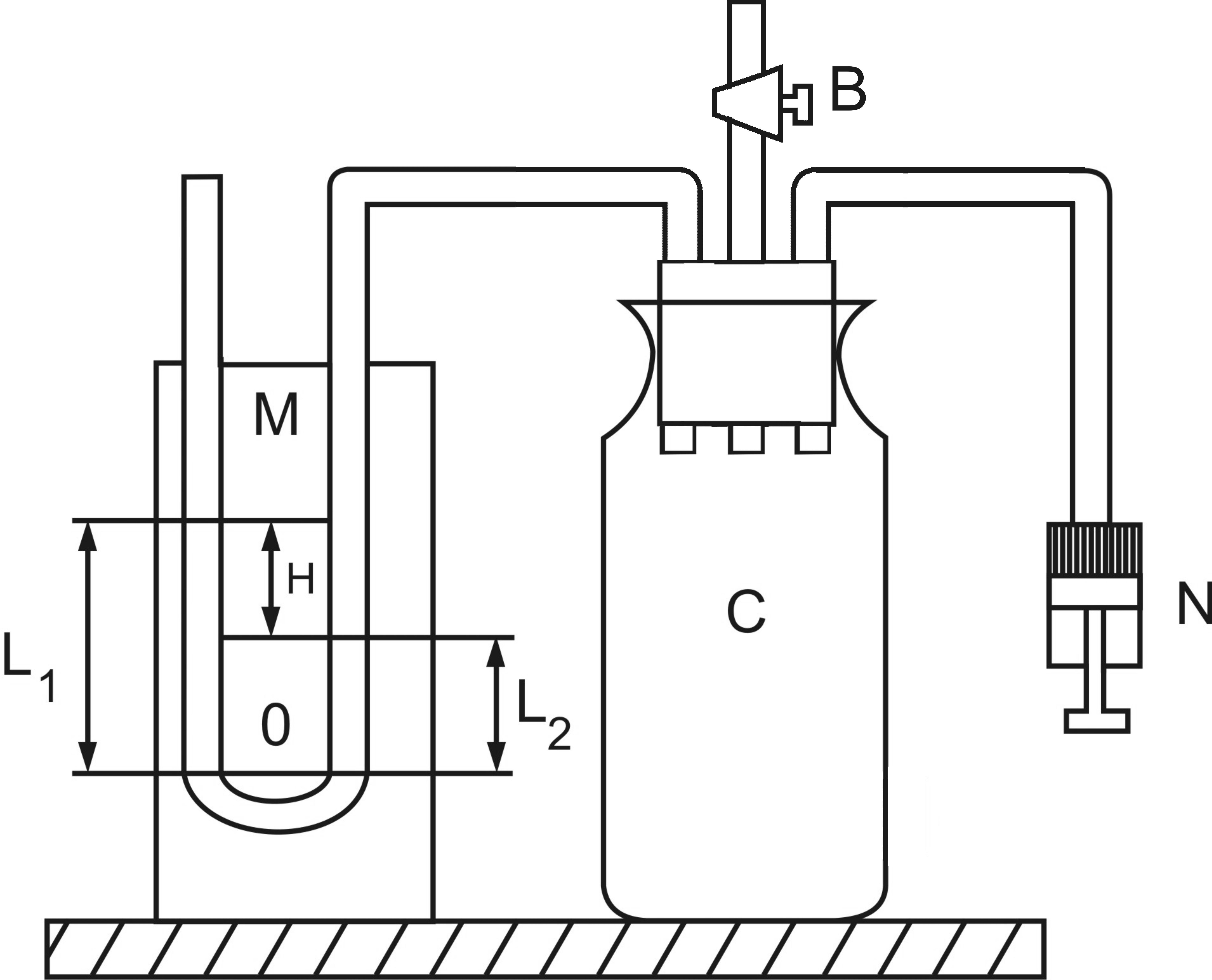
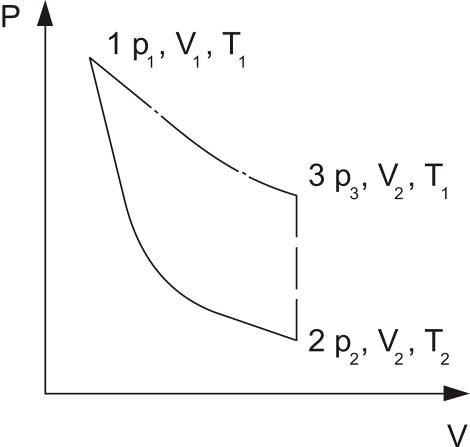
рис.1 рис.2
Для адиабатического перехода из первого состояния во второе справедливо уравнение Пуассона:
![]() .
(4)
.
(4)
После закрытия баллона воздух нагревается изохорически до комнатной температуры T1, причем давление повышается до величины p3 (состояние 3 на рис. 2).
Конечное состояние 3 и состояние 1 газа принадлежат одной и той же изотерме. Поэтому, применяя закон Бойля–Мариотта, имеем:
![]() .
(5)
.
(5)
Возведя уравнение (5) в степень и поделив на уравнение (4), имеем:
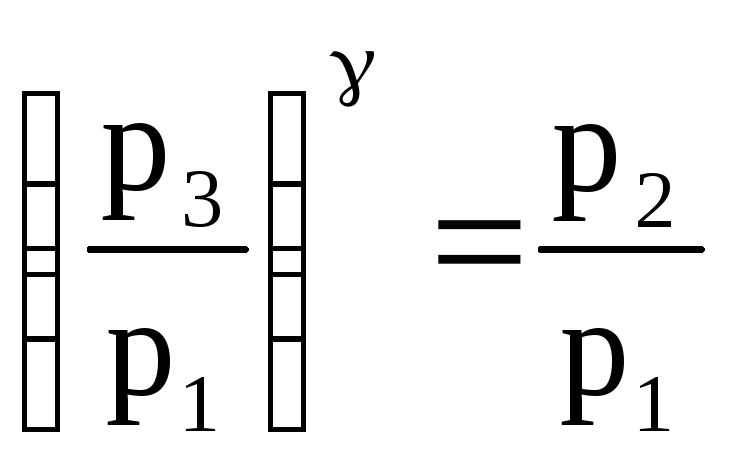 .
.
Логарифмируя последнее выражение, находим искомый коэффициент:
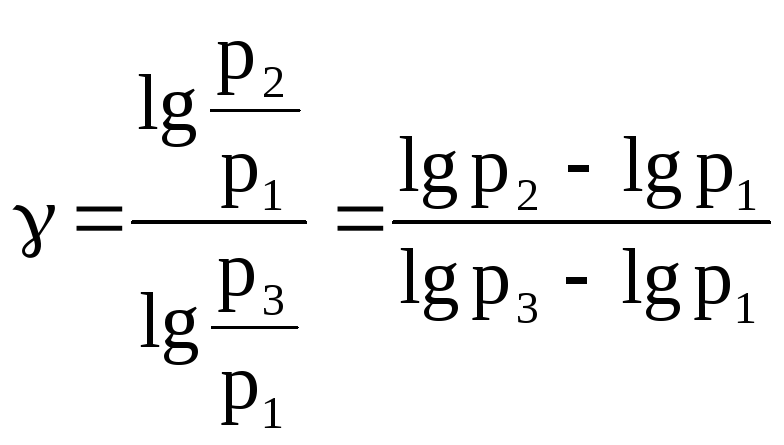 .
(6)
.
(6)
Обозначим разность уровней жидкости в манометре в первом состоянии через H, а в третьем состоянии через h:
![]() ;
;
![]() (7)
(7)
(![]() –переводной
коэффициент для перевода от разностей
уровней к давлению). Так как давлениеp1,
p2,
p3
мало отличаются друг от друга, то разность
логарифмов можно принять равной
пропорциональной разности самих
давлений:
–переводной
коэффициент для перевода от разностей
уровней к давлению). Так как давлениеp1,
p2,
p3
мало отличаются друг от друга, то разность
логарифмов можно принять равной
пропорциональной разности самих
давлений:
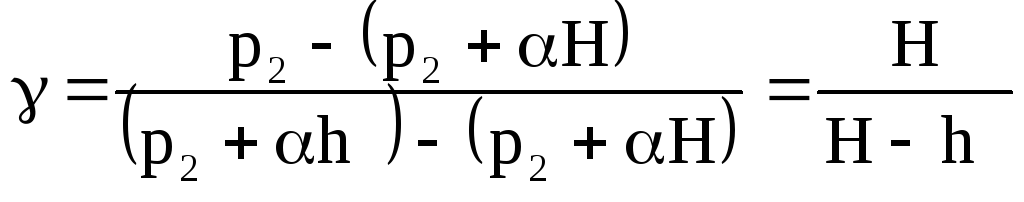 (8)
(8)
Величина h, входящая в формулу (8), получена в предположении, что кран В (зажим) закрывается в момент окончания адиабатического процесса 1–2 (рис.2).
