
Физика (Электричество)_ЛЕКЦИИ И ВОПРОСЫ / OF4_5_Диэлектрики_mini
.pdf4.5.Диэлектрики
4.5.1.Дипольный момент молекулы
4.5.2.Неполярные и полярные молекулы
4.5.3.Вектор электрической поляризации неполярного диэлектрика
4.5.4.Диэлектрические восприимчивость и проницаемость вещества
4.5.5.Поляризация полярных диэлектриков во внешнем электростатическом поле
4.5.6.Электростатическое поле на границе двух диэлектриков
4.5.7.Кристаллические диэлектрики. Изотропный и анизотропный кристаллические диэлектрики
4.5.8.Сегнетоэлектрики
4.5.9.Пьезоэлектрики
4.5.10.Пироэлектрики
4.5.11.Электреты, термоэлектреты, фотоэлектреты
© А.В. Бармасов, 1998-2013 |
1 |
12+ |
|
4.5.1. Дипольный моментнт молекулы
Диэлектрик – вещество, в котором затруднено перемещение зарядов по его объёму, или, другими словами, вещество, плохо проводящее электрический ток.
Дипольный момент молекулы µ характеризует электрические свойства молекулы:
μ ≡ ∑qi ri
i
© А.В. Бармасов, 1998-2013 |
2 |
12+ |
|
4.5.2. Неполярные и полярныерные молекулы
Если «центры тяжести» положительных и отрицательных зарядов совпадают, то дипольный момент µ такой системы равняется нулю. Такие молекулы называют неполярными.
Примеры неполярных молекул:
Водород H2, азот N2, кислород O2, четырёххлористый углерод CCl4, CH4, BF3, CO2.
Неполярные диэлектрики – вещества, молекулы которых в отсутствие внешнего электростатического поля не имеют электрического дипольного момента.
© А.В. Бармасов, 1998-2013 |
3 |
12+ |
|
Полярные молекулы
(Polar molecules)
Молекулы, обладающие дипольным моментом µ в отсутствие внешнего электростатического поля, называют полярными. Постоянный дипольный момент µ у них имеет порядок 10–29 ÷10 –30 Кл·м, что соответствует диполю, состоящему из двух противоположных зарядов в 1,6·10–19 Кл, расположенных на расстоянии 10–10 м друг от друга.
Примеры полярных молекул:
Окись углерода CO (0,40·10–30 Кл·м), бромистый водород
HBr (2,6·10–30 Кл·м), хлористый водород HCl (3,4·10–30 Кл·м), этиловый эфир (C2H5)2O (3,8·10–30 Кл·м), вода H2O (6,2·10–30 Кл·м), NH3.
Полярные диэлектрики – вещества, молекулы которых в отсутствие внешнего электростатического поля обладают определённым электрическим дипольным моментом.
© А.В. Бармасов, 1998-2013 |
4 |
12+ |
|
4.5.3. Вектор электрическойой поляризации неполярного диэлектрикаектрика
Способность диэлектриков поляризоваться – одно из их фундаментальных свойств. Под поляризацией здесь имеется в виду процесс, связанный с созданием в диэлектрике под действием электрического поля преимущественного направления индуцированных и собственных электрических диполей.
Электрическая поляризация может появиться в результате упорядоченного расположения заряженных частиц противоположных знаков. Наиболее простой случай упорядоченного расположения зарядов – электрический диполь. В структуре некоторых диэлектриков такие электрические диполи действительно имеются, и если они ориентированы в одном направлении – кристалл будет
спонтанно поляризованным.
Связанные заряды спонтанной поляризации при этом создают собственное электростатическое поле вне диэлектрика.
© А.В. Бармасов, 1998-2013 |
5 |
12+ |
|

Спонтанная поляризация
(Spontaneous polarization)
© А.В. Бармасов, 1998-2013 |
6 |
12+ |
|
Спонтанная поляризация
(Spontaneous polarization)
Известны два типа кристаллических диэлектриков, обладающих спонтанной поляризацией: пироэлектрики и сегнетоэлектрики. В пироэлектриках электрические диполи всех элементарных ячеек кристалла ориентированы в одном направлении, а в сегнетоэлектриках поляризации подвержены целые области (домены) со спонтанной поляризацией.
© А.В. Бармасов, 1998-2013 |
7 |
12+ |
|
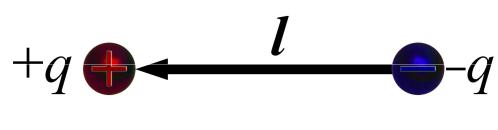
Электрический диполь
(Electric dipole)
Электрическим диполем называют систему, образованную двумя равными точечными зарядами противоположных знаков, жёстко связанными между собой и отстоящими друг от друга на расстоянии l, значительно меньшем, чем расстояние R до точки, в которой измеряется электростатическое поле.
Отрезок прямой, проходящей через заряды, называют осью диполя l.
© А.В. Бармасов, 1998-2013 |
8 |
12+ |
|
Поляризуемость
(Polarizability)
Поляризуемость атомов, ионов и молекул – способность этих частиц приобретать электрический дипольный момент в электрическом поле.
Атомная поляризуемость молекул обусловлена смещением в электрическом поле атомов разного типа в молекуле (что связано с индуцированным полем несимметричным распределением в молекуле электронной плотности).
Поляризация диэлектриков происходит в результате смещения связанных зарядов. Здесь мы имеем в виду обратимое смещение
– заряженные частицы атомов и молекул, как в поле, так и после его снятия продолжают принадлежать тем же самым атомам и молекулам. Такое смещение зарядов называется
упругим.
© А.В. Бармасов, 1998-2013 |
9 |
12+ |
|
Поляризуемость
(Polarizability)
Во внешнем электростатическом поле E0 молекулы неполярного диэлектрика поляризуются, т. е. в них нарушается симметрия взаимного расположения зарядов электронных облаков и ядер, и появляется индуцированный электрический момент, модуль которого при небольших электростатических полях E0 равен:
|
p |
′ |
|
′ |
|
(−β) E0 |
||||
|
|
= q l = εa |
||||||||
где εa – |
абсолютная диэлектрическая постоянная; l – ось |
|||||||||
диполя; |
β – коэффициент |
|
поляризуемости молекул |
|||||||
неполярного диэлектрика. |
p′ |
|
|
p′ |
|
|||||
|
−β ≡ |
|
|
|
= |
|
||||
|
|
ε |
E |
|
D |
|||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
a 0 |
|
|
|
|
© А.В. Бармасов, 1998-2013 |
10 |
12+ |
|
