
Методичка для медиков
.pdf
|
|
VKMnO4 Nщав.кисл. Vщав.кисл. ЭKMnO4 |
|
x |
NKMnO4 VKMnO4 |
1000 , |
|
|
VH2O |
||
|
|
|
где V - объем первоначально добавленного перманганата калия, мл;
KMnO4
VKMnO4 - объем перманганата калия, затраченного на титрование, мл;
VH2O - объем воды, взятой для анализа, мл.
Вопросы к защите работы
1.Почему при определении окисляемости воды применяют метод обратного титрования?
2.Как влияет окисляемость питьевой воды на здоровье человека?
3.Чем обусловлено несовпадение результатов отдельных титрований?
Йодометрия
В йодометрических методах в качестве титранта используются стандартные растворы йода или иодида калия. Метод основан на полуреакции:
I |
2 |
2e 2I ( E0 |
|
|
0,62 В), |
|
I2 |
2I |
|
||
|
|
|
|
||
или в присутствии иодид-ионов: |
|
|
|
||
I 2e 3I ( E0 |
|
|
0,54 В). |
||
|
3 |
|
3I |
|
|
|
|
I3 |
|
|
|
Из значений |
|
стандартных |
окислительно-восстановительных |
||
потенциалов видно, что I2 - окислитель средней силы, I - средней силы восстановитель, поэтому в йодометрии применяют окислительные свойства йода и восстановительные свойства иодидов. Йодометрия является универсальным методом и применяется для определения и окислителей, и восстановителей.
31
Йодометрическое титрование проводят в нейтральной, кислой или слабощелочной среде при рН 9, так как в щелочной среде протекает
реакция диспропорционирования, и образуется гипоиодид:
I2 2OH IO I H2O .
Гипоиодид является сильным окислителем, окисление титранта приводит к завышенным результатам титрования. Поэтому
анализируемый раствор подкисляют серной кислотой.
Титрование проводят на холоде, так как I2 - летучее соединение;
кроме того, при повышенной температуре понижается чувствительность индикатора.
Высокая точность йодометрии обусловлена применением специфического, чувствительного индикатора – крахмала. Амилоза,
входящая в состав крахмала, образует с йодом адсорбционно-комплексное соединение, окрашенное в синий цвет. Прочность комплекса зависит от
концентрации йода в растворе; чем она выше, тем устойчивее комплекс.
Особенность применения крахмала как индикатора заключается в том, что его добавляют в конце титрования, когда концентрация йода в пробе мала, и раствор имеет соломенно-желтую окраску. В присутствии крахмала раствор приобретает синюю окраску, титрование продолжают
до обесцвечивания раствора.
Йодометрическое определение восстановителей выполняют
методом прямого титрования. Титрант – раствор йода, который готовят растворением точной навески смеси I2 с KI ( I2 KI KI3) в
дистиллированной воде высокой степени очистки. Приготовленный раствор хранят в склянке из темного стекла во избежании окисления иодида и улетучивания йода.
32
Прямым йодометрическим титрованием определяют As3 , As5
(после предварительного восстановления), Sn2 , Hg 2 и другие металлы.
Индикатор – крахмал, который добавляют в начале титрования,
точку эквивалентности фиксируют по появлению синего окрашивания раствора от избыточной капли раствора йода.
Йодометрическое определение окислителей выполняют методом замещения по следующей схеме.
1. В колбу для титрования помещают избыток раствора KI , раствор подкисляют серной кислотой и добавляют анализируемый раствор окислителя.
Колбу с реакционной смесью накрывают часовым стеклом и помещают на 5 мин в затемненное место. При этом протекает реакция замещения, в результате которой образуется эквивалентное количество I2 .
2. Окрашенный в бурый цвет раствор йода титруют раствором тиосульфата натрия; индикатор – крахмал, который добавляют в конце титрования.
Препарат Na2S2O3 5H2O не относится к стандартным веществам,
так как его состав может не соответствовать химической формуле вследствие разрушения реагента ферментными тиобактериями и выветривания при хранении кристаллизационной воды. Кроме того,
раствор тиосульфата натрия неустойчив при хранении, подвержен автоокислению. Поэтому готовят рабочий раствор, точную концентрацию которого устанавливают при титрованию стандартного раствора дихромата калия.
ЛАБОРАТОРНАЯ РАБОТА №7
«Определение аскорбиновой кислоты в растворе» Аскорбиновую кислоту (витамин С) добавляют в напитки для
подкисления. Количественное определение аскорбиновой кислоты
33
основано на ее восстановительных свойствах. При взаимодействии с йодом она окисляется до дегидроаскорбиновой кислоты:
C6H8O6 I2 C6H6O6 2HI .
Для определения аскорбиновой кислоты применяют метод обратного титрования: к анализируемой пробе добавляют избыток йода,
после чего остаток не вступившего в реакцию с аскорбиновой кислотой йода титруют раствором тиосульфата натрия.
Цель работы: освоить методику обратного йодометрического титрования и определить аскорбиновую кислоту в растворе.
Реактивы и приюоры:
1.Раствор йода, С(1/2 I2)=0,0100 моль/дм3.
2.Стандартизированный раствор тиосульфата натрия, С(1/1
Na2S2O3)=0,0100 моль/дм3.
3.Раствор серной кислоты, С(1/2 H2SO4)=2,0 моль/дм3.
4.Раствор крахмала с массовой долей 0,5 %.
5.Бюретка вместимостью 25 мл; пипетки Мора вместимостью 5 и 20
мл; коническая колба для титрования вместимостью 25 мл; воронка
диаметром 3 см; часовое или покровное стекло; мерный цилиндр вместимостью 25 мл.
Ход работы. Получают от преподавателя мерную колбу вместимостью 200 или 250 мл с раствором аскорбиновой кислоты.
Доводят объем раствора в мерной колбе дистиллированной водой до метки. В колбу для титрования отбирают пипеткой Мора 20,00 или 25,00
мл раствора, добавляют с помощью мерного цилиндра 3-5 мл раствора серной кислоты, мерной пипеткой (или из бюретки) вводят 10,00 мл раствора йода, колбу прикрывают стеклом. В течение 5 мин аскорбиновая кислота окисляется, затем избыток йода оттитровывают раствором тиосульфата натрия из бюретки до перехода бурой окраски в светло-
34
желтую. Добавляют раствор крахмала и продолжают титрование до обесцвечивания раствора. Анализ повторяют до получения трех сходящихся результатов. Рассчитывают средний объем титранта,
затраченный на титрование.
Содержание аскорбиновой кислоты в мерной колбе (m, г)
вычисляют по формуле:
|
NI |
|
VI |
|
NNa S O |
|
|
|
Na2S2O3 Э(C6H8O6 ) |
|
|
|
|
|
|
|
V |
|
V |
||||||
m |
|
2 |
|
2 |
2 2 |
3 |
|
|
|
|
м.к |
. |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
1000 |
|
Vа.ч |
||||
КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Комплексонометрическое титрование - метод титрования с использованием комплексонов - полиаминополикарбоновых кислот, из титриметрических методов по своему значению и широкому применению,
безусловно, стоит на первом месте.
Комплексонометрическим титрованием можно определять почти все ионы металлов и анионы. Этот метод универсален. Однако универсальность его имеет некоторый недостаток, так как определению того или иного элемента в большинстве случаев могут мешать другие элементы. Поэтому приходится выбирать условия титрования или вводить некоторые маскирующие вещества, чтобы устранить влияние мешающих элементов. Если не помогают все эти способы, то приходится прибегать к предварительному отделению определяемого элемента от мешающих.
Широкое применение нашел один из комплексонов - двунатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА), называемый комплексоном III (раньше его называли трилоном Б). Сама кислота в воде растворяется плохо, что затрудняет ее использование. Отличительная особенность комплексона III заключается в том, что с ним все металлы,
35
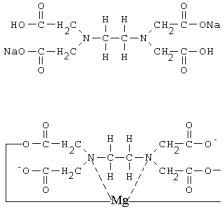
независимо от валентности, реагируют в отношении 1:1. Строение комплексона III:
Строение комплекса магния с ЭДТА:
Строение комплексов трехвалентного алюминия или четырехвалентного тория с ЭДТА точно такое же, что у комплекса магния, только у металла остается заряд + или 2+. Металл во всех случаях замещает два атома водорода в карбоксильных группах, и, кроме того,
соединяется координационными связями с атомами азота.
При образовании комплексных соединений металлов с ЭДТА среда становится кислой, что может мешать реакции. Поэтому в комплексонометрическом титровании для создания оптимальной среды всегда применяют буферные растворы - в слабокислой среде ацетатные, а
в щелочной - аммиачные.
Для фиксирования конечной точки титрования в комплексонометрии применяют металлохромные индикаторы. Использование их основано на том, что они образуют с определяемыми металлами окрашенные комплексные соединения менее устойчивые, чем с ЭДТА. Комплексы металлов с индикатором по окраске отличаются от свободного индикатора. В процессе титрования сначала с ЭДТА взаимодействуют свободные ионы металла, только после этого ЭДТА разрушает окрашенный комплекс металла с индикатором и титруемый раствор приобретает окраску индикатора.
36
Наиболее часто применяются следующие индикаторы:
а) эриохром черный Т - для комплексонометрического титрования магния, марганца, цинка, кадмия и некоторых других металлов;
б) мурексид - для комплексонометрического титрования кальция,
меди, никеля и кобальта;
в) сульфосалициловая кислота как лучший металлохромный индикатор для трехвалентного железа;
Поскольку все металлы, независимо от валентности, реагируют с ЭДТА в отношении 1:1, концентрацию раствора ЭДТА и растворов металлов для обратного титрования выражают в моль/л.
Вопросы для самопроверки
1.Какие ионы определяют комплексонометрическим методом в кислой среде, какие – в щелочной? Привести примеры.
2.Какие аналитические приемы используются при титровании ЭДТА сложных смесей катионов?
3.Какие из металлохромных индикаторов: а) эриохром черный Т, б)
ксиленоловый оранжевый, в) пирокахетиновый фиолетовый – используют при титровании раствором ЭДТА в кислой среде?
4. Какие специфические индикаторы используются при комплексонометрическом титровании (ЭДТА) катионов: а) Fe3+; б) Bi3+?
ЛАБОРАТОРНАЯ РАБОТА №7
«КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ
ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ»
Различают временную, постоянную и общую жесткость воды.
Временная жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния. Временной названа она потому, что может быть устранена кипячением воды. Постоянная жесткость обусловлена
37
присутствием сульфатов и хлоридов магния и кальция. Общая жесткость складывается из временной и постоянной жесткости.
Жесткость воды выражают суммой миллимолей ионов кальция и магния в 1 л воды. Она может колебаться в широких пределах: до 4
ммоль/л – мягкая вода, 4-8 – средней жесткости, 8-12 – жесткая, выше 12
– очень жесткая.
Цель. 1. Провести титрование водопроводной воды стандартным раствором ЭДТА.
2. Определить общую жёсткость воды.
Реактивы и приборы:
1.Бюретка вместимостью 25 мл со штативом;
2.Воронка;
3.Коническая колба вместимостью 300 мл;
4.Мерная колба вместимостью 25 или 50 мл;
5.Мерный цилиндр на 25 мл;
6.Аммиачный буферный раствор с pH=9,0;
7.Стандартный раствор ЭДТА (если концентрация раствора ЭДТА неизвестна, то необходимо установить точную концентрацию по стандартному раствору сульфата магния);
8.Индикатор – эриохром чёрный Т, сухой препарат.
Ход работы. Общую жесткость определяют так. В коническую колбу вместимостью 300 мл отбирают пипеткой 25 мл водопроводной воды,
прибавляют 50-70 мл дистиллированной воды, 5 мл аммиачного буферного раствора и немного индикатора эриохром черного Т. В
бюретку наливают 0,01 М раствор комплексона III, предварительно сполоснув бюретку этим раствором. Приготовленный раствор титруют до перехода винно-красной окраски в синюю без фиолетового оттенка. Если добавлено очень много индикатора, то переход окраски трудно заметить.
38

Тогда надо разбавить титруемый раствор небольшим количеством дистиллированной воды. В конце титрование проводят медленно,
тщательно перемешивая раствор после добавления каждой капли комплексона III. Общую жесткость воды рассчитывают по следующей формуле:
Q CЭДТА VЭДТА 1000,
VH2O
где Q – жёсткость воды, ммоль/л; СЭДТА - молярная концентрация раствора ЭДТА, моль/л; VЭДТА - объем раствора ЭДТА, пошедший на титрование, мл; 1000 - число для пересчета объема на 1 (1000 мл); VH2O - объем отобранной для анализа водопроводной воды, мл.
Вопросы к защите работы
1.Можно ли провести определение общей жесткости воды в кислой среде?
2.На чем основано действие эриохрома черного Т как индикатора?
3.Какой вывод можно сделать о жесткости водопроводной воды?
ТИПОВЫЕ РАСЧЕТНЫЕ ЗАДАЧИ
При решении задач рекомендуется соблюдать следующую
последовательность:
1.Написать уравнение химической реакции (равновесия) в ионной
форме.
2.Концентрацию веществ выразить в моль/л, применяя следующие формулы:
39
C |
m 1000 |
; С |
1000 |
|
10 |
, |
|
M V(мл) |
M 100 |
M |
|||||
|
|
|
|
где m – масса растворенного вещества, г; M – молярная масса, г/моль; -
плотность раствора, г/мл; V- объём раствора, мл; - массовая доля
растворённого вещества, %.
3.Записать выражение константы равновесия и найти её численное значение.
4.Подставить равновесные концентрации в выражение для константы равновесия.
5.Выполнить расчёт.
I. Вычисление величины рН в растворах электролитов Пример 1.
Вычислить рН 0,0018%-ного раствора соляной кислоты.
Решение.
Найдем |
молярную |
|
концентрацию |
HCl, |
учитывая, |
что |
|||||
M |
|
36,5 г/моль: |
C |
|
|
0,0018 1000 1 |
|
5 10 4 |
моль/л. |
|
|
HCl |
HCl |
100 36,5 |
|
||||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||
Соляная кислота – сильный электролит, в воде она распадается на ионы
полностью: |
HCl H |
2 |
O Cl H O , поэтому концентрация ионов |
|
|
3 |
водорода будет равна концентрации кислоты. Тогда,
40
