
Основы физической химии_Ерёмин
.pdf
318 |
Г л а в а |
5. Химическая кинетика |
||||||
|
Скорость образования продукта: |
|
|
|
||||
|
r = |
d[D] |
= k2 [B] = |
k1 |
k2 |
[A] . |
||
|
dt |
|
|
k−1 |
+ k2 |
|||
|
|
|
|
|
|
|||
Таким образом, мы выразили скорость реакции через концентрацию исходного вещества, установили порядок реакции (первый) и выразили эффективную константу скорости через константы скорости отдельных элементарных реакций.
Пример 22-2. Реакция конверсии пара-водорода в орто-водород протекает по следующему механизму (M – инертная частица):
п-H2 + M → H + H + M (k1), H + п-H2 → H + о-H2 (k2), H + H + M → п-H2 + M (k3).
Используя метод стационарных концентраций, получите выражение для скорости конверсии пара-водорода.
Решение. Из второго уравнения следует, что скорость образования орто-водорода равна:
r = k2 [H] [п-H2].
Для того, чтобы решить задачу, надо исключить из этого выражения концентрацию неустойчивого вещества – атомов водорода. Это можно сделать, приняв, что она не изменяется со временем:
d[H]dt = 2k1[п-H2 ] [M] − 2k3[H]2[M] ≈ 0 ,
откуда
[H] = |
k1 [п-H2 ] |
. |
|
||
|
k3 |
|
При оценке скорости изменения концентрации [H] мы учли, что в первой и третьей реакциях образуются и расходуются по два атома H, а во второй реакции число атомов H не изменяется. Подставляя концентрацию [H] в выражение для скорости реакции, получаем окончательный результат:
r = k2 |
|
k1 |
1/ 2 [п-H 2 ]3/ 2 . |
|
|||
|
k3 |
|
|
Из этого результата мы видим, как в сложной реакции может получиться дробный порядок.

320 |
|
Г л а в а 5. Химическая кинетика |
|
|
|||
|
|
откуда следует, что скорость образования азота равна скорости второй |
|||||
|
|
реакции: |
|
|
|
|
|
|
|
r = k2 [N2O2] [H2]. |
|
|
|||
|
|
Равновесие в реакции образования N2O2 устанавливается быстро, по- |
|||||
|
|
этому к N2O2 можно применить квазиравновесное приближение: |
|||||
|
|
K = |
|
k1 = |
[N 2 O2 ] , |
|
|
|
|
|
k−1 |
[NO]2 |
|
|
|
|
|
Подставляя квазиравновесную концентрацию [N2O2 ] в выражение |
|||||
|
|
для скорости второй реакции, находим скорость образования азота: |
|||||
|
|
r = d[N2 ] |
= k1k2 [NO]2 [H 2 ] . |
|
|
||
|
|
dt |
|
k−1 |
|
|
|
|
|
Это выражение полностью соответствует экспериментальному ки- |
|||||
|
|
нетическому закону с эффективной константой скорости k = k1 k2 / k–1. |
|||||
|
|
Пример 22-5. Щелочной гидролиз ацетилхлорида – необратимая |
|||||
|
|
реакция, состоящая из двух элементарных процессов: |
|
|
|||
|
|
CH3C(O)Cl + OH– → интермедиат (I) → продукты |
|
||||
|
|
|
|
|
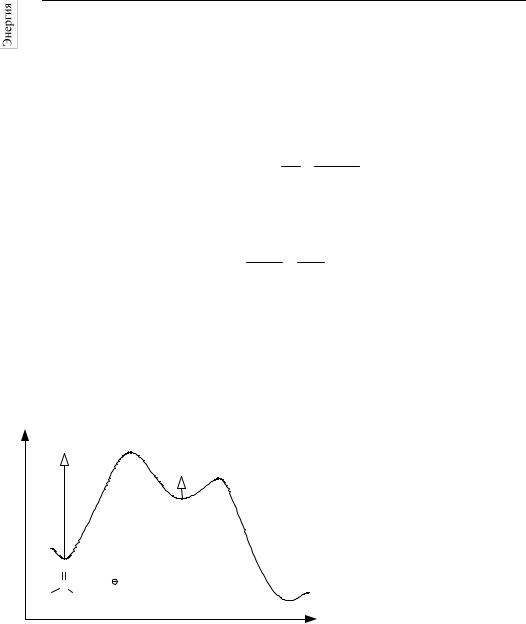
Энергетическая |
диаграм- |
|
|
|
|
|
|
ма этой реакции приведена на |
||
|
|
|
|
|
рисунке. |
|
|
|
|
|
|
|
Определите |
лимитирую- |
|
|
|
E2 |
|
|
щую стадию реакции. Выве- |
||
E1 |
|
|
|
|
дите кинетическое уравнение |
||
|
|
|
|
|
для данной реакции и опреде- |
||
|
|
|
|
|
лите ее общий порядок. Как |
||
O |
|
|
|
|
связана общая |
энергия акти- |
|
|
|
|
|
вации реакции E с энергиями |
|||
C |
+ |
OH |
|
|
|||
|
|
активации отдельных стадий |
|||||
H3C |
Cl |
|
|
|
|||
|
|
|
|
|
(E1 и E2)? |
|
|
|
|
Координата реакции |
|
|
Решение. Энергетический |
||
|
|
|
|
барьер на первой стадии на- |
|||
|
|
|
|
|
|||
|
|
|
|
|
много больше, чем на второй, |
||
|
|
следовательно интермедиат медленно образуется и быстро расходуется. |
|||||
|
|
Лимитирующая стадия – первая. В этих условиях можно применить |
|||||
|
|
квазистационарное приближение: |
|
|
|
||
r = k2 [I] = k1 [CH3 C(O)Cl] [OH − ] .
Скорость реакции равна скорости лимитирующей стадии; общий порядок реакции – второй. Эффективная константа скорости и энергия активации реакции равны соответствующим величинам для первой ста-
дии: k = k1, E = E1.

Г л а в а 5. Химическая кинетика |
321 |
ЗАДАЧИ
22-1. Механизм некоторой ферментативной реакции имеет вид:
E + S |
k1 |
ES |
k2 |
E + P . |
|||
|
|
|
|
||||
k-1 |
k-2 |
||||||
|
|
|
|||||
Используя метод квазистационарных концентраций для комплекса фермента с субстратом, выразите скорость образования продукта через текущие концентрации фермента, субстрата и продукта.
22-2. Для реакции NO2Cl → NO2 + 1/2Cl2 предложен следующий двухстадийный механизм:
NO2Cl → NO2 + Cl, (k1) NO2Cl + Cl → NO2 + Cl2. (k2)
Используя метод квазистационарных концентраций, выведите уравнение для скорости разложения NO2Cl.
22-3. Для реакции синтеза иодоводорода из простых веществ H2 + I2 → → 2HI предложен следующий механизм:
I2 → 2I, (k1) 2I → I2, (k2)
2I + H2 → 2HI. (k3)
Используя квазиравновесное приближение, выведите уравнение для скорости образования HI и покажите, что данная реакция имеет второй порядок.
22-4. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
активация: |
A + A → A* + A, (k1) |
дезактивация: |
A + A* → A + A, (k–1) |
распад: |
A* → продукты. (k2) |
Используя метод квазистационарных концентраций, выведите уравнение для скорости мономолекулярной реакции и определите порядок реакции при больших и малых концентрациях [A].
22-5. Для тримолекулярной реакции 2NO + O2 → 2NO2 предложен следующий механизм:
2NO (NO)2, (k1, k–1) (NO)2 + O2 → 2NO2. (k2)
Определите порядок суммарной реакции, предполагая, что первая стадия – быстрая, а вторая – медленная.
322 |
Г л а в а 5. Химическая кинетика |
22-6. Конденсация ацетона (CH3)2CO в водном растворе катализируется основаниями, которые обратимо реагируют с ним с образованием карбаниона C3H5O–. Карбанион реагирует с молекулой ацетона и дает продукт реакции. Упрощенный механизм выглядит так:
AH + B → A– + BH+, (k1) A– + BH+ → AH + B, (k2)
A– + AH → продукт. (k3)
Используя метод стационарных концентраций, найдите концентрацию карбаниона и выведите уравнение дляскорости образования продукта.
22-7. Составьте кинетические уравнения для следующего механизма газофазной реакции:
AB,
B+ C → D.
Определите скорость образования продукта в приближении квазистационарных концентраций. Покажите, что при высоких давлениях реакция может протекать по первому порядку, а при низких давлениях – по второму порядку.
22-8. Химическая реакция N2O → N2 + 1/2O2 протекает по следующему механизму (M – инертная частица):
N2O + M → N2O* + M, (k1) N2O* → N2 + O, (k2)
N2O* + M → N2O + M, (k3) N2O + O → N2 + O2. (k4)
Считая концентрации N2O* и O стационарными, найдите выражение для скорости распада N2O.
22-9. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N2O5(г) → 4NO2(г) + O2(г) при следующем механизме реакции:
N2O5 → NO2 + NO3, (k1) NO2 + NO3 → N2O5, (k–1)
NO2 + NO3 → NO2 + O2 + NO, (k2) NO + N2O5 → 3NO2. (k3)
22-10. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N2O5(г) → 4NO2(г) + O2(г) при следующем механизме реакции:
N2O5 → NO2 + NO3, (k1) NO2 + NO3 → N2O5, (k–1)
NO2 + NO3 → NO2 + O2 + NO, (k2) NO + NO3 → 2NO2. (k3)
Указание. Интермедиаты – NO и NO3.
Г л а в а 5. Химическая кинетика |
323 |
22-11. Дана схема цепной реакции:
AH → A + H, (k1) A → B + C, (k2)
AH + B → A + D, (k3) A + B → P. (k4)
Назовите стадии зарождения, развития и обрыва цепи. Используя метод квазистационарных концентраций, покажите, что образование продукта P описывается кинетическим уравнением первого порядка.
22-12. Дана кинетическая схема:
CH4 + M → CH3 + H + M, (k1) CH3 + CH4 → C2H6 + H, (k2) H + CH4 → H2 + CH3, (k3)
H + CH3 + M → CH4 + M. (k4)
(M – инертная молекула). Используя метод квазистационарных концентраций, выразите скорость образования этана через концентрацию метана.
22-13. Реакция разложения бромметана 2CH3Br → C2H6 + Br2 может протекать по следующему механизму:
CH3Br → CH3 + Br, (k1)
CH3 + CH3Br → C2H6 + Br, (k2)
Br + CH3Br → CH3 + Br2, (k3) 2CH3 → C2H6. (k4)
Используя метод стационарных концентраций, найдите выражение для скорости образования этана.
22-14. Термическое разложение углеводорода R2 протекает по следующему механизму:
R2 → 2R, (k1)
R + R2 → PB + R', (k2) R' → PA + R, (k3)
2R → PA + PB. (k4)
где R2, PA, PB – устойчивые углеводороды, R и R' – радикалы. Найдите зависимость скорости разложения R2 от концентрации R2.
22-15. Дана кинетическая схема разложения ацетальдегида:
CH3CHO → CH3 + CHO, (k1)
CH3 + CH3CHO → CH4 + CH2CHO, (k2) CH2CHO → CO + CH3, (k3)
CH3 + CH3 → C2H6. (k4)
324 |
Г л а в а 5. Химическая кинетика |
Используя приближение стационарных концентраций, получите выражение для скорости образования метана и скорости расходования ацетальдегида.
22-16. Реакцию радикального дегидрирования этана можно описать с помощью механизма Райса–Герцфельда, который включает следующие стадии:
инициирование: CH3CH3 → 2CH3, (k1)
развитие цепи: CH3 + CH3CH3 → CH4 + CH3CH2, (k2)
CH3CH2 → CH2=СH2 + H, (k3)
H + CH3CH3 → H2 + CH3CH2, (k4) обрыв цепи: H + CH3CH2 → CH3CH3. (k5)
Найдите уравнение для скорости образования этилена, если константа k1 мала. Как можно изменить условия, чтобы изменился порядок?
22-17. Дана кинетическая схема дегидрирования этана:
C2H6 → 2CH3, (k1)
CH3 + C2H6 → CH4 + C2H5, (k2) C2H5 → H + C2H4, (k3)
H + C2H5 → C2H6. (k4)
Используя приближение стационарных концентраций, получите выражение для скорости образования этилена.
22-18. Химическая реакция 2C2H6 → C4H10 + H2 протекает по следующему механизму:
C2H6 → C2H5 + H, (k1)
H + C2H6 → C2H5 + H2, (k2) C2H5 + C2H6 → C4H10 + H, (k3) 2C2H5 → C4H10. (k4)
Используя метод стационарных концентраций, получите выражение для скорости образования бутана.
22-19. Дана кинетическая схема радикального хлорирования тетрахлорэтилена в растворе CCl4:
Cl2 → 2Cl, (k1)
Cl + C2Cl4 → C2Cl5, (k2) C2Cl5 + Cl2 → Cl + C2Cl6, (k3) 2C2Cl5 → C2Cl6 + C2Cl4. (k4)
Используя приближение стационарных концентраций, получите выражение для скорости образования гексахлорэтана.
22-20. Реакция образования фосгена CO + Cl2 → COCl2 может протекать по следующему механизму:
Cl2 → 2Cl, (k1)
2Cl → Cl2, (k2)
Г л а в а 5. Химическая кинетика |
325 |
CO + Cl → COCl, (k3)
COCl → CO + Cl, (k4)
COCl + Cl2 → COCl2 + Cl. (k5)
Используя метод стационарных концентраций, найдите выражение для скорости образования фосгена.
22-21. При низких температурах скорость реакции CO(г) + NO2(г) → → CO2(г) + NO(г) описывается кинетическим уравнением:
r = k [NO2]2.
Предложите возможный механизм для этой реакции.
22-22. Для реакции Канниццаро 2RCHO + OH– → RCOO– + RCH2OH предложен следующий механизм:
RCHO + OH– RCH(OH)O–, (k1, k–1) RCH(OH)O– + OH– RCHO22– + H2O, (k2, k–2)
RCH(OH)O– + RCHO → RCOO– + RCH2OH, (k3) RCHO22– + RCHO → RCOO– + RCH2O–.. (k4)
Найдите выражение для скорости образования соли карбоновой кислоты, используя квазиравновесное приближение для первых двух реакций. Чему равен порядок этой реакции:
а) при малой, б) при большой концентрации щелочи?
22-23. Скорость реакции Cl2(г) + CHCl3(г) → CCl4(г) + HCl(г) описывается кинетическим уравнением: r = k [Cl2]1/2 [CHCl3]. Для этой реакции был предложен механизм:
Cl2 → 2Cl, (k1)
2Cl → Cl2, (k–1)
CHCl3 + Cl → CCl3 + HCl, (k2) CCl3 + Cl → CCl4. (k3)
Вторая и четвертая реакции – быстрые, третья – медленная. Совместим ли этот механизм с экспериментальным кинетическим уравнением?
22-24. Для реакции брома с метаном Br2 + CH4 → CH3Br + HBr предложен механизм:
инициирование: Br2 + M → 2Br + M, (k1)
развитие цепи: Br + CH4 → CH3 + HBr, (k2)
Br2 + CH3 → CH3Br + Br, (k3)
HBr + CH3 → CH4 + Br, (k4) обрыв цепи: 2Br + M → Br2 + M, (k5)
где М – любая молекула, константы скорости k3 и k4 близки по величине. Используя квазистационарное приближение, найдите выражение для


 уст. двойная спираль .
уст. двойная спираль .