
Основы физической химии_Ерёмин
.pdf
Г л а в а 5. Химическая кинетика |
297 |
20-3. Какой должна быть энергия активации, чтобы скорость реакции увеличивалась в 3 раза при возрастании температуры на 10 °С:
а) при 300 К;
б) при 1000 К?
20-4. Реакция первого порядка имеет энергию активации 25 ккал моль–1 и предэкспоненциальный множитель 5 1013 с–1. При какой температуре время полураспада для данной реакции составит:
а) 1 мин; б) 30 дней?
20-5. Энергия активации реакции, приводящей к скисанию молока, равна 75 кДж моль–1. При температуре 21 °С молоко скисает за 8 ч. Как долго можно хранить молоко в холодильнике при температуре 5 °С? Время скисания можно принять обратно пропорциональным константе скорости.
20-6. В каком из двух случаев константа скорости реакции увеличивается в большее число раз: при нагревании от 0 °С до 10 °С или при нагревании от 10 °С до 20 °С? Ответ обоснуйте с помощью уравнения Аррениуса.
20-7. Используя дифференциальную форму уравнения Аррениуса, выведите связь между энергиями активации прямой и обратной реакций, в предположении, что прямая и обратная реакции – элементарные.
20-8. Энергия активации некоторой реакции в 1.5 раза больше, чем энергия активации другой реакции. При нагревании от T1 до T2 константа скорости второй реакции увеличилась в a раз. Во сколько раз увеличилась константа скорости первой реакции при нагревании от T1 до T2?
20-9. Константа скорости сложной реакции выражается через константы скорости элементарных стадий следующим образом:
k = k1k2 . k3
Выразите энергию активации и предэкспоненциальный множитель сложной реакции через соответствующие величины, относящиеся к элементарным стадиям.
20-10. В необратимой реакции первого порядка за 20 мин при 125 °С степень превращения исходного вещества составила 60%, а при 145 °C такая же степень превращения была достигнута за 5.5 мин. Найдите константы скорости и энергию активации данной реакции.
298 |
Г л а в а 5. Химическая кинетика |
20-11. Реакция первого порядка при температуре 25 °С завершается на 30% за 30 мин. При какой температуре реакция завершится на 60% за 40 мин, если энергия активации равна 30 кДж моль–1?
20-12. Реакция первого порядка при температуре 25 °С завершается на 70% за 15 мин. При какой температуре реакция завершится на 50% за 15 мин, если энергия активации равна 50 кДж моль–1?
20-13. Константа скорости реакции первого порядка равна 4.02 10–4 с–1 при 393 К и 1.98 10–3 с–1 при 413 К. Рассчитайте предэкспоненциальный множитель для этой реакции.
20-14. Для газофазной реакции HI + CH3I → CH4 + I2 энергия активации равна 140 кДж моль–1. Константа скорости при 227 °С равна 3.9 10–3 л моль–1 с–1. Рассчитайте константу скорости при 310 °С. При какой температуре константа скорости будет равна 1.0 10–3 л моль–1 с–1?
20-15. Для реакции
H2 + I2 → 2HI
константа скорости при температуре 683 К равна 0.0659 л моль–1 мин–1, а при температуре 716 К – 0.375 л моль–1 мин–1. Найдите энергию активации этой реакции и константу скорости при температуре 700 К.
20-16. Для реакции
2N2O → 2N2 + O2
константа скорости при температуре 986 К равна 6.72 л моль–1 мин–1, а при температуре 1165 К – 977.0 л моль–1 мин–1. Найдите энергию активации этой реакции и константу скорости при температуре 1053.0 К.
20-17. Трихлорацетат-ион в ионизирующих растворителях, содержащих H+, разлагается по уравнению
H+ + CCl3COO– → CO2 + CHCl3.
Стадией, определяющей скорость реакции, является мономолекулярный разрыв связи C−C в трихлорацетат-ионе. Реакция протекает по
первому порядку, и константы скорости имеют следующие значения: k = 3.11 10–4 с–1 при 90 °С, k = 7.62 10–5 с–1 при 80 °С. Рассчитайте:
а) энергию активации, б) константу скорости при 60 °С.
20-18. Используя справочные данные, рассчитайте период полураспада бромэтана на этилен и бромоводород при:
а) 100 °С; б) 400 °С.

Г л а в а 5. Химическая кинетика |
299 |
20-19. Используя справочные данные, рассчитайте период полураспада иодоводорода на иод и водород при начальной концентрации 0.05 моль л–1 и температуре:
а) 600 °С; б) 900 °С.
20-20. Раскручивание двойной спирали ДНК – реакция первого порядка с энергией активации 420 кДж моль–1. При 37 °С константа скорости равна 4.90 10–4 мин–1. Рассчитайте период полупревращения ДНК при
37 и 40 °С.
20-21. Для реакции
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
константа скорости при температуре 282.6 К равна 2.307 л моль–1 мин–1, а при температуре 318.1 К – 21.65 л моль–1 мин–1. Найдите энергию активации этой реакции и константу скорости при температуре 343 К.
20-22. Для реакции
C12H22O11 + H2O → C6H12O6 + C6H12O6
константа скорости при температуре 298.2 К равна 0.765 л моль–1 мин–1, а при температуре 328.2 К – 35.5 л моль–1 мин–1. Найдите энергию активации этой реакции и константу скорости при температуре 313.2 К.
20-23. Вещество разлагается двумя параллельными путями с константами скорости k1 и k2. Какова разность энергий активации этих двух ре-
акций, если при 10 °C k1/k2 = 10, а при 40 °C k1/k2 = 0.1?
20-24. В двух реакциях одинакового порядка разница энергий активации составляет E2 – E1 = 40 кДж моль–1. При температуре 293 К отношение констант скорости равно k1/k2 = 2. При какой температуре константы скорости сравняются?
20-25. Зависимость константы скорости разложения фосфина 4PH3 → P4 + 6H2 от температуры выражается уравнением:
lg k = − 1896T + 2 lg T + 12.130.
Рассчитайте опытную энергию активации этой реакции при 800 К.
20-26. Разложение ацетондикарбоновой кислоты в водном растворе – реакция первого порядка. Измерены константы скорости этой реакции при разных температурах:
t, °С |
0 |
20 |
40 |
60 |
k 105, с–1 |
2.46 |
47.5 |
576 |
5480 |

302 |
Г л а в а 5. Химическая кинетика |
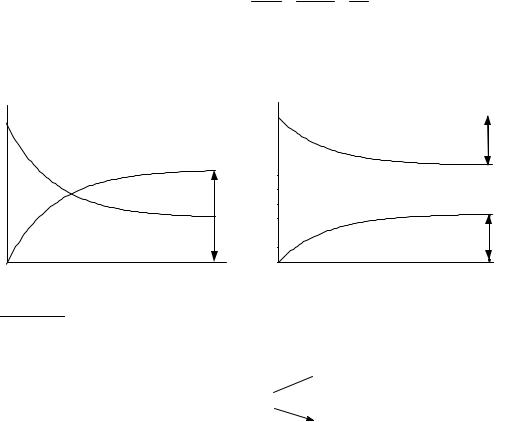
Уравнения (21.3) для обратимой реакции первого порядка имеют такой же вид, как и для необратимой реакции (18.3), (18.4) с той разницей, что вместо начальной концентрации фигурирует равновесная, а константу скорости необратимой реакции заменяет сумма констант для прямой и обратной реакций.
При t → ∞ наступает равновесие, которое характеризуется константой:
|
(21.5) |
K = |
[B]∞ |
= b + x∞ |
= k1 . |
|
|
|
[A]∞ |
a − x∞ |
k−1 |
|
|
Кинетические кривые для обратимых реакций первого порядка при- |
|||
|
|
ведены на рис. 21.1. |
|
|
|
|
|
(1) |
|
|
(1) |
a |
AA VBB |
a |
|
|
|
|
|
|
|
|
x∞ |
c |
|
B |
c |
|
A |
|
|
A |
B |
||
|
|
A |
|
|
Aς B |
|
|
|
|
B |
|
|
|
x∞ |
|
|
x∞ |
|
|
t |
|
|
t |
|
Рис. 21.1 |
Зависимость концентраций реагента и продукта от времени |
|||
|
|
для обратимой реакции первого порядка: (1) K > 1; (2) K < 1 |
|||
2. Параллельные реакции:
k1 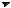 B
B
A k2
D .
Кинетическое уравнение записывается с учетом принципа независимости:
(21.6) |
dx |
= k1 (a − x) + k2 (a − x) . |
|
dt |
|||
|
|
Решение этого уравнения записывается так же, как и для одной реакции первого порядка:
(21.7.а) |
(k1 + k2 )t = ln |
a |
|
, |
|
a − x |
|||||
|
|
|
|||
(21.7.б) |
[A] = a − x = a exp[−(k1 |
+ k2 )t]. |
|||
|
|
|
|
|
Г л а в а 5. Химическая кинетика |
303 |
|||
|
Для |
|
параллельных |
реак- |
a |
AA→T B |
|
||
|
|
|
|
||||||
ций в любой момент времени |
|
A T D |
|
||||||
отношение концентраций про- |
|
A → D |
|
||||||
c |
B |
|
|||||||
дуктов постоянно и определя- |
|
|
|||||||
|
|
|
|||||||
ется |
константами |
скорости |
|
D |
|
||||
элементарных стадий: |
|
|
|
||||||
|
|
|
|
||||||
[B] |
= |
k1 |
. |
|
(21.8) |
|
A |
|
|
[D] |
k |
|
|
|
t |
|
|||
|
2 |
|
|
|
|
|
|||
|
Кинетические кривые для |
Зависимость концентраций реагентов и |
|
||||||
|
продукта от времени для параллельных |
|
|||||||
случая двух параллельных ре- |
|
||||||||
|
реакций первого порядка, k1 > k2 |
Рис. 21.2 |
|||||||
акций первого порядка приве- |
|
|
|
||||||
дены на рис. 21.2. |
|
|
|
|
|
||||
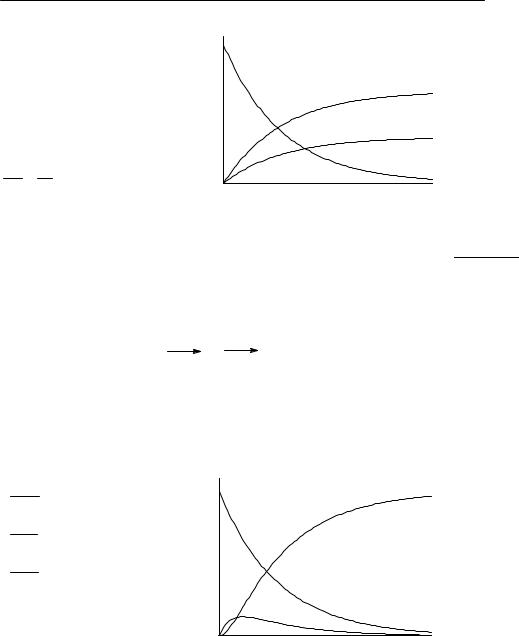
3. Последовательные реакции:
A |
k1 |
B |
k2 |
D . |
|
|
К таким реакциям относится, например, гидролиз сложных эфиров дикарбоновых кислот.
Пусть в начальный момент времени есть только вещество A. Применим к этой системе закон действующих масс и принцип независимости химических реакций:
d[A] |
= −k1[A] |
|
a |
D |
|
|
dt |
|
|
||
|
|
|
A |
||
d[B] |
= k1[A] − k2 [B] |
(21.9) |
|
|
|
|
dt |
|
|
||
|
|
|
c |
A → B → D |
|
d[D] |
= k2 [B] |
|
|
A T B T D |
|
|
|
|
|||
|
dt |
|
|
|
|
с начальными условиями |
|
B |
|||
[A]0 = a, [B]0 = [D]0 = 0. |
|
|
t |
||
|
|
|
|
|
|
Решение |
этой |
системы |
Зависимость концентраций веществ |
Рис. 21.3 |
||||
дает |
концентрации |
веществ |
от времени в системе двух |
|||||
|
||||||||
|
||||||||
как |
функции |
времени (рис. |
последовательных реакций |
|
||||
21.3): |
|
|
|
|
первого порядка при k1 / k2 = 0.2 |
|
||
|
|
|
|
|
|
|||
|
|
[A] = a exp(−k1t) |
|
|||||
|
|
|
|
|
k1 |
|
|
|
|
|
|
|
|
[exp(−k1t) − exp(−k2 t)] |
(21.10) |
||
|
|
[B] = a |
|
|
||||
|
|
k2 |
− k1 |
|||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
[D] = a − [A] − [B] . |
|
|||||
304 |
Г л а в а 5. Химическая кинетика |
|
|
|
|
|||||
|
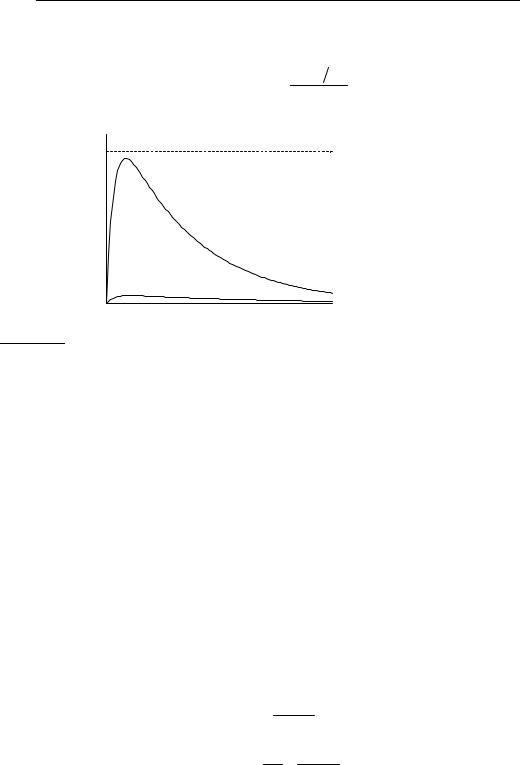
Концентрация промежуточного вещества B достигает максимума при |
|||||||||
(21.11) |
tmax = |
ln (k2 |
k1 ) |
. |
|
|
|
|
||
|
k2 |
− k1 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
Величина |
этого |
мак- |
||
|
a |
|
|
|
|
симума определяется |
от- |
|||
|
|
|
|
|
ношением констант k2 / k1. |
|||||
|
|
|
|
|
|
|||||
|
A → B → D |
|
|
|
|
Если оно мало, то проме- |
||||
|
|
|
|
|
жуточный продукт быстро |
|||||
|
A T B T D |
|
|
|
|
|||||
|
[B] |
|
|
|
|
накапливается и медленно |
||||
|
k1 >> k2 |
|
|
|
|
расходуется, |
его |
макси- |
||
|
|
|
|
|
мальная |
концентрация |
||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
почти достигает исходной |
||||
|
k1 << k2 |
|
|
|
|
концентрации |
реагента a. |
|||
|
t |
|
|
|
|
Если же оно велико, т.е. |
||||
|
|
|
|
|
k2 >> k1, то промежуточ- |
|||||
Рис. 21.4 |
Зависимость концентрации |
|
|
|
|
ный продукт |
не |
успевает |
||
|
промежуточного продукта от времени |
|
накапливаться и его кон- |
|||||||
|
в системе двух последовательных реакций |
|
||||||||
|
|
центрация |
в |
любой |
мо- |
|||||
|
при различных соотношениях констант |
|
||||||||
|
скорости первой и второй стадий |
|
|
мент времени мала (рис. |
||||||
|
|
|
|
|
|
21.4). В этом случае для |
||||
|
анализа кинетических уравнений можно использовать приближенный |
|||||||||
|
метод квазистационарных концентраций (или, что то же, квазиста- |
|||||||||
|
ционарное приближение – см. § 22). |
|
|
|
|
|
|
|
||
|
Кинетическая кривая для продукта D имеет S-образную форму с |
|||||||||
|
точкой перегиба. Как нетрудно показать из системы уравнений (21.9), |
|||||||||
|
время достижения точки перегиба равно tmax (21.11), то есть совпадает с |
|||||||||
|
временем достижения максимума [B]. До точки перегиба продукт D на- |
|||||||||
|
капливается с ускорением, а после нее скорость его образования посто- |
|||||||||
|
янно уменьшается. При малых временах концентрация D настолько ма- |
|||||||||
|
ла, что его нельзя обнаружить в системе. Время, в течение которого |
|||||||||
|
продукт практически отсутствует в системе, называют индукционным |
|||||||||
|
периодом. Его продолжительность зависит от чувствительности метода, |
|||||||||
|
применяемого для обнаружения вещества D. |
|
|
|
|
|||||
|
Если промежуточный продукт B неустойчив, то есть k1 < k2, то че- |
|||||||||
|
рез какое-то время слагаемым exp(–k2t) в (21.10) можно пренебречь, |
|||||||||
|
тогда |
k1 |
|
|
|
|
|
|
|
|
(21.12.а) |
[B] = a k2 |
|
exp(−k1t) , |
|
|
|
|
|||
− k1 |
|
|
|
|
||||||
(21.12.б) |
[B] |
= |
|
k1 |
, |
|
|
|
|
|
[A] |
k2 |
|
|
|
|
|
|
|||
|
|
− k1 |
|
|
|
|
|
|||
|
то есть отношение концентраций промежуточного продукта и реагента |
|||||||||
|
становится постоянным; такое состояние называют переходным равно- |
|||||||||
Г л а в а 5. Химическая кинетика |
305 |
весием. Если же первая константа скорости намного меньше второй, то есть k1 << k2, то в (21.12.б) можно пренебречь величиной k1 в знаменателе1, что приводит к выражению:
[B] |
|
= |
k1 |
= |
τ 2 |
. |
(21.12.в) |
|
[A] |
k2 |
τ1 |
||||||
|
|
|
|
|||||
Это означает, что отношение концентраций промежуточного этого соединения и реагента равно отношению их периодов полураспада. Такое состояние называют вековым равновесием. Оно устанавливается при временах, много больших периода полураспада промежуточного соединения, t >> τ2.
Для более сложных типов параллельных, последовательных и обратимых реакций, включающих реакции второго порядка, методы анализа остаются такими же, однако решения кинетических уравнений обычно имеют намного более сложный вид (некоторые из них можно найти в разделе «Задачи»), а в некоторых случаях они допускают только численные решения (см., например, задачу 21-31).
ПРИМЕРЫ
Пример 21-1. Для обратимой реакции первого порядка
k1
A  B
B
k-1
константа равновесия K = 8, а k1 = 0.4 с–1. Вычислите время, при котором концентрации веществ A и B станут равными, если начальная концентрация вещества B равна 0.
Решение. Из константы равновесия находим константу скорости обратной реакции:
k−1 = kK1 = 08.4 = 0.05 с–1.
По условию, мы должны найти время, за которое прореагирует ровно половина вещества A. Для этого надо подставить значение x(t) = a/2 в решение кинетического уравнения для обратимых реакций (21.3.б) и (21.4.б):
t = |
|
1 |
ln |
x∞ |
= |
|
1 |
ln |
|
2k1 |
= |
1 |
ln |
0.8 |
= 1.84 |
c. |
|
(k1 |
+ k−1 ) |
x∞ − x |
(k1 |
+ k−1 ) |
k1 |
− k−1 |
0.45 |
0.35 |
|||||||||
|
|
|
|
|
|
|
|
1Обычно считают, что одним слагаемым можно пренебрегать по сравнению
сдругим, если они отличаются более чем на два порядка величины, то есть, в нашем случае k1 / k2 < 10–2.


 B .
B . B
B D
D