
Биомедицина практика
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
МОЛЕКУЛЯРНАЯ
БИОМЕДИЦИНА
Часть 2
Учебное пособие для вузов
Воронеж Издательский дом ВГУ
2014
Утверждено научно-методическим советом биолого-почвенного факультета 15 мая 2014 г., протокол № 9
Составители: О.А. Сафонова, А.А. Агарков, М.В. Лущик, А.В. Семенихина, Т.Н. Попова, Т.И. Рахманова
Рецензент профессор кафедры биофизики и биотехнологии Воронежского государственного университета, д-р биол. наук, профессор Т.А. Ковалева
Учебное пособие подготовлено на кафедре медицинской биохимии и микробиологии биолого-почвенного факультета Воронежского государственного университета.
Рекомендуется для студентов биолого-почвенного факультета 4-го курса очной и очно-заочной форм обучения, для магистрантов 1-го года обучения.
Для направлений 020400 – Биология (бакалавриат); и 020400м – Биология (магистратура)
2
СОДЕРЖАНИЕ |
|
Генетическая диагностика.................................................................................. |
4 |
Введение............................................................................................................... |
4 |
Выделение и анализ нуклеиновых кислот........................................................ |
5 |
Качественный анализ нуклеиновых кислот......................................... |
5 |
Количественный анализ нуклеиновых кислот..................................... |
5 |
Некоторые ферменты, применяемые в молекулярной диагностике.............. |
6 |
Нуклеазы и их применение.................................................................... |
6 |
Ингибиторы РНКаз и их практическое применение........................... |
7 |
Рестриктазы............................................................................................. |
7 |
Гибридизационные методы................................................................................ |
8 |
Метод гибридизации в растворе.......................................................... |
11 |
Метод гибридизации на твердом носителе........................................ |
11 |
Гибридизация in situ ............................................................................. |
11 |
Блот-гибридизация................................................................................ |
13 |
Блот-гибридизация по Саузерну......................................................... |
14 |
Метод сэндвич-гибридизации ............................................................. |
15 |
Метод разветвленной ДНК.................................................................. |
16 |
Методы амплификации нуклеиновых кислот................................................ |
16 |
Полимеразная цепная реакция............................................................. |
17 |
Лигазная цепнаяреакция..................................................................... |
32 |
Молекулярнаядиагностикагенныхболезней................................... |
33 |
Методыпервичнойидентификациимутаций.................................... |
33 |
Молекулярноесканированиеизвестныхмутаций............................. |
38 |
МетодПЦР/ЛОЗ.................................................................................... |
40 |
ИспользованиеДНК-биочипов............................................................ |
42 |
Биоинформатика................................................................................................ |
44 |
Целиизадачибиоинформатики...................................................................... |
45 |
Прикладнаяобластьбиоинформатики............................................................ |
47 |
Анализгомологичностипоследовательностей.................................. |
47 |
Разработкалекарственныхпрепаратов............................................... |
47 |
Прогнозирующиефункции.................................................................. |
48 |
Примечаниявмедицине....................................................................... |
48 |
Биоинформатикапоследовательностей.............................................. |
49 |
Структурнаябиоинформатика............................................................. |
51 |
Компьютернаягеномика...................................................................... |
53 |
Применениенекоторыхметодованализадляполучения |
|
новыхбиологическихзнаний.............................................................. |
55 |
Разработкановыхметодованализабиологическихданных............ |
59 |
Разработкановыхбазданных.......................................................................... |
61 |
Открытиелекарственныхпрепаратовифармакоинформатика................... |
64 |
Открытиелекарственныхпрепаратов................................................. |
64 |
Определениеопытногосоединения.................................................... |
66 |
Программыпоиска............................................................................................ |
69 |
3
ГЕНЕТИЧЕСКАЯ ДИАГНОСТИКА
Введение
Среди большого числа исследовательских методов и новых технологий, обогативших клиническую медицину за последние десятилетия, важное место принадлежит разработке и практическому внедрению современных молекулярно-генетических методов. Они основаны на непосредственном анализе молекул ДНК и РНК. На основании анализа данных молекул возможно проведение ранней и более полной диагностики ряда инфекционных заболеваний, идентификация организмов (в частности, по следам крови, спермы и других тканей), а также выявление генных (хромосомных) мутаций (в том числе и пренатальное), что необходимо для решения ряда клинических и фундаментальных задач.
Исходным материалом для проведения ДНК-диагностики заболеваний, обусловленных мутациями ядерных генов, могут служить любые клетки организма, содержащие ядро. Обычно для этих целей используют лейкоциты, выделяемые из 5–20 мл периферической крови. В некоторых случаях (например, при митохондриальных болезнях, обусловленных мутациями митохондриальной ДНК с преимущественной экспрессией мутации в мышечной ткани) более адекватным источником ДНК являются биоптаты мышц. Генодиагностика может также проводиться на основе исследования ДНК, выделяемой из клеток эпителия полости рта, кожных фибробластов и т.д. При проведении пренатальной ДНК-диагностики у плода (обычно на 10–21-й неделе беременности) источником ДНК служат биоптаты хориона, плаценты, клетки амниотической жидкости или лимфоциты пуповинной крови плода.
При выявлении инфекционных заболеваний исходным материалом может служить сыворотка крови, моча, мокрота, соскобы мочеполовых путей и т.д.
Большинство методов анализа структуры фрагментов ДНК и РНК осуществляется с помощью различных методик электрофореза (ЭФ) в агарозном или полиакриламидном (ПАА) гелях. В подобранных стандартных условиях именно подвижность молекул нуклеиновых кислот (НК) при электрофорезе является ключевым анализируемым параметром, зависящим от конкретных характеристик изучаемого фрагмента (например, от его величины или конформации).
Для визуализации молекул ДНК по результатам проведенного ЭФ могут использоваться окраска их нитратом серебра, бромистым этидием (дающим характерное красноватое свечение при исследовании в проходящем УФ-свете) или мечение различными флюорохромами (дающими флюоресценцию определенной длины волны при возбуждении лазерным лучом). Для окраски РНК можно также применять толуидиновый синий, метиленовый синий.
4
Более сложный метод визуализации ДНК – авторадиография – основан на введении радиоизотопной метки в состав анализируемых макромолекул; по окончании ЭФ на гель с радиоактивно мечеными молекулами ДНК накладывается рентгеновская пленка, и положение различных фрагментов ДНК в геле определяется в виде соответствующих полос на проявленной пленке.
Выделение и анализ нуклеиновых кислот
Для выделения ДНК (РНК) из клеток их необходимо предварительно лизировать (например, с помощью воздействия высокой температуры или детергентами). Пробоподготовка проводится также с целью удаления клеточных белков, в частности, различных РНКаз. Для депротеинизации используют 2 метода: 1) обработка белков протеазами (например, протеиназой К) в присутствии ЭДТА и детергентов (например, саркозила); 2) денатурация и экстракция органическими растворителями (например, фенолом и хлороформом). Из водных растворов геномную ДНК можно осадить добавлением этанола или изопропанола. К настоящему времени также разработаны специальные сорбенты для осаждения ДНК (РНК) из раствора.
Для одновременного лизиса клеток и денатурации всех клеточных белков (в том числе РНКаз) можно использовать гуанидинтиоцианат – сильный денатурирующий агент.
Конечный размер получающихся фрагментов ДНК (РНК) зависит от действия клеточных нуклеаз и механического разрушения НК в процессе выделения.
После выделения ДНК и/или РНК и до проведения дальнейших исследований необходимо определить чистоту препаратов и размер молекул. При наличии загрязнений повторно проводят обработку протеиназой К и экстракцию фенолом/хлороформом. ДНК должна быть достаточно высокомолекулярной, чтобы можно было проводить планируемые эксперименты, а РНК должна быть интактной.
Качественный анализ нуклеиновых кислот
ДНК (одно– и двухцепочечные) и РНК при ЭФ движутся в геле со скоростью, обратно пропорциональной десятичному логарифму их молекулярной массы. При этом одноцепочечные молекулы движутся быстрее, чем двухцепочечные той же длины. Поскольку молекулярная масса НК пропорциональна их длине (в парах нуклеотидов или в тысячах пар нуклеотидов), можно построить стандартную кривую зависимости расстояния, на которое перемещается маркерный фрагмент, от десятичного логарифма длины этого фрагмента. С ее помощью можно определять размеры фрагментов нуклеиновых кислот в данном препарате по расстоянию, на которое они перемещаются при электрофорезе.
5
Количественный анализ нуклеиновых кислот
Для определения концентрации ДНК и РНК в растворе наиболее широко используется 2 метода. Более простым и точным является спектрофотометрический метод, однако он обладает сравнительно малой чувствительностью. Если общее содержание нуклеиновых кислот невелико, то концентрацию ДНК и РНК можно определить по интенсивности их флуоресценции в УФ-свете после окрашивания бромистым этидием.
1. Спектрофотометрический метод Концентрацию нуклеиновых кислот в растворе можно рассчитать,
измерив его оптическую плотность (D) при 260 нм. Одна единица D примерно соответствует концентрации двухцепочечной ДНК 50 мкг/мл и концентрации одноцепочечной ДНК и РНК 40 мкг/мл. Для оценки чистоты образцов можно использовать отношение между D при 260 и 280 нм. Для чистых препаратов ДНК и РНК оно должно быть равно соответственно 1,8 и 2. Если это соотношение меньше, значит, препараты загрязнены белками или фенолом, и оценка концентрации будет неверна.
2. Окрашивание бромистым этидием А) Электрофоретический метод
Для примерной оценки концентрации препаратов ДНК или РНК на гель наносят разные количества маркерных нуклеиновых кислот. Концентрацию исследуемых ДНК или РНК в образце оценивают, сравнивая интенсивность флуоресценции образца и стандартных маркеров с известной концентрацией. При этом важно, чтобы образцы ДНК и РНК сравнивались с соответствующими маркерами, поскольку при одинаковом количестве ДНК и РНК интенсивность их флуоресценции в УФ-свете различается.
Б) Метод пятен Концентрацию нуклеиновых кислот в растворе можно определить, ок-
расив раствор бромистым этидием, измерив интенсивность флуоресценции в УФ-свете и сравнив ее с флуоресценцией маркеров известной концентрации. Как и при электрофоретическом методе, маркеры должны представлять собой нуклеиновые кислоты соответствующего типа (т.е. ДНК или РНК).
Для количественного определения РНК можно использовать также орциновый метод, ДНК – дифениламиновый.
Некоторые ферменты, применяемые в молекулярной диагностике
Нуклеазы и их применение
Нуклеазы – ферменты, расщепляющие нуклеиновые кислоты до моно- и олигонуклеотидов, по характеру своего действия относятся к фосфодиэстеразам. Концевые мононуклеотиды отщепляются экзонуклеазами; расщепление внутри полинуклеотидной цепи осуществляют эндонуклеазы. Нуклеазы могут расщеплять РНК или ДНК (в соответствии с чем разделяют РНКазы и ДНКазы), а также и те, и другие (неспецифические нуклеазы).
6
В лабораториях нуклеазы применяют для очистки препаратов от нуклеиновых кислот определенного вида, для установления структуры исследуемых нуклеиновых кислот, изучения механизма их распада и синтеза.
Нуклеазы в молекулярной клинической диагностике применяют:
1)для обеспечения отрицательного контроля в результате удаления нуклеиновой кислоты-мишени;
2)при обработке РНКазой повышается специфичность гибридизации ДНК-ДНК, а при обработке ДНКазой – специфичность анализа РНК;
3)для проверки специфичности зонда – обработка перед гибридизацией РНКазой должна приводить к исчезновению сигнала, возникающего при связывании РНК с зондом, а ДНКазой – не должна влиять на РНКспецифичный сигнал.
Ингибиторы РНКаз и их практическое применение
РНК по сравнению с ДНК гораздо более лабильна и чувствительна к действию нуклеаз. Кроме того, РНКазы менее чувствительны к действию денатурирующих белки веществ, чем ДНКазы. Все это затрудняет получение полноразмерной РНК и заставляет проводить инактивацию РНКаз одновременно с лизисом клеток. Вся используемая вода должна быть обработана 0,1%-м диэтилпирокарбонатом (ДЭПК). Ингибиторы РНКаз должны использоваться везде, где это возможно: в буферах для выделения РНК, при последующих экспериментах, при хранении РНК в водных растворах. Можно выделить белковые и небелковые ингибиторы РНКаз. Белковые ингибиторы РНКаз производятся несколькими фирмами (например, Sigma), однако они могут денатурировать под действием определенных агентов или деградировать под действием протеаз. Некоторые фирмы (например, Sigma) производят ванадил-рибонуклеозидные комплексы. Это комплексы, образованные ионом оксованадия и любым из четырех рибонуклеозидов, которые связываются со многими РНКазами и практически полностью их ингибируют. Однако они ингибируют трансляцию РНК в бесклеточной системе синтеза белка.
Рестриктазы
Рестрикционная эндонуклеаза (рестриктаза) – это фермент бактериального происхождения, распознающий специфическую нуклеотидную последовательность длиной от 4 до 10 н.п. и разрезающий двунитевую молекулу ДНК в этом месте (сайте рестрикции).
В зависимости от частоты встречаемости сайтов рестрикции в молекуле ДНК различают 3 класса рестриктаз: часто-, средне– и редкощепящие. Сайты рестрикции могут быть использованы в качестве генетических маркеров ДНК. Образующиеся в результате рестрикции фрагменты ДНК могут быть упорядочены по длине путем электрофореза в агарозном или полиак-
7
риламидном геле, и тем самым может быть определена их молекулярная масса, а, значит, и физическое расстояние между сайтами.
Рестриктазы широко используются при определении первичной структуры ДНК, для картирования генов и в генетической инженерии для создания и клонирования гибридных молекул ДНК.
Гибридизационные методы
Гибридизационный анализ, или генное зондирование, – это направление по определению специфических нуклеотидных последовательностей ДНК и РНК.
Воснове гибридизационных методов лежит способность нуклеиновых кислот к гибридизации – образованию двухцепочечных структур за счет взаимодействия комплементарных нуклеотидов.
Зонд – меченая молекула ДНК (РНК), гибридизующаяся с изучаемым комплементарным участком геномной ДНК или РНК.
Выделяют 3 основных типа зондов:
а) фрагменты комплементарной ДНК (кДНК), входящие в состав плазмидного вектора или изолированные;
б) комплементарная РНК (кРНК), встроенная в плазмидный вектор, который содержит сайт инициации транскрипции, распознаваемый бактериальной РНК-полимеразой (обычно SP6);
в) синтетические некодирующие олигонуклеотиды, полученные с помощью автоматического ДНК-синтезатора.
Также в зависимости от используемой метки выделяют: 1) радиоизотопно меченые зонды.
Традиционно для получения РНК– или ДНК-зондов используют радиоактивно меченые с помощью 32Р, 35S, 125I, 3H нуклеотиды, которые после гибридизации зонда с нуклеиновой кислотой-мишенью выявляют методом авторадиографии. Преимущества: обеспечивают высокую чувствительность, специфичность и воспроизводимость результатов. Недостатки: имеют малый период полураспада, требуют соблюдения строгих мер безопасности;
2) нерадиоактивно меченые зонды.
Воснове большинства методов нерадиактивного мечения лежат ферментативные реакции с участием нуклеозид-трифосфатов, ковалентно связанных с молекулой-свидетелем, обычно биотином – витамином Н – или дигоксигенином. Использование в качестве метки дигоксигенина обеспечивает большую специфичность, т.к. биотин присутствует в большинстве тканей. Для их детекции используют гистохимические методы.
После гибридизации такие нерадиоактивно меченые зонды можно выявить: во-первых, с помощью неиммунологической системы детекции на основе авидина и стрептавидина (белков, имеющих высокое сродство к биотину) – аффинный метод – или, во-вторых, с помощью конъюгирован-
8
ных с флуоресцентным красителем или ферментом антител к зонду – иммуноцитохимический метод.
Зонды можно метить и химическими методами, используя биотин, пришитый к высокоактивным молекулам (например, фотобиотин, биотингидразид, эфир биотина).
В качестве неизотопной метки можно использовать и другие соедине-
ния, например, ртуть, ацетиламинофлуорен, динитрофенол и другие, но не все из них являются безопасными.
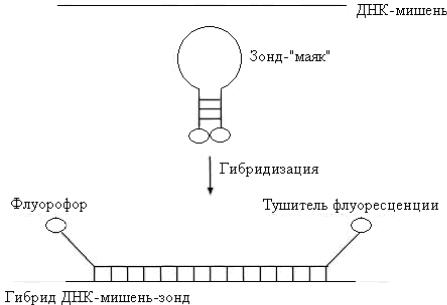
Один из недавно разработанных нерадиоактивных методов детекции основан на использовании зонда-«молекулярного маяка» (рис. 1). Такой зонд состоит из 25 нуклеотидов. Средние 15 из них комплементарны ДНКмишени и не спариваются друг с другом, а 5 концевых нуклеотидов взаимно комплементарны и образуют шпильку. К 5'-концу присоединен флуоресцентный хромофор (флуорофор), а к 3'-концу – нефлуоресцентный хромофор (тушитель), на который передается энергия возбуждения флуорофора. В растворе при комнатной температуре «маяк» имеет такую конфигурацию, при которой флуорофор и тушитель находятся в тесном контакте, и флуоресценция флуорофора тушится. Когда же 15 средних нуклеотидов зонда гибридизуются с комплементарной последовательностью ДНК– или РНКмишени, происходит пространственное разделение флуорофора и тушителя, и зонд испускает свет. Температура реакционной смеси должна быть близка к комнатной, поскольку при ее повышении шпилька денатурирует, флуорофор и тушитель расходятся и происходит флуоресценция. Необходимо также, чтобы все 15 нуклеотидов зонда были комплементарны соответствующей последовательности ДНК– или РНК-мишени.
Рис. 1. Зонд-«молекулярный маяк»
9
Кроме вышеописанных, в качестве нерадиоактивных меток могут выступать вещества, рассеивающие электроны; бактериофаги; эритроциты; металлы (коллоидное золото); флуоресцентные красители; хемилюминесцентные и биолюминесцентные вещества; липосомы; простетические группы и субстраты ферментов; модуляторы ферментов; а также сами ферменты.
Предложенная в начале 1970-х годов ферментная метка получила наиболее широкое применение.
Преимущества ферментной метки:
1)многократно усиливает сигнал (в присутствии одной молекулы фермента за короткое время образуются миллионы и миллиарды молекул продукта реакции);
2)позволяет в некоторых случаях проводить анализ без разделения вошедших в комплекс и не связавшихся компонентов;
3)позволяет регулировать свою каталитическую активность.
Перед проведением ферментативной реакции необходимо разделить свободную и связанную фракции ферментной метки. Количество образовавшихся комплексов, а тем самым и содержание определяемой последовательности, оценивают по содержанию ферментной метки. Количество метки определяют по ее каталитической активности.
В зависимости от типа регистрируемого сигнала в продуктах фер- мент-субстратной реакции все субстраты можно разделить на 4 группы.
1.Хромогенные субстраты, при использовании которых продукты реакции – хромофоры – поглощают свет в видимой области, то есть их растворы окрашены.
2.Пероксид водорода. При его каталитическом расщеплении образуется атомарный кислород, который окисляет присутствующий в растворе хромоген с образованием хромофора.
3.Флуоресцентные субстраты. В результате воздействия фермента из них образуются продукты, которые имеют свойство поглощать свет одной длины волны, аиспускать– другой. Такоеявлениеназывается флуоресценцией.
4.Хемилюминесцентные субстраты, при использовании которых продукты реакции поглощают кванты света, переходят в возбужденное состояние и затем испускают свет определенной длины волны, то есть их растворы светятся.
Наибольшее применение в качестве ферментной метки нашли 3 фермента: пероксидаза хрена, щелочная фосфатаза, β-D-галактозидаза.
Различают 2 типа гибридизационного анализа:
1.Методы гибридизационного анализа, проводимые в растворе (гомогенные);
2.Методы гибридизационного анализа, проводимые на твердом носителе (гетерогенные).
10
