
Биомедицина практика
.pdfсутствуют в избытке: концентрация их составляет 0,5–1,0 мкМ. Специфичность получаемого продукта ПЦР в значительной степени определяется так называемой температурой отжига праймеров, при которой они взаимодействуют с комплементарными участками ДНК-матрицы, образуя двухцепочечные структуры. Температура отжига определяется длиной праймера и содержанием ГЦ-пар. Как правило, праймеры для ПЦР-детекции инфекционных возбудителей создают на консервативные участки их ДНК, которые редко подвергаются генетическим перестройкам.
Дезоксинуклеозидтрифосфаты: dATP, dTTP, dGTP, dCTP – в реакционной смеси содержатся в эквивалентных концентрациях от 200 до 500 мкМ, т.к. избыток какого-либо из них увеличивает ложное спаривание нуклеотидов в ПЦР.
Магний необходим для функционирования фермента Taq-ДНК- полимеразы, но оптимальная его концентрация устанавливается путем титрования, поскольку концентрация свободных ионов магния зависит не только от добавленного его количества, но и от концентраций нуклеиновых кислот, праймеров и dNTP, которые связывают эти ионы. Средние величины концентрации магния в ПЦР составляют около 2–3 мМ.
Буфер должен обеспечивать оптимальные условия для работы фермента. Наиболее распространен трис-НСl-буфер, который удерживает рН во время ПЦР между 6,8 и 7,8, содержит желатин или бычий сывороточный альбумин и неионные детергенты для стабилизации фермента, а также 50 мМ KCl.
Минеральное масло наслаивается на поверхность реакционной смеси в количестве 30–40 мкл для предотвращения испарения в процессе ПЦР.
Кроме этих компонентов, необходим образец ДНК исследуемой биологической системы – положительный контроль.
Специфичность ПЦР и количество амплифицируемой ДНК, которое определяет чувствительность, могут значительно варьировать в зависимости от концентрации и количества пяти основных компонентов реакционной смеси и температурного режима ПЦР, в частности, от температуры отжига праймеров (2-я стадия ПЦР).
Важным фактором воспроизводимости реакции амплификации является приборное обеспечение. Основным прибором для проведения ПЦР является амплификатор (термоциклер), представляющий собой аппарат, в гнезда которого устанавливаются специальные амплификационные пробирки, изготовленные из особого термопроводимого пластика, с реакционной смесью или предметные стекла с образцами тканей.
Амплификаторы изменяют температуру автоматически на основе заданной программы. В термоциклерах температура металлического блока, в который помещаются пробирки, изменяется с помощью элемента Пельтье. Элемент Пельтье позволяет изменять температуру блока с большой скоростью, что сокращает продолжительность каждого цикла ПЦР. Современные
21
термоциклеры приспособлены для использования специальных тонкостенных пластиковых пробирок для реакционной смеси, что позволяет ускорить теплообмен между блоком прибора и реакционной смесью и в конечном итоге дополнительно сократить время проведения реакции.
К настоящему времени выпущено много разнообразных моделей амплификаторов. Наиболее удобными являются приборы с несколькими платформами, каждая из которых может работать по отдельной программе, что дает возможность одновременно анализировать пробы на наличие нескольких типов возбудителей или нескольких мутаций. Многие приборы позволяют программировать специальные усложненные температурные профили, необходимые для специфических модификаций процесса ПЦР.
Также для проведения исследования методом ПЦР необходимы: 1) микроцентрифуга типа Эппендорф (10–12 тыс. об./мин); 2) камера для ЭФ в гелях; 3) УФ-трансиллюминатор; 4) встряхиватель пробирок типа Эппендорф; 5) микротермостат; 6) фотоаппарат; 7) ламинарный шкаф и т.д.
После подготовки реакционной смеси для ПЦР пробирки плотно закрывают крышками и ставят в амплификатор, задают программу смены температурных режимов, соответствующую амплификации исследуемого участка ДНК. Каждый цикл амплификации включает 3 температурных режима: денатурацию ДНК (92–95 °С) – примерно 1 мин., отжиг праймеров (45–60 °С) – 0,5–2 мин, синтез комплементарной цепи (65–72 °С) – 1–3 мин После прохождения необходимого количества циклов процесс останавливают. Таким образом, стандартная ПЦР может быть осуществлена за 1–3 ч. При необходимости оставить пробы на ночь их помещают в холодильник при +4 °С или вводят дополнительный цикл на амплификаторе: +4 °С – 12 часов или более.
Детекция продуктов амплификации
Детекция методом гель-электрофореза
Выявление, или детекцию, наработанного продукта ПЦР (амплификата) чаще всего проводят при помощи его электрофореза в 2–3%-м геле агарозы или полиакриламидном геле, содержащем бромид этидия (специфический флуоресцентный ДНК и РНК-краситель). Поглощая УФ-свет с максимальной длиной волны 256 нм, бромид этидия, связанный с участком ДНК, способен флуоресцировать, что регистрируется в видимом спектре (610–620 нм) в виде оранжевой полоски. Получаемые результаты элекрофореза амплификонов оценивают в проходящем УФ-свете на специальных приборах – трансиллюминаторах – и сравнивают с положительным контролем (ДНК выявляемого микроорганизма или известная ДНК). При положительном результате светящаяся полоска ДНК находится на том же уровне, что и положительный контроль вследствие одинаковой молекулярной массы наработанных амплификонов в контроле и изучаемом положительном образце. В отрицательном
22
контроле должны отсутствовать компактные светящиеся полоски ДНК. Для такого выявления необходимо не менее 20 нг ДНК.
Детекция гибридизационно-ферментативным методом с измерением интенсивности окраски образовавшегося продукта
колориметрическим, флуоресцентным или хемилюминесцентным методами
Другим способом качественной и количественной оценки ПЦР является ферментно-гибридизационный метод. Для его проведения на твердом носителе иммобилизуют ДНК-зонд, с которым в результате гибридизации взаимодействует продукт амплификации. В дальнейшем в результате аффинного взаимодействия происходит связывание биотина и авидина с образованием биотин-авидинового комплекса. При этом меченый пероксидазой авидин выявляется ферментной реакцией с субстратом и дальнейшей регистрацией оптической плотности. В случаях, если вместо пероксидазы в авидин встроено флуоресцентное вещество, детекция должна осуществляться с использованием флуоресцентной техники. Возможны варианты, когда в авидиновый комплекс встраивается рутений или другие вещества, способные к хемилюминесценции, и тогда оценка результатов проводится с использованием метода хемилюминесценции.
Использование одного или нескольких внутренних стандартов с известным количеством копий позволяет рассчитать содержание возбудителя в исследуемой пробе.
Использование гибридизации с внутренними ДНК-зондами позволяет в ряде случаев значительно повысить чувствительность и специфичность детектирования ПЦР-продуктов. Благодаря отсутствию необходимости в подготовке и проведении электрофоретического разделения, возможности автоматизации для анализа большого количества образцов и использования нерадиоактивного формата детектирования, этот метод становится все более распространенным. В некоторых случаях применение специальных флюоресцентных «маркеров» позволяет контролировать проведение амплификации или детектирование конечных продуктов ПЦР непосредственно в реакционной пробирке.
Перспективной в настоящее время видится разработка для детекции продуктов амплификации методов лантаноидного иммунофлуоресцентного анализа. Данный метод основан на использовании в качестве метки положительно заряженных ионов редкоземельных элементов – европия, самария, тербия и прозеодима, являющихся флуорохромами, причем их атомы способны существовать в возбужденном состоянии продолжительное время.
Весьма перспективной является также детекция продуктов амплификации с использованием флуоресцирующих моноклональных антител к специфическим амплификонам (цепочкам ДНК), характеризующим тот или иной геном возбудителя или участок гена с определенными искомыми свойствами (генные мутации, наследственные и онкологические заболевания и т.д.).
23
Модификации ПЦР
ПЦР в реальном времени
Принципиальной особенностью полимеразной цепной реакции в реальном времени является возможность детекции накопления продуктов амплификации непосредственно во время проведения амплификации. Так как кинетика накопления ампликонов напрямую зависит от числа копий исследуемой матрицы, это позволяет проводить количественные измерения ДНК и РНК. В отличие от других методов количественного определения ДНК матрицы в пробе, ПЦР в реальном времени не требует дополнительных манипуляций, связанных с раститровкой ДНК исследуемой пробы или полученных в ходе ПЦР ампликонов, которые усложняют постановку анализа и могут приводить к появлению ложноположительных результатов. Подобный подход позволяет отказаться от стадии электрофореза, что ведет к резкому уменьшению вероятности контаминации исследуемых проб продуктами амплификации, а также позволяет снизить требования, предъявляемые к ПЦР-лаборатории.
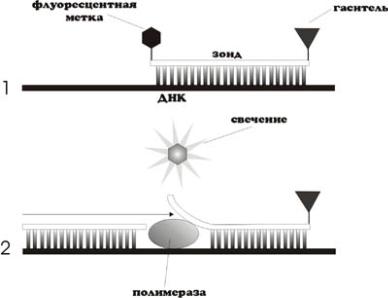
Один из методов количественной ПЦР в режиме реального времени базируется на использовании ДНК-зонда, комплементарного амплифицируемой последовательности и меченного двумя флуоресцентными метками, одна из которых в исходном состоянии «поглощает» спектр флуоресценции другой. Далее в каждом цикле ПЦР (а именно, в фазе синтеза) за счет 5’- нуклеазной активности ДНК-полимеразы используемый зонд расщепляется и высвобождает 5’-метку, нарастание флуоресценции которой после возбуждения лазерным лучом регистрируется в реальном режиме времени и отражает нарастание числа молекул ПЦР-продукта (рис. 4).
Рис. 4. Количественная ПЦР в реальном режиме времени при детекции с помощью выщепления 5' концевой метки (TaqMan Assay)
24

Рис. 5. Количественная ПЦР в реальном режиме времени при детекции с использованием интеркалирующих агентов
Другой вариант ПЦР в реальном времени основан на использовании интеркалирующих агентов: флуоресценция бромистого этидия и SYBR Green I значительно возрастает при их внедрении в двухцепочечные молекулы ДНК (рис. 5). Таким образом, можно наблюдать за накоплением продуктов амплификации.
Рис. 6. Кривые плавления продуктов амплификации
Очень важно отметить то, что увеличение флуоресценции может быть связано как с накоплением специфического продукта, так и неспецифиче-
25
ского (праймеры-димеры, шмер). Для получения корректных результатов необходимо дополнительное изучение полученных ампликонов с помощью построения так называемых «кривых плавления» (melting curves). Для этого после окончания ПЦР реакционную смесь нагревают и непрерывно измеряют флуоресценцию. По достижении температуры плавления продукта амплификации флуоресценция резко снижается (рис. 6).
Каждое резкое уменьшение флуоресценции на графике соответствует числу полосок, получаемых на электрофорезе, то есть числу разных типов ампликонов. Для облегчения работы с полученной информацией проводят дифференциальный анализ кривой плавления. Такой способ визуализации полученных данных гораздо удобнее для понимания и анализа.
Применение кривых плавления не ограничивается только детекцией продуктов амплификации с помощью бромистого этидия и SYBR Green I. При использовании кривых плавления в системах с ДНК-зондами (Taq-man assay) возможно различать точечные мутации, расположенные внутри областей связывания ДНК-матрицы и зонда. Наличие таких мутаций способно привести к изменению температуры плавления зонда и к изменениям в графике кривой плавления. Использование кривых плавления не требует от оператора амплификатора никаких дополнительных манипуляций с пробирками, а интерпретация полученных данных автоматизирована и формализована.
Подводя итоги, стоит отметить следующее: использование ДНКзондов в том или ином варианте является наиболее предпочтительным в свете повышения специфичности анализа. Однако к недостаткам зондов относится высокая стоимость, что делает работу по подбору зондов, праймеров и условий амплификации дорогостоящей. Вместе с тем, использование интеркалирующих агентов является очень простым и дешевым. Отпадает необходимость подбора специальных праймеров, зондов, так как можно пользоваться уже используемыми праймерами, эффективность работы которых уже проверена. Эти обстоятельства делают применение интеркалирующих агентов весьма привлекательным.
Гнездная ПЦР Разработана в целях повышения чувствительности и специфичности и
проводится в 2 этапа. На первом этапе осуществляется амплификация определенного гена искомой ДНК с «внешними» праймерами: проводится от 30 до 35 циклов. После этого часть амплификата (аликвоту) помещают во вторую пробирку с ПЦР-смесью и проводят 30–35 циклов амплификации с так называемыми «внутренними» праймерами (участки нуклеотидных последовательностей, отстоящие от внешних праймеров на их длину). Получаемый продукт отличается высокой специфичностью и в дальнейшем подвергается детекции.
26
Обратно-транскрипционная ПЦР Методика позволяет осуществлять ПЦР с РНК-содержащими возбу-
дителями, считывая информацию с РНК и создавая подобную ей ДНК. Выполнение данного процесса возможно при использовании специальных ферментов, обладающих обратно-транскрипционными свойствами и дезоксинуклеотидфосфатов. При помощи фермента обратной транкриптазы или ревертазы и одного цикла амплификации по специальной программе (+42 °С – 30 мин, +99 °С – 5 мин, охлаждение до +4 °С) осуществляется обратная транскрипция РНК: одна нить РНК превращается в двойную комплементарную ДНК, а дальше ДНК может быть амплифицирована «классической» или «гнездной» ПЦР.
ПЦР in situ (PRINS – polymerase reaction in situ)
Метод сравнительно недавно предложен для практики, аналогичен методу ГИС и позволяет проводить ПЦР на срезе или в мазке. Метод хорошо себя зарекомендовал и используется, в частности, в онкологии.
В данном методе отсутствует пробоподготовка. При этом используется та же ПЦР-смесь, что и в «классическом» методе, однако сама реакция проходит на поверхности среза. Для проведения данной методики требуется специальный амплификатор, в котором изменяется температура воздушных потоков, создаваемых в микроколориметре, куда устанавливаются предметные стекла со срезами и реакционной смесью. Детекцию результатов проводят с использованием ферментативно-гибридизационного метода с визуальной оценкой полученных результатов в обычном световом микроскопе.
Данный метод позволяет определить:
1)типы клеток, в которых произошли изменения;
2)распределение измененных клеток в ткани, т.е. оценить степень повреждения;
3)провести сравнение с результатами гистологических и цитохимических исследований в адекватных условиях.
Мультиплексная ПЦР (multi-PCR, multiplex PCR)
Методика позволяет проводить ПЦР с двумя-четырьмя и более не перекрещивающимися праймерами нескольких возбудителей. Мультиплексная ПЦР позволяет определить в одной пробе нуклеиновые кислоты сразу нескольких возбудителей, что особенно актуально, т.к. часто при диагностике обнаруживаются смешанные формы инфицирования.
Так, например, описаны варианты применения множественной ПЦР для одновременного обнаружения двух (Chlamidia trachomatis и Neisseria gonorrhoeae при заболеваниях урогенитального тракта) или даже четырех возбудителей (Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis и Alloiococcus otitidis при хроническом гнойном отите).
27
Метод используется также часто для выявления нескольких экзонов исследуемого гена. Например, для быстрой диагностики носительства делеций в гене дистрофина у больных прогрессирующей мышечной дистрофией Дюшенна и Бекера проводится одновременная амплификация набора наиболее часто мутирующих экзонов данного гена.
Альтернативный подход в ПЦР-диагностике связан с использованием универсальных праймеров, которые позволяют амплифицировать фрагменты генов, присутствующих у всех микроорганизмов определенной таксономической группы. Количество видов, которые могут быть выявлены с помощью этого метода, может ограничиваться как рамками небольших систематических групп (рода, семейства), так и крупных таксонов на уровне порядка, класса, типа. В последнем случае мишенью для ПЦР чаще всего являются рибосомные гены (16S и 23S рРНК), которые имеют сходную структуру у различных прокариотических микроорганизмов.
Использование праймеров, комплементарных консервативным участкам этих генов, позволяет амплифицировать ДНК большинства видов бактерий. Полученные в результате ПЦР фрагменты рибосомных генов могут быть затем проанализированы с помощью различных лабораторных методов с целью идентификации бактерий, которым они принадлежат. Наиболее точным методом «молекулярной» идентификации является определение полной нуклеотидной последовательности (секвенирование) амплифицированной ДНК и сравнение ее с соответствующими последовательностями известных видов.
Несмотря на наличие автоматизированных систем, использующих описанный принцип идентификации, на практике обычно используются менее трудоемкие и дорогостоящие методы, которые, тем не менее, позволяют достоверно выявлять определенные различия в последовательности ДНКфрагментов. Наиболее распространенными являются методы, основанные на анализе расположения в ДНК участков расщепления ферментами-
рестриктазами – метод ПДРФ (RFLP) – полиморфизм длины рестрикцион-
ных фрагментов, или на определении электрофоретической подвижности ДНК в одноцепочечной форме (метод SSCP – анализ конформационного по-
лиморфизма одноцепочечной ДНК).
ПЦР с использованием универсальных праймеров может применяться как для идентификации выделенных в чистой культуре микроорганизмов, так и для прямой диагностики широкого спектра возбудителей непосредственно в клинических образцах. Следует однако отметить, что чувствительность ПЦР «широкого спектра», как правило, ниже по сравнению с «видоспецифическими» тест-системами. Кроме того, ПЦР с универсальными праймерами обычно не используется для исследования образцов, в которых может находиться большое количество различных микроорганизмов, из-за трудности анализа продуктов реакции, полученных в результате амплификации ДНК разных видов.
28
Методы предотвращения контаминации. Устройство ПЦР-лаборатории
Потенциально высокая чувствительность ПЦР делает совершенно необходимым особенно тщательное устройство ПЦР-лаборатории. Это связано с наиболее острой проблемой метода – контаминацией.
Контаминация – попадание из внешней среды в реакционную смесь молекул ДНК, способных служить мишенями в реакции амплификации и давать ложноположительные результаты.
Такими мишенями могут быть продукты реакции, попадающие во внешнюю среду на этапе электрофореза из пробирок, в которых успешно прошла амплификация, либо специфическая ДНК из образцов на этапе пробоподготовки.
Существует несколько способов борьбы с этим неприятным явлением. Одним из них является использование фермента N-урацилгликозилазы (УГ). В основе этого метода лежит способность УГ расщеплять молекулы ДНК со встроенным урацилом. Реакцию амплификации проводят с использованием смеси dNTP, в которой dTTР заменен на dUTP, и после проведения ПЦР все образующиеся в пробирке амплификоны будут содержать урацил. Если до амплификации в реакционную смесь добавить УГ, то попавшие в реакционную смесь амплификоны будут разрушены, тогда как нативная ДНК останется целой и будет в дальнейшем служить мишенью для амплификации.
Другим способом инактивации амплификонов служит фотохимическое воздействие на молекулы ДНК. Для этого используют псорален или изопсорален, которые активируются кратковременным облучением УФсветом. Модифицированные этими соединениями молекулы ДНК не могут участвовать в реакции амплификации.
Однако, как известно, ни одна биологическая или химическая реакция не идет со 100%-й эффективностью и, соответственно, после инактивации продуктов амплификации из миллиардов копий амплифицированного фрагмента хотя бы несколько останутся целыми. Кроме того, всегда остается риск кросс-контаминации от образца к образцу в процессе пробоподготовки.
Даже при таком способе, как значительное уменьшение количества циклов реакции (до 25–30 циклов), риск получения ложноположительных результатов велик.
Таким образом, наиболее радикальным средством является заранее продуманная организация лаборатории. Для уверенности в отсутствии контаминации необходимо каждую серию экспериментов сопровождать отрицательными контролями. Все реактивы рекомендуется хранить разлитыми на отдельные порции (аликвоты).
Если все же, несмотря на принятые меры, обнаружены следы контаминации, то необходимо все поверхности помещения, оборудования, пипе-
29

ток и прочее обработать 0,1 М HCl, а все используемые порции реактивов следует заменить на новые.
ПЦР-лаборатория должна быть разделена на 3 зоны – по числу технологических операций:
1)зона подготовки реакционной смеси («чистая зона»);
2)зона пробоподготовки;
3)электрофоретическая комната.
[Стрелками показаны возможные направления перемещения по зонам ПЦР-лаборатории].
Все 3 зоны должны быть изолированными комнатами, снабженными предбоксниками. Полезно иметь устройство фильтрации воздуха.
Если первую и вторую зоны, в крайнем случае, допускается объединить (при наличии специальных боксов), то комната для электрофореза должна размещаться как можно дальше от двух других зон (другой этаж, другое здание) и иметь не связанную с другими зонами систему вентиляции. Это является одним из наиболее важных требований при организации ПЦР-лаборатории.
Кроме того, желательно предусмотреть отдельные помещения для переодевания и хранения верхней одежды, приема пища, складское помещение для лабораторных материалов. Все производственные комнаты должны быть снабжены коротковолновыми УФ-лампами.
Инактивацию биологического материала проводят в автоклаве в течение 1 часа при 1,5 атмосферах.
Преимущества ПЦР как метода диагностики и его применение
Отмечают следующие преимущества ПЦР перед другими методами клинической лабораторной диагностики:
1. Универсальность. Метод принципиально позволяет обнаруживать любые ДНК и РНК даже в тех случаях, когда другими способами это сделать невозможно. Вне зависимости от объекта и области применения ПЦР (клиническая медицина, криминалистика, ветеринария, генетика, молекулярная биология) используется стандартный комплект приборов. Это обуславливает универсальность процедуры постановки ПЦР при исследовании любых биологических объектов.
2.Специфичность. Высокая специфичность (100 %) метода обусловлена тем, что в исследуемом материале определяется уникальный фрагмент НК (нуклеотидная последовательность), характерный только для данного возбудителя или гена. Таким образом, ПЦР-диагностикумы дают возможность избежать проблем, связанных с перекрестно-реагирующими антигенами.
3.Чувствительность. Возможность проведения не только качественной (наличие), но и количественной (концентрация) оценки содержания НК.
Внастоящее время реальный порог чувствительности коммерческих ам-
30
