
Биомедицина практика
.pdfМетод гибридизации в растворе
При гибридизации в растворе искомая НК и зонд свободно взаимодействуют в водной реакционной смеси, что повышает скорость процесса гибридизации. Детекцию результатов гибридизации в растворе осуществляют путем нуклеазного гидролиза одноцепочечных ДНК и выделения оставшихся двухцепочечных гибридов, содержащих меченый зонд.
Для успешного проведения реакции гибридизации в растворе необходимо применять одноцепочечные зонды, неспособные к самогибридизации. Метод хорош еще и тем, что требует минимальных объемов и количеств биологического и клинического образцов, поэтому может быть использован в диагностических целях. В то же время этот метод имеет один существенный недостаток – на его основе можно создать диагностические тестсистемы для выявления специфических фрагментов небольших участков ДНК при условии достаточно высокой концентрации искомых фрагментов или участков в исследуемом образце. Это снижает порог чувствительности до уровня ИФА и даже ниже.
Метод гибридизации на твердом носителе
Принцип метода основан на гибридизации зонда на твердой поверхности. В качестве твердой поверхности чаще всего используют полимерный мембранный фильтр, например, нейлоновую мембрану.
Процедура гибридизации нуклеиновых кислот в общих чертах состоит в следующем:
1.Фиксация одноцепочечной ДНК-мишени на мембранном фильтре (обычно путем инкубации от 10 мин до 4 ч при 80 °С в вакууме).
2.Нанесение меченого одноцепочечного ДНК-зонда, который при определенных условиях (температуре и ионной силе) спаривается с ДНКмишенью.
3.Промывание фильтра для удаления избытка несвязавшегося меченого ДНК-зонда.
4.Детекция гибридных молекул зонд/мишень. Система детекции должна быть в высшей степени специфичной и высокочувствительной.
Гибридизация in situ
Гибридизация in situ (ГИС; in situ hybridization, ISH) – это метод прямого выявления нуклеиновых кислот в клеточных структурах в условиях, позволяющих одновременно исследовать их морфологию.
Метод гибридизации in situ основан на способности хромосомной ДНК образовывать устойчивые гибридные молекулы с ДНК(РНК)-зондами непосредственно на препаратах фиксированных хромосом и интерфазных ядер. С помощью этого метода можно определить точное местоположение практически любой последовательности ДНК или РНК непосредственно в клетке, клеточном ядре или на хромосомах.
11
Задача осложняется тем, что при проведении ГИС приходится иметь дело с самыми разными объектами – от индивидуальных хромосом в метафазных пластинках до архивных залитых в парафин биоптатов. Чувствительность метода ГИС ограничена возможностью проникновения зондов внутрь клеток для связывания с искомой мишенью.
Выбор конкретной методики гибридизации, оптимальной для данного эксперимента, зависит от следующих факторов:
–природа НК-мишени (методики выявления ДНК и РНК с помощью ГИС различаются);
–чувствительность;
–специфичность;
–вопросы практического характера (стоимость, безопасность, наличие оборудования и реактивов).
С помощью ГИС можно исследовать срезы толщиной 3–10 мкм. Процедура ГИС может быть представлена в виде следующей схемы: 1) предварительная обработка срезов; 2) получение и мечение зонда; 3) денатурация ДНК-мишени и зонда;
4) гибридизация одноцепочечной ДНК-мишени с зондом;
5) отмывание;
6) детекция.
Предварительная обработка срезов включает:
–депарафинирование срезов тканей, залитых в парафин;
–демаскирование НК-мишени (необходимо разрушить сшивки НКмишени с другими нуклеиновыми кислотами и белками, например, с помощью ограниченного протеолиза протеиназой К и пепсином-HCl);
–обработку РНКазой или ДНКазой;
–предгибридизацию срезов (инкубирование в не содержащей зонда гибридизационной смеси, проводится не всегда).
Для денатурации используют химические (щелочная денатурация) и физические (термоденатурация) факторы. Денатурацию обычно проводят в присутствии формамида (ослабляет внутримолекулярные водородные связи)
исолей, что позволяет снизить температуру денатурации и гибридизации. Для проведения гибридизации иногда достаточно просто снизить
температуру смеси ниже температуры плавления гибрида зонд/мишень и в этих условиях выдержать образец в течение 2–16 ч. В целом же подбор условий для проведения гибридизации (температура, время) индивидуален для каждого отдельного случая.
Оптимальная температура ренатурации (или отжига) примерно на 25 °С ниже температуры плавления (Tm) гибридной молекулы. Tm двухцепочечной молекулы ДНК – это температура, при которой 50 % дуплексов денатурировано. Один из вариантов условий гибридизации (общепринятые
12
«жесткие» условия: 50 % формамид, 2 × ССР (стандартный солевой раствор), 42 °С) соответствует температуре гибридизации Tm – 12 °С. Жесткость условий можно повысить, увеличив концентрацию формамида, снизив концентрацию солей и повысив температуру.
В зависимости от нуклеотидного состава и числа копий исследуемой последовательности ДНК, а также поставленных задач, может изменяться содержание формамида (от 0 до 60 %), концентрация солевых буферов (от 2 × до 0,1 × ССР), температурный режим (от 37 °С до 42 °С), время (2– 16 ч.) проведения гибридизации.
Необходимым условием проведения гибридизации является то, что меченый зонд должен иметь подходящий размер и присутствовать в нужной концентрации.
После гибридизации проводят отмывание образцов и детекцию гибридизовавшегося зонда (метод детекции зависит от типа используемого зонда).
Чтобы убедиться в специфичности наблюдаемого сигнала, во всех случаях необходимо ставить адекватные контрольные опыты, как положительные, так и отрицательные.
Частный случай ГИС – флуоресцентная гибридизация in situ (FISH). В качестве зондов в данном случае используют последовательности, меченые флуорохромами, что сокращает проведение процедуры до 7–9 часов. Данный метод имеет ряд преимуществ по сравнению с изотопными вариантами гибридизации: большую разрешающую способность, быстроту и безопасность для здоровья исследователя.
Гибридные молекулы можно выявлять с помощью различных систем иммунохимической детекции, используя флуорохромы – детекторы разных цветов. Это делает возможным выявление одновременно нескольких последовательностей ДНК в одной клетке. Существует множество вариантов флуоресцентной детекции, например, возможно «раскрасить» таким способом все хромосомы человека, каждую своим цветом.
Анализ препаратов после FISH проводят с помощью флуоресцентного микроскопа, оснащенного набором соответствующих светофильтров.
Блот-гибридизация
Блот-гибридизация (блоттинг) – метод идентификации макромолекул, разделенных гель-электрофорезом и фиксированных на твердом матриксе, путем гибридизации содержимого образцов с мечеными комплементарными зондами.
Виды блоттинга:
1) вестерн-блоттинг (иммуноблоттинг) – идентификация искомого белка путем гибридизации разделенных гель-электрофорезом белковых молекул с меченым антителом;
13
2)нозерн-блоттинг – идентификация искомой последовательности РНК путем гибридизации разделенных гель-электрофорезом молекул мРНК
смеченым комплементарным ДНК-зондом;
3)саузерн-блоттинг – идентификация участка ДНК, содержащего искомую нуклеотидную последовательность, путем гибридизации разделенных гель-электрофорезом фрагментов ДНК с меченым комплементарным ДНК-зондом.
Блот-гибридизация по Саузерну
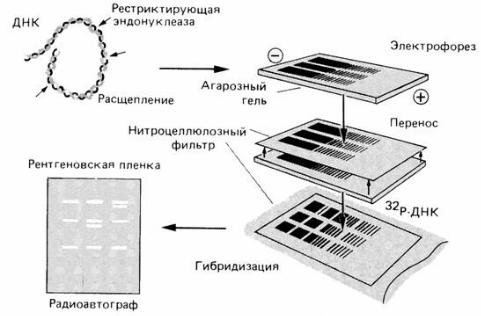
Блот-гибридизация по Саузерну – это классический метод блотгибридизации; назван по фамилии автора, предложившего его в 1975 г.
Первым этапом саузерн-блоттинга (рис. 2) является выделение суммарной геномной ДНК. Затем геномная ДНК обрабатывается одной или несколькими рестрикционными эндонуклеазами, после чего образующиеся фрагменты разделяют по относительной молекулярной массе в агарозном геле. Далее, после денатурации ДНК, проводится процедура блоттинга – переноса фрагментов ДНК с геля на нитроцеллюлозный или нейлоновый фильтр (это осуществляется за счет действия осмотических сил, вакуума или электрического поля), в результате чего на фильтре фиксируется точная реплика ДНК-рестрикта.
Денатурированные фрагменты ДНК гибридизуют с радиоактивномеченым зондом – молекулой ДНК длиной несколько сотен нуклеотидов.
После отмывки фильтра и авторадиографии на рентгеновской пленке можно оценить точное положение и длину фрагментов ДНК, комплементарных использованному зонду.
Рис. 2. Схема саузерн-блоттинга
14
Таким образом, блот-гибридизация позволяет идентифицировать специфические последовательности нуклеотидов в общем наборе рестрикционных фрагментов геномной ДНК. При наличии макроперестроек ДНК, затрагивающих исследуемый участок, набор или размер фрагментов, с которыми гибридизуется меченая проба, будет отличаться от нормы.
Нозерн– и вестерн-блоттинг проводятся аналогичным образом. Метод блот-гибридизации обладает высокой чувствительностью, одна-
ко он является весьма трудоемким, предполагает использование радиоактивных зондов (хотя в последнее время нередко используют различные варианты нерадиоактивного мечения или окраску ДНК нитратом серебра), предъявляет высокие требования к качеству анализируемой ДНК и требует для проведения больших количеств геномной ДНК (5–10 мкг). Тем не менее, во многих случаях он играет ведущую роль в прямой ДНК-диагностике, в том числе в сочетании с другими методами.
Метод сэндвич-гибридизации
Метод является одной из разновидностей зондовой технологии. При его использовании применяются два зонда, гомологичные различным участкам искомой нуклеиновой кислоты. Один зонд фиксируют на мембране для того, чтобы связать искомую нуклеиновую кислоту, присутствующую в исследуемом образце. После осуществления гибридизации мембрану отмывают от исследуемого материала и добавляют раствор, содержащий второй зонд, который имеет определенную метку. Процесс гибридизации проводят повторно, и при этом зонд с меткой взаимодействует с искомым участком ДНК (РНК). Дальнейший процесс детекции проводится стандартным методом (ферментно-гибридизационным, авторадиографическим, флуоресцентным, хемилюминесцентным).
Например, если второй зонд был связан с биотином, то его выявление может быть проведено ферментно-гибридизационным методом. Для этого в систему добавляют авидин (белок куриного яйца) или стрептавидин (бактериальный аналог авидина). После отмывания добавляют биотинилированный фермент щелочную фосфатазу или пероксидазу хрена. В зависимости от используемого фермента добавляют хромогенный или хемилюминесцентный субстрат и регистрируют изменение окраски либо люминесценцию, сопровождающую превращение субстрата в продукт.
В качестве альтернативы после гибридизации ДНК со вторым, биотинилированным зондом можно добавлять уже готовый комплекс стрептави- дин-фермент, имеющий сайт связывания с биотином.
Как авидин, так и стрептавидин связываются с биотином очень прочно (константа диссоциации (Кd = 10–15); кроме того, каждый из белков имеет четыре независимых биотинсвязывающих сайта, благодаря чему одна молекула авидина или стрептавидина может одновременно присоединять фермент и зонд, меченные биотином. Биотинилирование и связывание со
15
стрептавидином не приводят к снижению ферментативной активности. В хромогенных системах детекции в том месте, где находится гибридная ДНК, под действием фермента образуется нерастворимый краситель, а в хемилюминесцентных системах – продукт, который испускает свет.
Метод разветвленной ДНК
Искомая НК связывается с улавливающим зондом, один конец которого комплементарен мишени, а другой – определенному концу усиливающего зонда. При этом усиливающий зонд может быть комплементарен следующему зонду и т.д. Количество зондов может быть велико, и все они связаны с несколькими (от одного до нескольких десятков) люминофорами, которые по мере увеличения количества связанных зондов усиливают (хеми-, флуоро-) люминесценцию. Преимуществом данного метода является возможность использования в одной реакции нескольких улавливающих и связывающихся с мишенью зондов, что обеспечивает выявление агентов, характеризующихся значительной геномной гетерогенностью, например, ВИЧ.
Методы амплификации нуклеиновых кислот
До изобретения методов амплификации нуклеиновых кислот для доказательства наличия инфекционного возбудителя или идентификации генетической мутации использовали гибридизационные методы. Однако ДНК-зондовая диагностика имеет существенные ограничения как по своей чувствительности, так и по трудоемкости и длительности: для ее осуществления необходимо выделить ДНК из не менее чем 10 000 клеток, а сам процесс гибридизации не может быть полностью автоматизирован. Предварительная быстрая амплификация in vitro позволяет детектировать единичные микробные или мутантные клетки и в большинстве случаев делает необязательным применение для детекции ДНК-гибридизации.
Открытие Карри Мюллисом в 1983 году (США) метода полимеразной цепной реакции послужило толчком к активному развитию разнообразных технологий амплификации нуклеиновых кислот.
По сути, все методы амплификации имитируют природную возможность репликации ДНК. При этом in vitro происходит изолированное умножение гена или его фрагментов (амплификация) в миллионы раз.
Все методы амплификации могут быть разделены в зависимости от изменения температурных режимов на:
1)методы амплификации с циклической сменой температурных параметров: методы ПЦР, лигазной цепной реакции (ЛЦР) и их модификации;
2)изотермальные методы амплификации нуклеиновых кислот: метод изотермальной транскрипционной амплификации (TAS), самоподдерживающая репликация последовательностей (3SR, NASBA), амплификация с вытеснением цепи (АВЦ), амплификация с использованием QB-репликазы.
Все методы амплификации состоят из трех основных этапов:
16
1)Подготовка исследуемого образца в целях выделения ДНК (РНК) из клеток;
2)Непосредственная амплификация выделенных участков (копий) ДНК (РНК).
3)Детекция продуктов, полученных на втором этапе.
Полимеразная цепная реакция
Всовременной лабораторной диагностике ПЦР занимает особое место. Метод ПЦР поднял клиническую лабораторную диагностику на принципиально иную высоту – уровень определения нуклеиновых кислот (ДНК
иРНК), что позволяет провести прямое обнаружение инфекционного агента или генетической мутации в любой биотической или абиотической среде. При этом способом ПЦР, теоретически, может быть обнаружена всего одна искомая молекула НК среди миллионов других молекул НК.
Чрезвычайно важную роль играет этот метод в диагностике инфекционных заболеваний. Внедрение в практику этого метода наряду с серологической диагностикой существенно расширило возможности современной клинической микробиологии, основу которой до сих пор составляют методы выделения и культивирования микроорганизмов на искусственных питательных средах или в культуре клеток.
Втех случаях, когда использование культуральных методов является проблематичным или связано с недостаточной диагностической эффективностью, возможность замены биологической амплификации (то есть роста на искусственных средах) на ферментативное удвоение нуклеиновых кислот in vitro с помощью ПЦР представляется особенно привлекательной. Существуют различные подходы к использованию ПЦР для диагностики возбудителей инфекций. Наиболее распространенный вариант ПЦР (specific PCR) предусматривает использование праймеров, комплементарных специфической последовательности ДНК, характерной для строго определенного вида микроорганизма. Например, ПЦР-амплификация специфического участка гена, кодирующего главный белок наружной мембраны (МОМР) Chlamydia trachomatis, в сочетании с нерадиоактивной гибридизацией для детектирования продуктов реакции позволяет обнаружить единичные копии хламидийной ДНК в исследуемых образцах. При этом ПЦР значительно превосходит по диагностической эффективности культивирование и методы прямого обнаружения хламидийного антигена (микроиммунофлюоресценцию и иммуноферментный анализ), традиционно используемые для выявления C. trachomatis.
Принцип метода ПЦР Полимеразная цепная реакция – искусственный процесс многократно-
го копирования (амплификации) специфической последовательности ДНК,
17
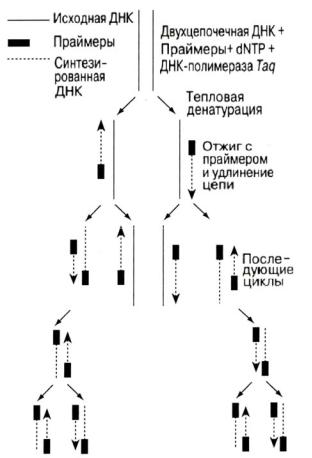
осуществляемый in vitro (рис. 3). Копирование ДНК при ПЦР осуществляется специальным ферментом – ДНК-полимеразой, как и в клетках живых организмов. ДНК-полимераза, двигаясь по одиночной цепи ДНК (матрице), синтезирует комплементарную ей последовательность ДНК. Для начала синтеза цепи ДНК ДНК-полимеразе необходима РНК-затравка (праймер), к которой она может начать присоединять нуклеотиды. Основной принцип ПЦР состоит в том, что реакция полимеризации (синтеза полимерной цепи ДНК из мономерных нуклеотидных звеньев) инициируется специфическими праймерами (короткими фрагментами «затравочной» ДНК) в каждом из множества повторяющихся циклов. Специфичность ПЦР определяется способностью праймеров «узнавать» строго определенный участок ДНК и связываться с ним согласно принципу молекулярной комплементарности.
В обычной реакции ПЦР используется пара праймеров, которые «ограничивают» амплифицируемый участок с двух сторон, связываясь с противоположными цепями ДНК-матрицы. Для многократного увеличения количества копий исходной ДНК нужна цикличность реакции. Как правило, каждый из последовательно повторяющихся циклов ПЦР состоит из трех этапов:
1)денатурации, или «плавления» ДНК, когда двухцепочечная ДНК под действием высокой температуры (92–95 °С) переходит в одноцепочечное состояние;
2)связывания (отжига) праймеров с одноцепочечной матричной ДНК (температура 45–60 °С);
3)элонгации, или полимеризации, или удлинения цепи. При температуре 65–72 °С происходит синтез комплементарной цепи на ДНК-матрице, начинающийся от места гибридизации праймера и происходящий в направ-
лении 5’→3’.
Смена этапов каждого цикла осуществляется путем изменения температуры реакционной смеси. Сначала праймеры могут связаться только с определенной последовательностью исходной ДНК, но в последующих циклах они связываются с копиями этой последовательности, синтезированными в предыдущих циклах. При этом количество основного продукта ПЦР (копии последовательности ДНК, ограниченной праймерами) теоретически удваивается в каждом цикле, то есть растет с числом циклов экспоненциально. Число указанных циклов в ПЦР составляет обычно от 25 до 40 (через
nциклов будет 2n копий исходной молекулы ДНК-мишени).
Вреакции используются термостабильные ДНК-полимеразы, выдерживающие высокую температуру на всех этапах цикла ПЦР в течение нескольких десятков циклов. Количество коммерчески доступных термостабильных ДНК-полимераз, отличающихся некоторыми своими свойствами, достаточно велико. Наиболее часто используется Taq-ДНК-полимераза, первоначально выделенная из термофильного микроорганизма Thermus aquaticus. Другие полимеразы чаще применяются для особых приложений
18
ПЦР. Современные коммерческие препараты термостабильных полимераз обеспечивают, как правило, стабильную воспроизводимую активность, что позволяет использовать технологию ПЦР в стандартной лабораторной практике.
Таким образом, ПЦР позволяет осуществлять амплификацию в пробирке при помощи фермента термостабильной ДНК-полимеразы (Taq-ДНК- полимеразы) из четырех дезоксинуклеозидтрифосфатов (dNTP), являющихся структурными элементами ДНК, и коротких олигонуклеотидных 20–30- членных затравок (праймеров), комплементарных 3’-концевым последовательностям антипараллельных цепей ДНК гена.
Рис. 3. Механизм полимеразной цепной реакции
Кинетика ПЦР имеет экспоненциальный характер только на начальном этапе (20–25 циклов), после чего начинается выход на плато (после 40– 45 циклов) в силу: 1) истощения dNTP и праймеров, 2) нарастающего температурного повреждения Taq-ДНК-полимеразы, 3) конкуренции за фермент амплификонов, когда их число начнет превышать число молекул Taq- ДНК-полимеразы. При содержании в ПЦР-пробирке около 10 молекул ДНК-матриц, как правило, достаточно 35 циклов.
19
Подготовка проб для ПЦР-амплификации ДНК-матрицы
Благодаря пробоподготовке происходит концентрирование исследуемой ДНК-матрицы в малом объеме и удаление ингибиторов Taq-ДНК- полимеразы (например, гемоглобина). При отсутствии такой необходимости подготовка пробы может быть полностью исключена. Например, вирус гепатита В в сыворотке крови и многие возбудители инфекционных менингитов в спинномозговой жидкости можно детектировать методом ПЦР без всякой подготовки, без предварительного выделения из них ДНК. В большинстве же случаев из исследуемой пробы крови, сыворотки, лейкоцитов, биоптатов тканей, мочи, мокроты для исключения ложноотрицательного результата следует выделить ДНК тем или иным способом. При этом необходимо учитывать, что содержание ДНК в геномах клеток человека, грибков, бактерий и вирусов различается в десятки раз (например, содержание ДНК в геноме диплоидной клетки человека составляет примерно 7 × 10–12 г,
ав геноме СМV (цитомегаловируса) – 0,25 × 10–15 г).
Впоследние годы ряд фирм производит наборы для быстрой экстракции ДНК или РНК из различных материалов, подвергаемых анализу методом ПЦР, обычно включающие специфические сорбенты НК. Общее количество ДНК, вносимой в пробирку для ПЦР, не должно превышать 1 мкг, поскольку большой избыток неспецифической ДНК снижает специфичность и чувствительность ПЦР-амплификации ДНК-матрицы.
Подготовка пробы материала (выделение ДНК или РНК) должна проводиться в условиях, исключающих перекрестное загрязнение исследуемых проб выделяемыми нуклеиновыми кислотами.
Постановка ПЦР
Пятью основными компонентами (реактивами) ПЦР являются следующие:
а) фермент Taq-ДНК-полимераза;
б) пара олигонуклеотидных праймеров (смысловой и антисмысловой);
в) 4 типа dNTP;
г) копируемая ДНК; д) ионы Mg2+.
Вспомогательными компонентами являются буферный раствор и минеральное масло.
Фермент Taq-ДНК-полимераза, полученная из термостабильных организмов Thermus aquaticus, при оптимальных условиях ПЦР содержится в 50–100 мкл реакционной смеси в количестве 0,5–2 единицы. Она и синтезирует цепь ДНК до 1000 пар оснований в минуту до заданной длины в несколько сотен или тысяч пар нуклеотидов.
Праймеры каждый раз встраиваются в амплифицируемые фрагменты ДНК-матрицы (амплификоны), поэтому они в реакционной смеси ПЦР при-
20
