
- •Введение.
- •Правила вычисления абсолютной погрешности.
- •Международная система единиц – си
- •Множители и приставки си для образования десятичных, кратных и дольных единиц
- •Лабораторная работа № 1 неупругий удар
- •Лабораторная работа №2. Проверка основного закона динамики поступательного движения
- •Теоретическое введение
- •Лабораторная работа № 3 Определение момента инерции твердого тела.
- •Лабораторная работа №4 проверка законов свободного падения тел
- •Лабораторная работа №5 Определение коэффициента вязкости жидкости
- •Лабораторная работа №6 Определение отношения молярных теплоемкостей газа ср сv методом адиабатического расширения
- •Лабораторная работа №7 изотермический процесс
- •Лабораторная работа №8 Изучение движения электронов в электростатических полях
- •Теоретическое введение
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Контрольные вопросы
- •Лабораторная работа №9 Определение электроемкости конденсатора
- •Теоретическое введение
- •Описание установки
- •Лабораторная работа №10 Исследование энергетических характеристик электрической цепи постоянного тока
- •Теоретическое введение
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Контрольные вопросы
Лабораторная работа №6 Определение отношения молярных теплоемкостей газа ср сv методом адиабатического расширения
Цель работы:изучить термодинамические процессы в воздухе и определить отношение теплоемкости воздуха при постоянном давлении к теплоемкости при постоянном объеме методом адиабатического расширения (методом Клемана-Дезорма).
Приборы и принадлежности: прибор Клемана-Дезорма.
Теоретические сведения
Теплоемкостью какого-либо вещества,
называется физическая величина, численно
равная количеству теплотыQ,
которое нужно сообщить телу, чтобы
повысить его температуру на один градус: .
.
Теплоемкость единицы массы вещества
называется удельной теплоемкостью, С
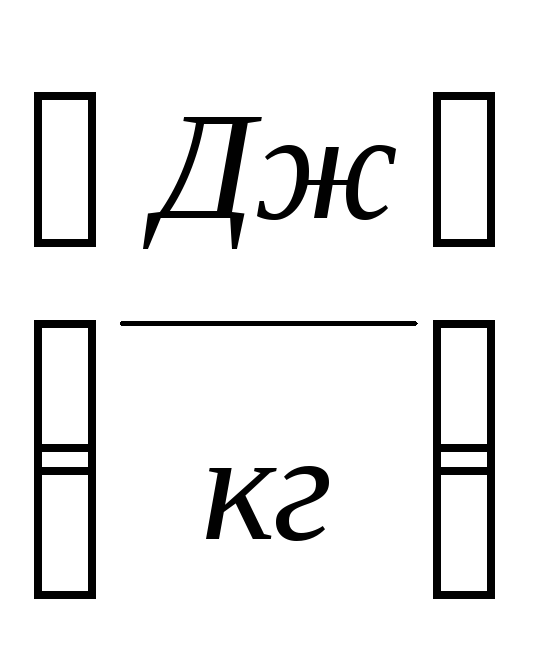 .
.
Молярной теплоемкостью называется
физическая величина, численно равнаятеплоте, которую нужно
сообщить одному молю вещества при
изменении его температуры на один
кельвин в рассматриваемом термодинамическом
процессе,С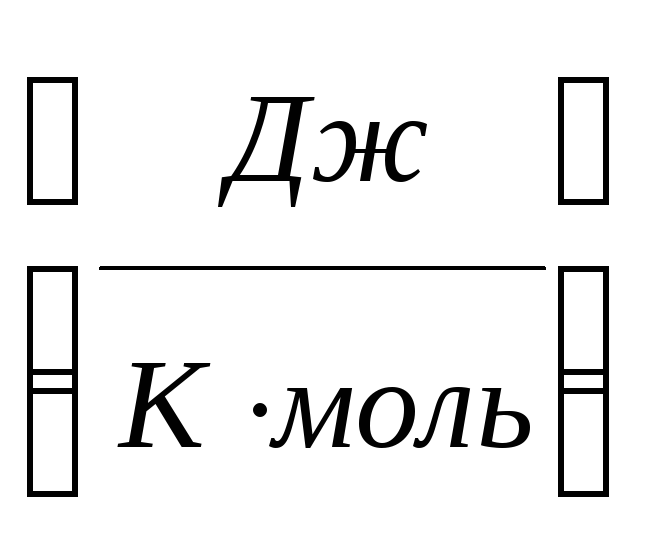 .
.
Величина теплоемкости зависит от условий, при которых происходит нагревание вещества. Рассмотрим …….
В соответствии с первым началом
термодинамики сообщение газу количества
теплоты
![]() расходуется на увеличение внутренней
энергии газа
расходуется на увеличение внутренней
энергии газа![]() и совершением газом работы
и совершением газом работы![]() :
:
![]() .
.
При изохорном нагревании объем газа V остается постоянным,
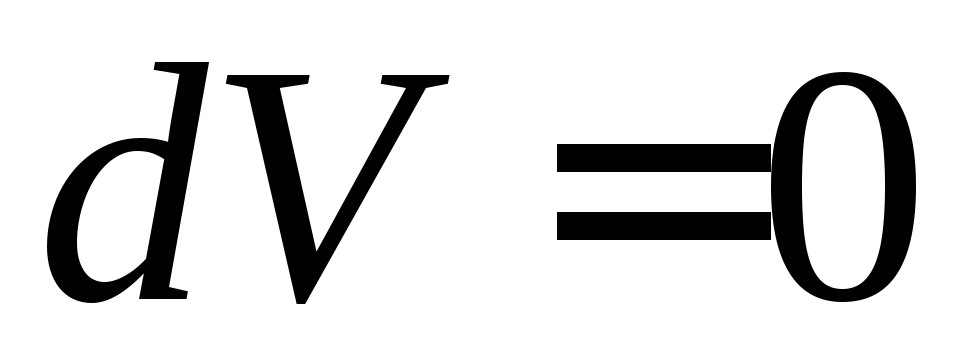 ,
и газ не совершает работу
,
и газ не совершает работу ;
тогда
;
тогда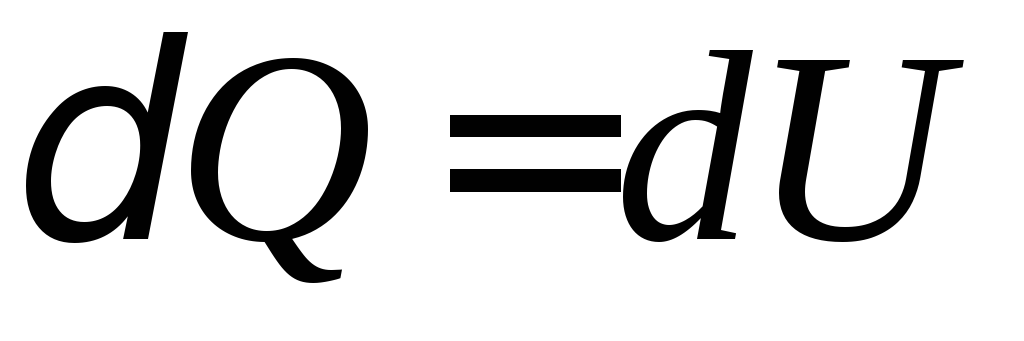 и молярная теплоемкость при постоянном
объеме определяется так:
и молярная теплоемкость при постоянном
объеме определяется так: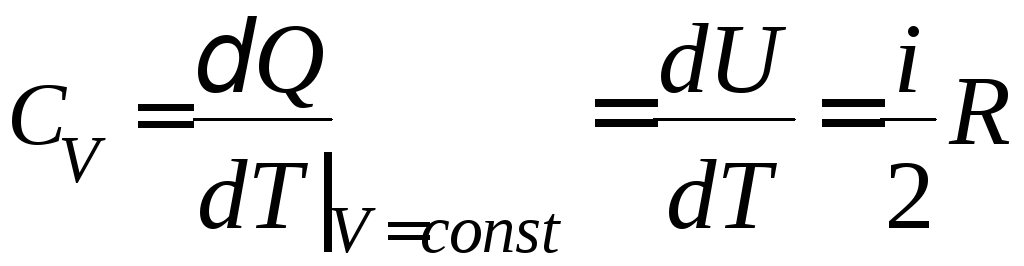 ,
,
где
 - внутренняя энергия одного моля
идеального газа,
і-
число степеней свободы молекулы
газа.
- внутренняя энергия одного моля
идеального газа,
і-
число степеней свободы молекулы
газа.
При изобарном нагревании газа давление остается постоянным. Газ, расширяясь, совершает работу (для одного моля газа)
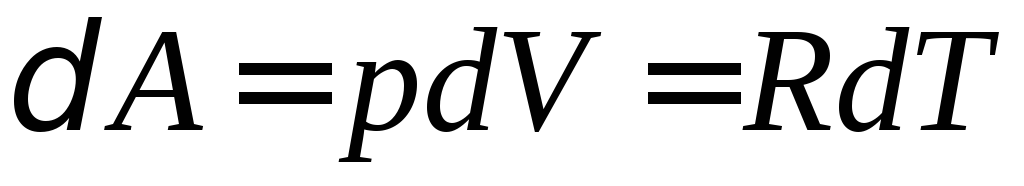 .
.
Следовательно,
![]() .
.
Таким образом, теплоемкость при постоянном давлении
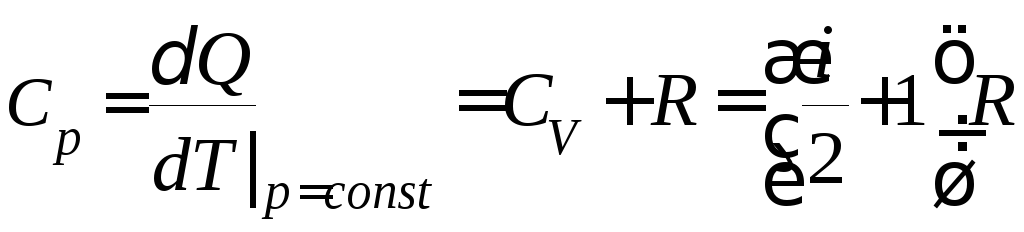 .
.
Отношение молярных теплоемкостей,
является одной из важных термодинамических
величин и называется показателем
адиабаты (коэффициентом Пуассона)
![]() :
:
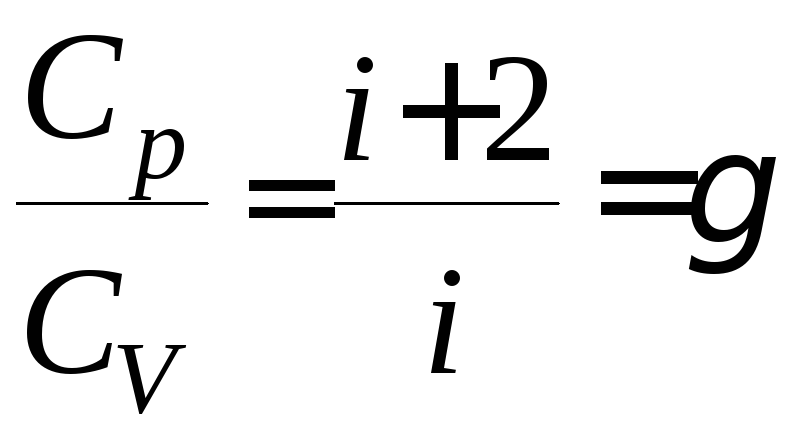 .
.
Величина показателя адиабаты зависит только от числа степеней свободы газовых молекул:
для одноатомных газов
![]() :
:
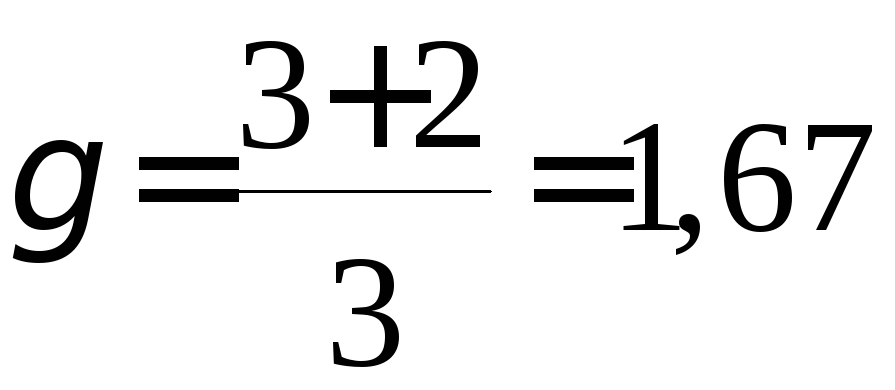 ,
,
для двухатомных газов (молекулы с
жесткими связями) ![]() :
:
 ,
,
для многоатомных газов (молекулы с
жесткими связями)
![]() :
:
 .
.
В данной работе показатель адиабаты определяется для воздуха, который в основном состоит из двухатомных молекул О2, N2, … и с определенной погрешностью может быть описан с помощью уравнений используемых для идеального газа.
В эксперименте реализуется адиабатно-изохорно-изотермический цикл. Циклом или круговым процессом называется совокупность термодинамических процессов, в результате которых система возвращается в первоначальное состояние.
Адиабатическим называется термодинамический процесс, протекающий без теплообмена с окружающей средой.
Уравнением адиабатического процесса является уравнение Пуассона:
![]() .
.
Изохорным называется термодинамический процесс, протекающий при постоянном объеме (V=const), то есть
 .
.
Изотермическим называется термодинамический процесс, протекающий при постоянной температуре (T=const), то есть
![]() .
.
Описание установки и методика проведения эксперимента
Р ассматриваемый
метод определенияСР
СV
и экспериментальная
установка для его реализации впервые
были предложены французским ученым
Клеман-Дезормом в 1819 году. Схема
экспериментальной установки представлена
на рис. 1.
ассматриваемый
метод определенияСР
СV
и экспериментальная
установка для его реализации впервые
были предложены французским ученым
Клеман-Дезормом в 1819 году. Схема
экспериментальной установки представлена
на рис. 1.
1. баллон
2. насадка
3. клапан
4. кран К
5. манометр
6. насос
Рис.1
Прибор Клемана - Дезорма состоит из баллона с воздухом 1, водяного манометра 5 и насоса 6. Баллон с воздухом 1, через насадку 2 может сообщаться либо с насосом через клапан 3, либо с атмосферой через кран 4.
В настоящей работе реализуется классический метод, основанный на исследовании поведения некоторой массы газа, последовательно проходящего через три состояния (см. диаграмму рV, рис.2). Из состояния 1 в состояние 2 газ переходит путем адиабатического расширения, из 2 в 3 – изохорически, из 3 в 1 – изотермически.
В исходном состоянии кран 4 открыт и давление в баллоне равно атмосферному давлению р2= ратм. Закроем кран и с помощью насоса быстро накачаем воздух в баллон. При сжатии повышается давление воздуха относительно атмосферного, при этом воздух нагревается. Давление, установившееся в баллоне
![]() ,
,
где р2– атмосферное давление, измеренное в мм вод. столба,
![]() - показание манометра (разность уровней
жидкости в коленах манометра), выраженное
в тех же единицах измерения, что ир2.
- показание манометра (разность уровней
жидкости в коленах манометра), выраженное
в тех же единицах измерения, что ир2.
Работа, затраченная на сжатие газа, превращается в теплоту, которая отводится через стенки баллона в атмосферу. То есть вследствие теплообмена воздуха с окружающей средой через некоторое время температура воздуха в баллоне сравнится с температурой внешней среды Т1(изохорное охлаждение).
Таким образом, состояние воздуха внутри баллона (состояние 1 на рис.2) характеризуется параметрами р1,V1,Т1.
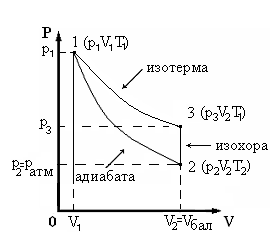
Рис.2
Пусть масса воздуха после накачивания
насосом в баллон объемом V2равнаm.
Откроем кран, при этом часть воздуха
выходит из баллона. Обозначим массу
вышедшего воздухаΔm,
тогда масса оставшегося воздуха![]() .
Эта масса перед открытием крана занимала
меньший объемV1(V1– часть объемаV2)
при давлении р1 и
температуре Т1 . Так как
процесс выпускания воздуха кратковременный
и заметного теплообмена между газом и
стенками баллона нет, то его можно
считать процессом адиабатического
расширения. Адиабатическое расширение
сопровождается понижением давления в
нашем случае до атмосферногоp2(столбы водяного манометра уравниваются)
и понижением температуры до
.
Эта масса перед открытием крана занимала
меньший объемV1(V1– часть объемаV2)
при давлении р1 и
температуре Т1 . Так как
процесс выпускания воздуха кратковременный
и заметного теплообмена между газом и
стенками баллона нет, то его можно
считать процессом адиабатического
расширения. Адиабатическое расширение
сопровождается понижением давления в
нашем случае до атмосферногоp2(столбы водяного манометра уравниваются)
и понижением температуры до![]() .
.
Состояние воздуха в баллоне после расширения до закрытия крана (состояние 2) характеризуется параметрами p2,V2,T2.
Для газа массой m11 и 2 состояния связаны уравнением Пуассона:
![]() или
или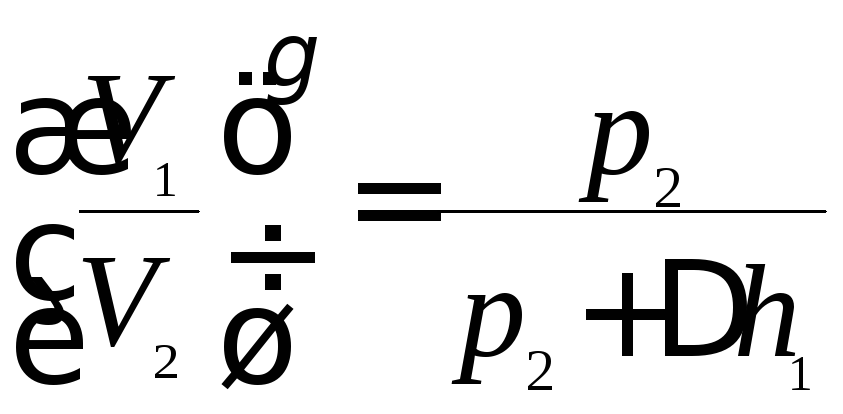 .
(3)
.
(3)
При повторном закрывании крана и
отключении баллона от атмосферы воздух
изохорно нагревается вследствие
теплообмена с окружающей средой,
температура и давление увеличиваются
при постоянном объеме, столбики манометра
расходятся до расстояния
![]() (состояние 3). Состояние 3 характеризуется
параметрами
(состояние 3). Состояние 3 характеризуется
параметрами![]() ,V2,T1.
,V2,T1.
Состояния 1 и 3 связаны уравнением Бойля – Мариотта (так как T=const)
![]() или
или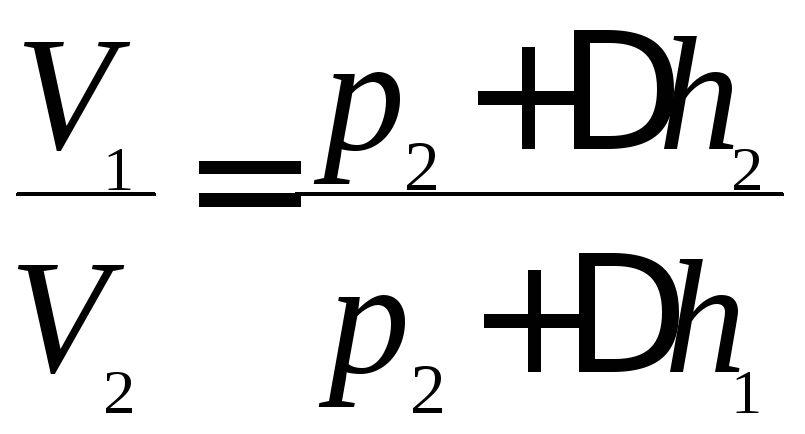 .
(4) Возведем уравнение
(4) в степеньγ:
.
(4) Возведем уравнение
(4) в степеньγ: .
(5) На основании (3) и (5)
запишем:
.
(5) На основании (3) и (5)
запишем: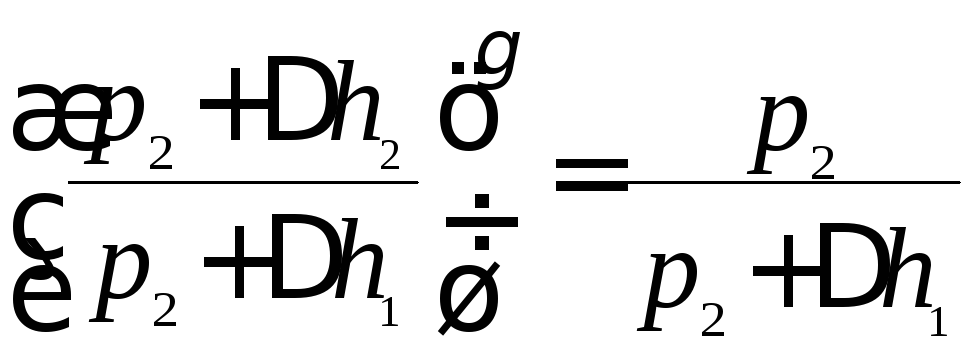 .
(6) Логарифмируя
соотношение (6), получим:
.
(6) Логарифмируя
соотношение (6), получим:
 .
(7)
.
(7)
Откуда
 .
(8)
.
(8)
Для дальнейших
преобразований разложим
![]() и
и![]() в ряд Тейлора, ограничившись двумя
первыми членами:
в ряд Тейлора, ограничившись двумя
первыми членами:
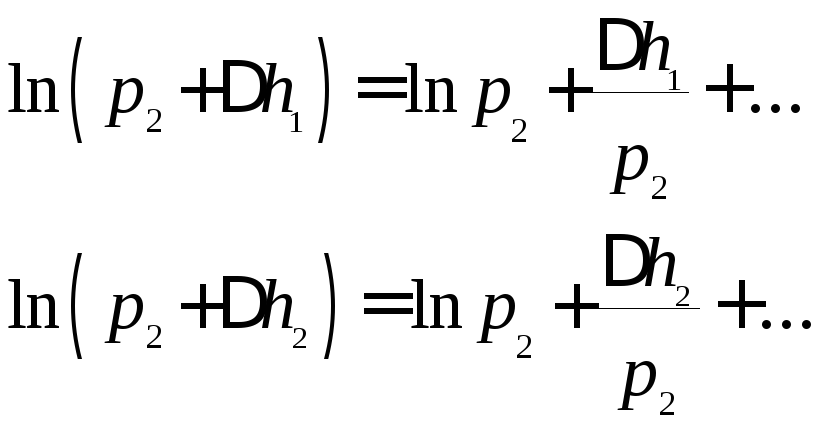 .
.
Подставляя эти выражения в формулу (8), получим
 .
(9)
.
(9)
Итак, для определения показателя адиабаты γнеобходимо измерить разность уровней жидкости в коленах манометра перед адиабатическим расширением и после него.
Порядок выполнения работы
1. Накачать воздух в баллон так, чтобы величина ∆h1, показываемаяU-образным манометром составляла 20-25 см вод.ст.. Значение∆h1 записать в таблицу.
2. Открыть кран, при этом давление и температура газа понижаются, и столбики жидкости в коленах манометра уравниваются.
3. Закрыть кран, отключив баллон с газом от атмосферы. Дождаться нагревания воздуха в баллоне. Зарегистрировать перепад давления ∆h2.Записать полученное значение в таблицу.
4. Повторить опыт 10 раз.
5. При помощи калькулятора произвести вычисления.
6. Сделать вывод о проделанной работе.
7. Ответить на контрольные вопросы.
Обработка результатов измерений
1. Показатель адиабаты γрассчитать по формуле (9).
2. Относительную погрешность определить как при многократных измерениях по формуле
 .
.
Таблица измерений
|
№ пп |
∆h1, м |
∆h2, м |
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
| |
|
3 |
|
|
|
| |
|
4 |
|
|
|
| |
|
5 |
|
|
|
| |
|
6 |
|
|
|
| |
|
7 |
|
|
|
| |
|
8 |
|
|
|
| |
|
9 |
|
|
|
| |
|
10 |
|
|
|
| |
|
Среднее значение |
-- |
-- |
|
|
Контрольные вопросы:
1)Дать определение молярной и удельной теплоемкости.
2)Объяснить, почему теплоемкость газа зависит от условий теплообмена.
3) Что понимают под числом степеней свободы. Сформулируйте закон равномерного распределения энергии.
4)Какова связь между молярными теплоемкостямиСPиСVи числом степеней свободы?
5) Сформулируйте первое начало термодинамики.
6)Какой процесс называется адиабатическим, и какому уравнению состояния этот процесс подчиняется? Нарисовать график процесса в координатах рV, VТ, ТS.
7)В каких пределах может изменяться показатель адиабаты для идеальных газов?
