
BIO_-_vsyo
.pdfнаследсвенные свойства бактерия, была установлена лишь в 1944 году О. Эйвери. , доказавшим его принадлежность к нуклеиновым кислотам( Днк).
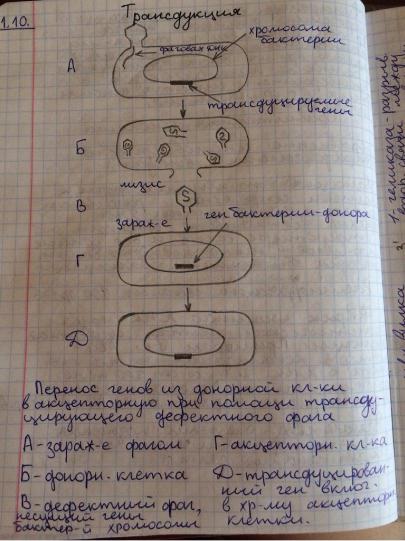
32. Экспериментальные доказательства генетической роли нуклеиновых кислот. Трансдукция.
Сущность свления трансдукции и способ его открытия состоит в следующем. U-образная труюка в нижней части была разделена бактериальным фильтром. В одну половину этой трубки были помещены бактерии мышиного тифа штамма 22А, а в другую половину трубки штамма 2А., лизогенную по фагу. При этом бактериальные клетки не могли переходить сквозь перегородку. Штамм 22А нес мутацию, тормозящую синтез трипотофана, и поэтому культивированные бактерии нуждались в добаке триптофана в среду. Штамм бактерии 2А синтезировал триптофан, поэтому не нуждался в нем при культивировании. После инкубации этих двух штаммов в трубке, разделенной только бактериальным фильтром, был произведен рассев клеток обоих штаммов. При рассеве клеток штамма 22А на среде, лишенной триптофана, было обнаружено небольшое число колоний. Следовательно, некоторые клетки штамма 22А каким-то образом приобрели способность синтезировать триптофан и смогли дать колонии на среде без этой аминокилосты.
Можно было предположить, что эти измененные клетки появились или в результате обратной мутации от trp- к trp+ или в результате перехода трансформирующего фактора от штамма 2А. Но штамм 22А отличается высокой стабильностью, и поэтому указанную частоту появление клеток генотипа trp+ нельзя было объяснить возникновением обратных мутаций. Трансформирующий фактор в среде также не был обнаружен. Следовательно, перенос мог произойти только с помощью фага из штамма 2А. Фаг, вышедший из бактериальных клеток штамма 2А, проник через фильтр, внедрился в некоторые клетки штамма 22А и передал им часть наследвенной информации-фрагмент наследственного материала штамма 2а. Явление переноча бактериофагом наследственной информации от одних юактерий другим-новая форма рекомбинации генов-получило название трансдкукции.
Механизм этого явления заключается в том, что трансдуцирующий бактериофаг при размножении в клетках хозяина захватывает часть его генетического материала и переносит во вновь зараженные клетки. Фаг может переносить самые различные гены бактерий. Как правило, одновременно трансдуцируется один, реже два тесно сцепленных гена и очень редко три.
33. Классификация генов человека по структуре.
Уники - одна или несколько раз повторяющаяся информация о структуре белков. Их мутации наиболее опасны.
Умеренные - десятки, сотни копий кодирующих рРНК, тРНК, иРНК, гистоны, гены рибосомных белков.
Множественные повторысотни, тысячи,млн копий отрезков ДНК. Теломерные и центромерные участки хромосом, ALu повторы
ПГЭ-подвижные (мобильные) генетические элементы дисперсно разбросаны по геному (эндогенные вирусы)Это чужеродные геномы вирусов, молекулярные останки вирусов(провирусы), которые когда-то внедрились в геном и там остались.
34. Классификация генов человека по функциям.
1)РНК-Кодирующие гены – функционально активны уже РНК продукты. Н-р: рРНК для инактивации Х хромосомы у женщин. К ним относятся: тРНК,рРНК,м/яРНК 2)Протеин-кодирующие гены. К ним относятся:
• Гены «Домашнего хозяйства» - гены жизнеобеспечения клетки
•Гены роскошных синтезов(терминальной дифференцировки)- кодирующие белки характерные для высокоспециализированных клеток. (Н-р: гемоглобин в эритроцитах)
•Регуляторные геныкодируют регуляторные белки репрессоры и активаторы, способные соединяться с регуляторными элементами ДНК. В результате транскрипция либо подавляется, либо стимулируется. Эти гены имеют не большие размеры и высоко консервативны. Стерессорные гены кодируют стрессорные белки (белки теплового шока). Эти белки защищают клетку от повреждения и гибели в экстремальных условиях.
3) Гены МТХкодирующие и регуляторные участки непрерывны. Мутации этих геновмитохондриальные болезни. Наследуются по материнской линии. Анализ этих генов показал, что все женщины-потомки одной Евы
35. Генетический полиморфизм и разнообразие геномов человека. Нейтральные мутации.
Нейтральные мутации обычно не влияют на жизнедеятельность организма (например, мутации, вызывающие веснушки, изменение цвета волос, радужной оболочки глаза). Генетический полиморфизм - разнообразие геномов в популяции. ГПналичие небольших отклонений в нуклеотидной последовательности ДНК, которые совместимы с норм функцией генома. но приводят к вариациям в структуре белков и таким образом формируется биохимический индивидуализм каждого чел.(бх фингерпринт) ГПявляется нейтрализацией, если доля мутаций превышает 1%.
Причины ГП в различных популяциях:
1.ГП затрагивает экзоны генов ,на долю которых приходится 5-10% ДНК всего генома. 2.ГП затрагивает интроны ,составляющие 90-95% генома.
Генетический полиморфизм:
•качественный (замена нуклеотидов)
•количественный (в ДНК варьируют нуклеотидные повторы разной протяжон-ти)
36. Современные данные по антропогенезу. Новый взгляд на эволюцию
Homo sapiens.
Антропогенез — процесс историко-эволюционного формирования физического типа человека, первоначальное развитие его трудовой деятельности, речи, а также общества. Эволюционная ветвь человека отделилась от общего с другими приматами ствола около 4 млн лет назад. Человек и его ближайшие предки называются гоминидами. В настоящее время они представлены только одним видом — человеком разумным. 2 млн лет назад их было не меньше трёх. Останки древнейших гоминид найдены в Южной и Восточной Африке и принадлежали разным видам — австралопитекам и человеку умелому. У них разный объём головного мозга, различные формы черепов, но они ходили на двух ногах. Человек умелый, живший одновременно с австралопитеком (2,3–1,8 млн лет назад), первым из гоминид умел пользоваться примитивными каменными орудиями и огнём. Его мозг был гораздо больше, чем у австралопитека, но меньше, чем у современного человека. Со временем человек умелый превратился в человека прямоходящего (появился 2 млн лет назад), который впервые покинул Африку и проник в Азию, а потом и в Евразию. Этот человек пользовался более крупными орудиями (ручные рубила, острия и кливеры), чем ранние гоминиды. При их изготовлении применялась новая технология — оббивка каменной заготовки с двух сторон. Он со временем превратился в человека разумного, а тот — в современного. Впервые человек разумный появился в Африке и Европе около 500 тыс. лет назад. В Европе он эволюционировал в неандертальца (его кости были найдены в 1856 г. в долине Неандерталь в Германии). Считается, что к тому времени, когда в Азии и Европе появились современные люди, неандертальцы стали постепенно вымирать. 40 тыс. лет назад современные люди заселили большую часть мира.Археологи сделали открытие,
которое позволяет по-новому взглянуть на эволюцию предков современного человека.Человек освоил довольно сложный и трудоемкий процесс изготовления копий и ножей из камня, по крайней мере, на 50 тысяч лет раньше, чем предполагали ученые.Как свидетельствуют результаты исследований, наши далекие предки научились точить предметы под давлением не позднее 75 тысяч лет назад.
37. Биохимическая уникальность человека. Гены предрасположенности.
Биохимическая уникальность определяет нашу устойчивость или, наоборот, чувствительность к различными внешним воздействиям, нашу предрасположенность к мультифакториальным заболеваниям. Гены предрасположенности 10-20 процентов всего генома (22-29 тыс. генов)
Гены внешней среды. Отвечают за метаболизм ксенобиотиков. Эти гены определяют реакции организма на неблагоприятную внешнюю среду. Гены кодируют белки(ферменты), отвечающие за детоксикацию ксенобиотиков (любые чужеродные вещества, включая лекарственные препараты, поступающие в организм). Важна роль этих генов в процессах интоксикации и канцерогенеза.
Гены триггеры(ключевые)
Их продукты играют ключевую роль в биохимических процессах. При мутациях их функции нарушаются. Это приводит к мультифакториальным заболеваниям.(остеопороз, инфаркт, онкология)
Гены рецепторов Эти гены кодиюруют рецепторные белки, определю поступление веществ в клетку, в том
числе лекарственных, инфекционных агентов и прочих ксенобиотиков.
38. Организация генома митохондрий. Митохондриальные болезни.
Геном митохондрий человека представлен кольцевой двухцелочечной молекулой ДНК, содержащей 16559 п.н. Доля митохондриальной ДНК от общего количества ДНК достигает 5%. Митохондриальная молекула ДНК состоит из тяжелой (Н) и легкой (L) - цепей. Цепи различаются по нуклеотидному составу. Н-цепь (heavy) содержит больше пурина, легкая L-цепь (ligbt) - больше пиримидина. Митохондриальный геном человека, как и других организмов, представляет собой полуавтономную генетическую систему. Большая часть генов человека локализована в хромосомах ядра, и меньшая - в митохондриальном геноме. 1987г-Адан Уилсон исследовал ДНК 147 представителей различных расс(женщин). Анализ показал, что все мтДНК можно представить как происходящие от одной предковой. Общаа праматерь, к которой восходят все типы мтДНК современных людей, жила в Восточной Африке менее 200тыс лет назад. Митохондрии — это внутриклеточные органеллы, имеющие небольшую собственную хромосому. В отличие от ядерной ДНК, которая содержит подавляющее большинство генов и в процессе полового размножения подвергается рекомбинации, так что потомки получают половину генов от отца, а вторую половину от матери, митохондрии и их ДНК ребёнок получает только из материнской яйцеклетки. Поскольку митохондриальная ДНК не подвергается рекомбинации, изменения в ней могут происходить исключительно посредством редких случайных мутаций. Митохондриальные заболевания — группа наследственных заболеваний, связанных с дефектами в функционировании митохондрий, приводящими к нарушениям энергетических функций в клетках эукариотов, в частности
— человека. Митохондриальные заболевания обусловлены генетическими, структурными, биохимическими дефектами митохондрий, приводящими к нарушениям тканевого дыхания. Они передаются только по женской линии к детям обоих полов, так как сперматозоиды передают зиготе половину ядерного генома, а яйцеклетка поставляет и вторую половину генома, и митохондрии. Патологические нарушения клеточного
энергетического обмена могут проявляться в виде дефектов различных звеньев в цикле Кребса, в дыхательной цепи, процессах бета-окисления и т. д. Эффекты митоходриальных заболеваний очень разнообразны. Из-за различного распределения дефектных митохондрий в разных органах, мутация у одного человека может привести к заболеванию печени, а у другого — к заболеванию мозга. Величина проявления дефекта может быть большой или малой, и она может существенно изменяться, медленно нарастая во времени. Некоторые небольшие дефекты приводят лишь к неспособности пациента выдерживать физическую нагрузку, соответствующую его возрасту, и не сопровождаются серьёзными болезненными проявлениями. Другие дефекты могут быть более опасны, приводя к серьёзной патологии.В общем случае, митоходриальные заболевания проявляются сильнее при локализации дефектных митохондрий в мышцах, мозге, нервной ткани,[2] поскольку эти органы требуют больше всего энергии для выполнения соответствующих функций. Для постановки диагноза митохондриального заболевания важен комплексный генеалогический, клинический, биохимический, морфологический и генетический анализ
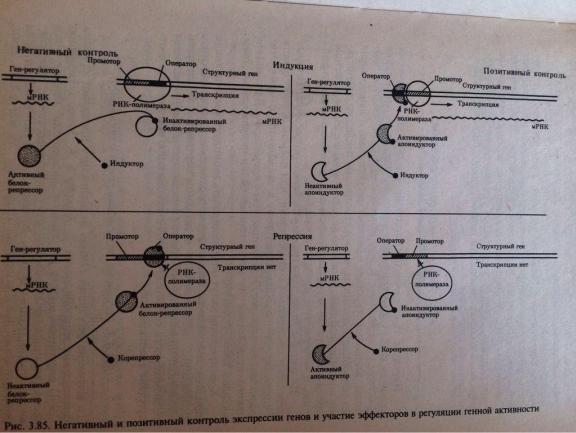
39. Общие принципы генетического контроля экспрессии генов.
Важнейшим фактором регуляции генной активности являются элементы генома, отвечающие за синтез регуляторных белков,— гены-регуляторы. Соединяясь с определенными нуклеотидными последовательностями ДНК, предшествующими структурной части регулируемого гена,—операторами, белки-регуляторы способствуют или препятствуют соединению РНК-полимеразы с промотором. Если белок-регулятор взаимодействует с оператором, занимающим часть промотора или расположенным между ним и структурной частью гена, то это не дает возможности РНК-полимеразе соединиться с промоторной последовательностью и осуществить транскрипцию. Такой белок называют репрессором, и в этом случае осуществляется негативный контроль экспрессии гена со стороны гена-регулятора (рис. 3.85). Если промотор обладает слабой способностью соединяться с РНК-полимеразой, а ему предшествует область, узнаваемая белком-регулятором, присоединение последнего непосредственно перед промотором к молекуле ДНК облегчает связывание РНК-полимеразы с промотором, вслед за чем следует транскрипция. Такие белки называют активаторами (или апоиндукторами), а контроль экспрессии гена со стороны гена-регулятора — позитивным.
40. Нейтральные мутации. Генетический полиморфизм. Нейтральные.
Нейтральные мутации, не дающие организму преимуществ или недостатков, не поддаются действию естественного отбора. С генетической точки зрения, эти мутации изменяют кодон так, что он не меняет кодируемой аминокислоты или меняет ее на другую, вполне приемлемую. Нейтральные мутации имеют тенденцию уходить из популяции посредством генетического дрейфа.
Генетический полиморфизм - сосуществование в пределах популяции, двух или нескольких различных наследственных форм, находящихся в динамическом равновесии в течение нескольких и даже многих поколений. Чаще всего Г. п. обусловливается либо варьирующими давлениями и векторами (направленностью) отбора в различных условиях (например, в разные сезоны), либо повышенной относительной жизнеспособностью гетерозигот. Один из видов Г. п. — сбалансированный Г. п. — характеризуется постоянным оптимальным соотношением полиморфных форм, отклонение от которого оказывается неблагоприятным для вида, и автоматически регулируется (устанавливается оптимальное соотношение форм). В состоянии сбалансированного Г. п. у человека и животных находится большинство генов. Различают несколько форм Г. п., анализ которых позволяет определять действие отбора в природных популяциях.
41. Генетически модифицированные продукты. Польза или вред?
Генетически модифицированная пища — это продукты питания, полученные из генетически модифицированных организмов (ГМО) — растений, животных или микроорганизмов. Продукты, которые получены при помощи генетически модифицированных организмов или в состав которых входит хоть один компонент, полученный из продуктов содержащих ГМО так же могут считаться генетически модифицированными, в зависимости от законодательства страны. Генетически
модифицированные организмы получают некоторые новые свойства благодаря переносу в геном отдельных генов теоретически из любого организма (в случае трансгенеза) или из генома родственных видов (цисгенез).
Генетическая модификация может давать растению и пищевому продукту, который производится из неё, целый ряд признаков. Большинство культивируемых генномодифицированных организмов обладают устойчивостью к возбудителям болезней (к вирусам и грибам), несекомым-вредителям или к гербицидам. Это значительно облегчает культивирование, а также снижает затраты на обработку ядохимикатами.
Установить 100%-ю безопасность пищевых продуктов научно невозможно. Одним из возможных рисков употребления генетически модифицированной еды рассматривается её потенциальная аллергенность. Когда в геном растения встраивают новый ген, конечным результатом является синтез в растении нового белка, который может быть новым в диете. В связи с этим невозможно определить аллергенность продукта Например, в 1995 году компания разрабатывала кормовую сою с повышенным содержанием аминокислоты метионина. Для этого использовали ген бразильского ореха, который, как со временем выяснилось, демонстрировал аллергические качества. Разработка продукта остановлена, поскольку есть риск, что кормовая соя может случайно или в результате недобросовестных действий поставщика попасть на стол к потребителю.
Отдельные продукты генов, которые переносятся в организм генно-инженерными методами, могут демонстрировать токсичные особенности. В 1999 году опубликована, касающаяся токсичности генно-модифицированного картофеля для крыс. В картофель был встроен ген лектина из с целью повысить стойкость картофеля к нематодам. Скармливание картофеля крысам продемонстрировало токсический эффект генномодифицированного сорта. Разработка трансгенного картофеля с геном лектина прекращена.
Развитие технологии генной модификации и употребления генетическимодифицированной еды стимулировали ряд экспериментов по изучению судьбы употреблённой с продуктами ДНК в пищеварительной системе. Среднестатистический человек вместе с продуктами потребляет 0,1 — 1 г ДНК, независимо от диеты. В процессе пищеварения 95 % ДНК деградирует до отдельных нуклеотидов, 5 % в виде кусков длиной от 100 до 400 нуклеотидов доходят до кишечника. Поскольку в процессе изготовления генно-модифицированных организмов широко используют конститутивные промоторы, которые способны включать гены также в животных клетках, то остается риск, что куски ДНК, которые кодируют промоторы, встроятся в геном человека и активируют спящие гены.
Опыты на мышах демонстрируют, что непереваренная ДНК любой еды способна проникать в кровь, поступать в печень и даже проникать через плацентарный барьер. Но ни одного случая встраивания кусков инородной ДНК в геном потомства не наблюдалось.
42. Использование новых технологий в создании генетически рекомбинантных организмов (генотерапия, клеточная терапия).
Рекомбинация — процесс обмена генетическим материалом путем разрыва и соединения разных молекул нуклеиновых кислот, т. е. перераспределение генетического материала, приводящее к созданию новых комбинаций генов. В естественных условиях рекомбинация у эукариот — обмен участками хромосом в процессе клеточного деления. У прокариот рекомбинация осуществляется при передаче ДНК путем конъюгации, трансформации или трансдукции, либо в процессе обмена участками вирусных геномов. Методы генной инженерии значительно расширили возможности рекомбинационных обменов и позволяют, в отличие от естественной рекомбинации, получать гибридные
молекулы нуклеиновых кислот, содержащие практически любые чужеродные фрагменты. Техника генной инженерии включает несколько последовательных процедур:
1.Выделение нужного (целевого) гена;
2.Встраивание его в генетический элемент, способный к репликации (вектор);
3.Введение вектора в организм-реципиент;
4.Идентификация (скрининг) и отбор клеток, которые приобрели желаемый ген или гены. Рекомбинантные структуры используются в медицине в методах генной терапии.
Генотерапия — совокупность генноинженерных (биотехнологических) и медицинских методов, направленных на внесение изменений в генетический аппарат соматических клеток человека в целях лечения заболеваний. Это новая и бурно развивающаяся область, ориентированная на исправление дефектов, вызванных мутациями (изменениями) в структуре ДНК, или придания клеткам новых функцийГенная терапия. Технология до сих пор считается экспериментальной. 1. Интеграция(встраивание) нового гена в ДНК пациента т.о чтобы клетки его организма в дальшнейшем стали воспроизводить этот ген. 2. В схеме генной коррекции адресн. доставка гена проиходит с помощью вируса, лишенного патологического потенциала. Тем не менее сохран. Опасность появляется нов. Вирусн. Инфекций. 3. Чаще встречается заболевания, имеющие полиген. Характер, являющиеся рез-том взаимодействие различных генов(ген.сеть)
Клеточная трансплантология, также известная как клеточная терапия — комплекс терапевтических подходов, основанных на трансплантации клеток в больной организм с целью его лечения. Одно из широко известных и бурно развивающихся направлений клеточной трансплантологии — терапия стволовыми клетками. Клеточная трансплантация включает последовательные этапы: выделение клеток из ткани, манипуляции вне организма в искусственной среде (очистка, фракционирование, культивирование, генмодификация и другие) и их введение в организм реципиента (при аллогенной и ксеногенной клеточной трансплантации) или самого донора (при аутогенной). Несмотря на то, что трансплантация клеток имеет более чем столетнюю историю, её современный научно-клинический этап насчитывает только несколько десятилетий. Она может успешно применяться в регенеративной медицине (восстановление поврежденных тканей и органов), в лечении наследственных заболеваний и рака, при терапии трудноизлечимых сердечно-сосудистых, нейро-дегенеративных и аутоиммунных заболеваний. Внедрение в клиническую практику методов клеточной трансплантации позволило излечить некоторые формы лейкемии, увеличить продолжительность жизни сотням нуждающихся в пересадке органов людей, существенно повысить качество жизни пациентов, страдающих сахарным диабетом, рассеянным склерозом и многими другими заболеваниями.
43. Генная диагностика и генная терапия. Схема генной коррекции.
Генетическая диагностика – это считывание информации по формуле ДНК, т.е. расшифровка генетически наследуемой и передаваемой информации с хромосом, генов, геномов и иных молекулярных носителей, а также поиск и обнаружение деформированных, «дефектных» участков генетического кода человека. ДНК-идентификация проводится для определения риска развития различных болезней в процессе жизни, т.е. это исследование выявляет, какие опасные заболевания подстерегают вас в жизни, и позволяет получить генетический прогноз на будущее. ДНК-идентификация - это досимптоматическая диагностика, когда у человека еще нет никаких признаков болезни, определяемых общепринятыми методами исследования. Эта методика позволяет обнаружить у человека так называемые «гены предрасположенности».
Генотерапия — совокупность генноинженерных (биотехнологических) и медицинских методов, направленных на внесение изменений в генетический аппарат соматических
клеток человека в целях лечения заболеваний. Это новая и бурно развивающаяся область, ориентированная на исправление дефектов, вызванных мутациями (изменениями) в структуре ДНК, или придания клеткам новых функций.
Генная терапия. Технология до сих пор считается экспериментальной. 1. Интеграция(встраивание) нового гена в ДНК пациента т.о чтобы клетки его организма в дальшнейшем стали воспроизводить этот ген. 2. В схеме генной коррекции адресн. доставка гена проиходит с помощью вируса, лишенного патологического потенциала. Тем не менее сохран. Опасность появляется нов. Вирусн. Инфекций. 3. Чаще встречается заболевания, имеющие полиген. Характер, являющиеся рез-том взаимодействие различных генов(ген.сеть)
Схема генной коррекции
1.Создание генетической конструкции. Векторная система: вирус, лишенный патогенного потенциала.
2.Проблемы вектора-способ адресной доставки гена в клетку.
Методы введение генетической конструкции:-физический(микроиньекция),- химическая(соли некоторых элементов, например Ca),-биологическая(вирусные векторы)
3.Оценка эффективности на биологических моделях
4.Клинические испытания
44.Генетическое тестирование и его использование для выявления предрасположенности к заболеваниям, склонности к разным видам деятельности и т.п.
Расшифровка генома человека-появилась возможность изучать генетический профиль человека.
-позволяется определить, каким заболеванием подвержен человек -каких продуктов следует избегать -какие вижы профессианальной деятельности нежелательны -подобрать индивидуальное лечение
Генетической профилирование вызывает ряд вопросов этического характера. Человек с плохим генетическим профилем может счесть себя неугодным и обреченным, отказаться от карьеры, от вступления в брак. Возможна повышенная волна дискриминациистрахоовые компании и работодатели захотят получить доступ к информации о генетическом профиле человека.
45. Периоды онтогенеза человека. Пренатальное и постнатальное развитие.
Пренатальное развитие. Внутриутробное развитие человека. На 100 девочек-106 мальчиков. 98%-1 ребенок, 1,5%-близнецы, на 7500-тройня.
0 часов. Яйцеклетка в 100 раз больше сперматозоида, навстречу несколько миллионов.
24 часаАкросомальная реакция.
30 часов-2 бластомера
40часов-4 бластомера
65 часов-8 бластомеров
80 часов - мерула-16 клеток. Завершение дробления в маточной трубе.
5 сутки бластула попадает в полость матки
6 сутки - начало формирования плаценты
2-3 недели - 3 зародешивых листка, длина зародыша 2мм.
5 неделя - длина зародыша 10мм
6 неделя - длина зародыша 13-15 мм
8 неделя - длина 40мм; заканчивается закладка всех органов и систем.
С 9 недели - плод
Постнатальное развитие-развитие человека после рождения. Выделяют также несколько стадий:
1. Новорожденный (1-10 дней); для данного периода характерно вскармливание ребенка молозивом
2.Грудной возраст (10 дней - 1 год); вскармливание ребенка молоком; интенсивный рост тела (вес увеличивается в три раза, рост - в 1,5); в 0,5 года прорезываются молочные зубы
3.Раннее детство (1 - 3 года); прорезывание молочных зубов завершается к двум годам
4.Первое детство (4 - 7 лет); в 6 лет начинают прорезываться первые постоянные зубы
5.Второе детство (отрочество, 8-12 лет; у девочек 8 - 11 лет); активизируются процессы роста
(главным образом, в длину), появляются вторичные половые признаки
6.Подростковый возраст (13 - 16 лет; у девочек 12 - 15 лет); активное половое созревание, формирование вторичных половых признаков; у мальчиков появляются поллюции и ломается голос, у девочек - начинаются менструации и развиваются молочные железы; у обоих полов отмечается скачкообразное увеличение роста (пубертатный скачок)
7.Юношеский возраст (17 - 21 год; у девушек 16 - 20 лет); окончание процессов роста и формирования организма
8.Зрелый возраст (22 - 60 лет; у женщин - 21 - 55 лет); существенных изменений формы и строения тела не происходит
9.Пожилой возраст (61 - 74 года; у женщин - 56 - 74 года); уменьшение веса и роста вследствие дстрофических и атрофических изменений тканей и органов и снижения в них воды
10.Старческий возраст (75 - 90 лет); изменения роста, веса и строения тела
11.Долгожители (свыше 90 лет)
46. Периоды онтогенеза человека (пренатальное развитие). Понятие о критических периодах.
Пренатальное развитие. Внутриутробное развитие человека. На 100 девочек-106 мальчиков. 98%-1 ребенок, 1,5%-близнецы, на 7500-тройня.
0 часов. Яйцеклетка в 100 раз больше сперматозоида, навстречу несколько миллионов.
24 часаАкросомальная реакция.
30 часов - 2 бластомера
40часов - 4 бластомера
65 часов - 8 бластомеров
80 часов - мерула-16 клеток. Завершение дробления в маточной трубе.
5 сутки бластула попадает в полость матки
6 сутки - начало формирования плаценты
2-3 недели - 3 зародешивых листка, длина зародыша 2мм.
5 неделя - длина зародыша 10мм
