
- •Введение
- •1. Классификация и номенклатура
- •2. Определение активности ферментов
- •2.1. Единицы ферментативной активности
- •3. Общие свойства ферментов
- •3.1. Специфичность действия ферментов
- •3.2. Влияние температуры и рН на активность ферментов
- •3.3. Активирование и ингибирование ферментов
- •4. Гидролазы
- •4.1. Глюкозидазы
- •4.1.4. Определение активности амилолитических ферментов
- •4.1.5. Определение активности амилазы (сывороточная амилаза крови)
- •4.2. Протеазы
- •4.2.1. Гидролитическое расщепление казеина под действием пепсина.
- •4.2.2. Определение активности протеаз по методу Ансона
- •4.2.3. Определение активности протеолитических ферментов
- •4.2.4. Определение протеолитической способности (ПС)
- •4.2.5. Определение протеолитической активности молокосвертывающих препаратов
- •4.3. Эстеразы
- •4.3.1. Гидролитическое расщепление жира под действием липазы
- •4.3.2. Определение активности липазы
- •Список использованных источников
26
Оборудование. Штатив с центрифужными пробирками; пипетки; микропипетки (0,1 мл); термостат (37 °С); центрифуга; мерные колбы (50 мл); фотоэлектроколориметр.
4.2.Протеазы
Протеазы или протеолитические ферменты – это группа ферментов, относяща-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
R1 |
|
|
|
|
|
|
O |
|
||
H2N |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
C |
CH |
|
|
NH |
CH |
|
C |
+ (n+1) H2O |
|||||
|
|
|
|
HN |
C |
|
|
|
OH |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
O |
n |
R2 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
O |
|
|
|
O |
|
|
O |
||||
H2N |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||
C |
+ |
H2N |
C |
+ H2N |
|
|
|
||||||
CH |
|
|
OH |
C |
|||||||||
|
|
|
|
|
|
CH |
OH |
CH |
|
|
OH |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R1 |
|
R2 |
|
|
|
||
яся к классу гидролаз и подклассу пептид–гидролаз.
Пептид–гидролазы – ускоряют гидролиз пептидных связей в белках и пепти-
дах.
В зависимости от характера действия протеазы делятся на протеиназы и пепти-
дазы.
Протеиназы катализируют гидролиз небольшого числа внутренних пептидных связей в белковой молекуле (эндопептидазы), с образованием пептидов.
Пептидазы катализируют гидролиз пептидных связей в пептидах с образованием свободных аминокислот (экзопептидазы). Пептидазы могут отщеплять от пептида
аминокислоту, имеющую свободную аминогруппу (¾NН2) – это аминопептидазы, либо аминокислоту, имеющую свободную карбоксильную группу (¾СООН) –кар- боксипептидазы.
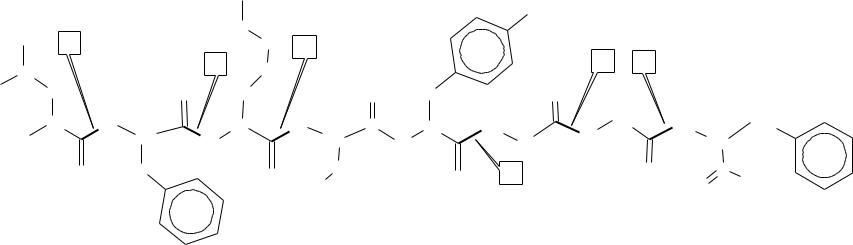
Очень важной особенностью протеаз является выборочный (селективный) характер их действия на пептидные связи в белковой молекуле. Так, пепсин избирательно ускоряет гидролиз пептидных связей, образованных аминокислотами Фен и Лей; трипсин – Арг и Лиз; химотрипсин – ароматическими аминокислотами Фен, Трп, Тир; папаин – Арг, Лиз, Фен и т. д. (см. рисунок5)
Причина избирательного действия пептид–гидролаз заключается в том, что радикал аминокислоты, по соседству с которым гидролизуется пептидная связь, служит для образования фермент–субстратного комплекса.
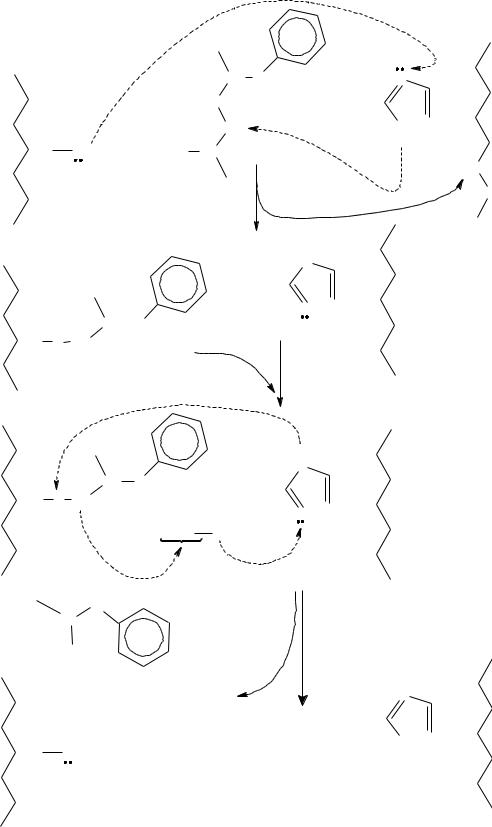
Механизм действия пептидгидролаз рассмотрен на примере действия химотрипсина (см. рисунок 6).
27
Фрагменты единой полипептидной цепи молекулы фермента условно показаны слева и справа изогнутой линией, в их составе отмечены остатки сер и гис с их функциональными группами. В активном центре фермента точно против остатков сер и гис размещается пептидная связь гидролизуемого белка, образованная остатком фен (или
|
|
|
|
|
|
NH2 |
|
CH3 |
1 |
|
|
|
H2C |
|
|
|
|
CH |
||
|
CH |
|
|
|
2 |
CH |
H3C |
|
|
|
|
||
C |
|
|
O |
|
CH2 |
|
|
C |
|
HN |
|
|
HC |
|
H2N |
|
CH |
|
HN |
Лиз |
|
Лей |
|
H2C |
|
|
|
|
O |
|
|
Арг O |
||
|
|
|
Фен |
|
|
|
|
|
|
Лей |
|
|
|
|
|
|
Тир |
|
|
|
OH
3 |
|
5 |
5 |
Фен и другие |
|
|
|||
O |
H2C |
O |
|
нейтральные |
|
аминокислоты |
|
C |
CH |
NH |
|
CH |
NH |
CH2 |
HC |
NH |
|
|||||
NH |
|
CH2 |
|
|
HC |
HO |
CH2 |
Тир |
O |
4 Гли |
Гли O |
C |
OH |
Сер |
Фен |
|
|
|
O |
|
|
|
|
|
|
|
|
|
1 – лейцинаминопептидаза
2 – пепсин
3 – трипсин
4 – химотрипсин
5 – карбоксипептидаза А
Рисунок 5 – Точки приложения действия протеолитических ферментов на пептидные связи в белковой молекуле
|
В цепь |
|
CH CH2 |
|
СО |
195 |
NH |
I Сер ОН |
R HC |
В цепь
В цепь
195 |
|
|
|
|
|
CH CH2 |
|||
II Сер O |
|
|||
СО |
|
|
H2O |
|
|
|
|
|
|
В цепь
195 |
CH CH2 |
|
III Сер O СО |
||
|
||
|
+ НО Н |
В цепь
CH2
HC COOH
195
IV Сер ОН
N
57 N
 Гис
Гис
H
HN
CHR
В цепь
H
N
57 N
 Гис
Гис
H N
57 N
 Гис
Гис
N
57 N Гис
Гис
H
