
- •5 Биохимия
- •1.Отличительные признаки живой материи.
- •2.Биомолекулы (простые и сложные); биополимеры. Структурная организация клетки
- •3.Классификация природных а-аминокислот:
- •4.Основные биологические функции а-аминокислот и белков в живых организмах.
- •5.Биохимические превращения протеиногенных а-аминокислот (аланина, лизина): дезаминирование и декарбоксилирование.
- •6.Биохимические превращения протеиногенных а-аминокислот: а) трансаминирование; б) дезаминирование.
- •7. Понятие об изоэлектрической точке а-аминокислот и белков.
- •8. Первичная структура белков: определение, пептидная группа, тип химической связи.
- •9. Вторичная структура белков: определение, основные виды
- •10.Третичная и четвертичная структуры белков: определение, типы связей участвующие в их образовании.
- •11.Строение полипептидной цепи пептидов белков. Привести примеры.
- •12.Структурная формула трипептида аланилсерилтирозин.
- •13.Структурная формула трипептида цистеилглицинфенилаланина.
- •14.Классификация белков по: а) химическому строению; б) пространственной структуре.
- •15.Физико-химические свойства белков: а) амфотерность; б) растворимость; в) электрохимические; г) денатурация; д) реакция осаждения.
- •16.Углеводы: общая характеристика, биологическая роль, классификация. Доказательство строения моносахаридов на примере глюкозы и фруктозы.
- •Классификация углеводов
- •17. Реакции окисления и восстановления моносахаридов на примере глюкозы и фруктозы.
- •18. Гликозиды: общая характеристика, образование.
- •Классификация гликозидов
- •19. Брожение моно- и дисахаридов (спиртовое, молочнокислое, маслянокислое, пропионовокислое).
- •20.Восстанавливающие дисахариды (мальтоза, лактоза): строение, биохимические превращения (окисление, восстановление).
- •21. Невосстанавливающие дисахариды (сахароза): строение, инверсия, применение.
- •22.Полисахариды (крахмал, целлюлоза, гликоген): строение, отличительные биологические функции.
- •23.Нуклеиновые кислоты (днк,рнк):биологическая роль,общая характеристика,гидролиз.
- •24.Структурные компоненты нк: главные пуриновые и пиримидиновые основания, углеводная составляющая.
- •Азотистое основание Углеводный компонент Фосфорная кислота
- •Пуриновые Пиримидиновые Рибоза Дезоксирибоза
- •26.Строение полинуклеотидпой цепи (первичная структура), например, построить фрагмент Ade-Thy-Guo; Cyt-Guo-Thy.
- •27.Вторичная структура днк. Правила Чартгоффа Вторичная структура днк характеризуется правилом э. Чаргаффа (закономерность количественного содержания азотистых оснований):
- •28.Основные функции т рнк, м рнк, р рнк. Структура и функции рнк.
- •Этапы репликации:
- •Транскрипция
- •Этапы транскрипции:
- •29.Липиды (омыляемые, неомыляемые): общая характеристика, классификация.
- •Классификация липидов.
- •30.Структурные компоненты омыляемых липидов (вжк, Спирты).
- •31.Нейтральные жиры, масла: общая характеристика, окисление, гидрогенизация.
- •32.Фосфолипиды: общая характеристика, представители (фосфатидилэтаноламины, фосфатидилхолины, фосфатидилсерины, фосфатидилглицерины).
- •33.Ферменты: определение, химическая природа и строение.
- •34.Общие свойства химических ферментов и биокатализаторов.
- •35.Факторы, влияющие на каталитическую активность ферментов:
- •36.Механизм действия ферментов.
- •37.Номенклатура, классификация ферментов.
- •38.Общая характеристика отдельных классов ферментов: а)оксидоредуктазы; б) трансферазы; в) гидролазы.
- •39.Общая характеристика классов ферментов: а) лиазы; б) изомеразы; в)л и газы.
- •40.Общая характеристика витаминов, классификация витаминов; представители водорастворимых и жирорастворимых витаминов. Их биологическая роль.
- •1)По растворимости:
- •2)По физиологической активности:
- •41.Понятие о метаболических процессах: катаболические и анаболические реакции.
- •42.Особенности метаболических процессов.
- •43.Основные источники энергии для живой материи (фотосинтез, энергия, образующаяся при окислении органических соединений).
7. Понятие об изоэлектрической точке а-аминокислот и белков.
Изоэлектрическая точка-это состояние,когда рН среды,при которой суммарный заряд аминокислоты или белка = 0 (молекула электронейтральна).При значении рН, равном изоэлектрической точке, белок максимально инертен, неперемещается в электрическом поле и имеет наиболее тонкую гидратную оболочку.
8. Первичная структура белков: определение, пептидная группа, тип химической связи.
Последовательность α-аминокислотных остатков в полипептидной цепи (порядок чередования) определяет первичную структуру белковой молекулы. С электрической точки зрения пептидная группа представляет собой трехцентровую р., π- сопряженную систему со смещением электрической плотности в сторону атома кислорода.
Неприсоединенный протон при рН=1-14 имеет жесткую структуру, не допуская вращения связей С-N и все 3 атома лежат в одной плоскости
Стабильность первичной структуры поодерживается прочными ковалентными связями и бисульфидными мостиками.
9. Вторичная структура белков: определение, основные виды
Конфигурации (α-спираль, (β-изгиб),.
Вторичнвя структура способ укладки полипептидной цепи в трехмерном пространстве с учетом дисульфидной связи, но без учета взаимодействия боковых радикалов
а-Спираль (a-helix). Эта конформация представляет собой спираль, образованную единственной цепью и имеющую направление вращения по ходу часовой стрелки.
а-Спираль имеет шаг 0,54 нм и диаметр 1,05 нм. На каждый виток а-спирали приходится в среднем 36 аминокислотных остатков. Один аминокислотный остаток занимает 0,15 нм длины спирали.
Между атомами водорода в пептидной группировке и карбонильным кислородом третьей по счету от нее аминокислоты возникают внутримолекулярные водородные связи. Эти связи появляются после формирования спирали и закрепляют ее.
Складчатая ß--структура формируется плоскостями, закрепленными водородными связями между параллельными цепями аминокислот.
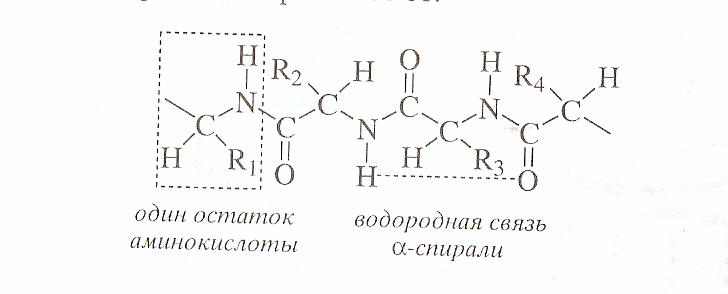
Образование спирали возможно за счет водородной связи между кислородом оксогруппы и водородом амоногруппы.Стабильность вторичной структуры поддерживается за счет водородных связей.
Пептидная группа лежит в одной плоскости, R уходит за плоскость.Все атомы пептидной группы лежат в одной плоскости. Боковые радикалы R1,R2 располагаются на внешней поверхности белковой молекулы.
Стабильность вторичной структуры поддерживается водородными связями
10.Третичная и четвертичная структуры белков: определение, типы связей участвующие в их образовании.
Третичная структура белка –способ укладки полипептидной цепи в пространстве с учетом взаимодействия боковых радикалов.
Стабильность третичной структуры поддерживается за счет сил слабого взаимодействия (водородные, ионное взаимодействие или электростатическое; гидрофобные и частично ковалентные дисульфидные связи,
Именно такую форму имеют белки, выполняющие роль биологических катализаторов и регуляторов, а также белки, имеющие транспортные функции.
Полярные гидрофильные группы в глобуле расположены на ее внешней поверхности, а неполярные гидрофобные группы обращены внутрь глобулы. Благодаря этому наружная поверхность белка гидратируется, что повышает растворимость белка и обусловливает возможность его участия в биохимических реакциях, которые в физиологических условиях протекают в водной среде.
Располагаясь рядом, спирали образуют нитевидные структуры, называемые фибриллами. Фибриллярные белки являются основным строительным материалом волос, кожи и мышечных тканей.
Третичная структура белка стабилизируется главным образом связями между боковыми группами аминокислотных остатков: дисульфидпые и водородные связи, диполярные взаимодействия, силы ван-дер-ваальсова притяжения, электростатические эффекты.
Четвертичная структура белка (характерна для сложных белков) формируется из двух или более полипептидиых цепей, каждая из которых имеет свою первичную, вторичную и третичную структуры и называется субъединицей. Субъединицы могут быть либо одинаковыми по составу и строению, либо различными. Несколько таких субъединиц могут объединяться с образованием в результате совместной упаковки четвертичной структуры.
Четвертичная структура белка не менее важна, поскольку некоторые белки выполняют свои биологические функции, находясь не в виде одинарной полипептидной цепи, а в виде конгломерата двух или более цепей. Полипептидные цепи связаны силами слабых взаимодействий. Пример белка-гемоглобин.
