
Вьюник. Лекция № 9
.pdf
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Ковалентний зв‘язок
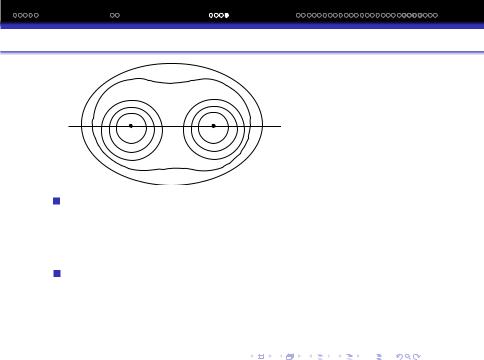
Спочатку переважають сили притягання, а в подальшому сили вiдштовхування.
На кривiй залежностi спочатку спостерiгається монотонне зниження енергiї EN, при досягненi ж мiнiмуму - рiзке її збiльшення.
Мiнiмум на кривiй залежностi EN вiд r вiдповiдає найбiльш стабiльному стану системи iз 2-х H рiвноважнiй вiдстанi r0, тобто утворенню молекули H2.
Утворення молекули H2 iз атомiв можна пояснити перекриванням атомних електронних хмаринок з утворенням молекулярної хмаринки, яка утворюється навколо 2-х позитивно заряджених ядер.
11/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Ковалентний зв‘язок
ψ2=MAX
HH
Умiсцi перекривання електронних хмаринок (в просторi мiж ядрами) електронна густина максимальна. Мiж ядрами ψ2 бiльше, чим в других мiсцях молекулярного простору.
Внаслiдок цього сили притягання мiж ядрами i електро-
нами рiзних атомiв збiльшуються, вiдстань r мiж атомами
◦
зменшується: r1 + r2 = 1.06(0.74)A.
Вiдповiдно до квантовомеханiчних уявлень утворення зв‘язку можливе лише при умовi 

12/43

Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Теорiя валентних зв‘язкiв (ТВЗ) (локалiзованих електронних пар) це 1-ша квантово-механiчна теорiя.
Вона була створена у 30-тi роки 20 столiття Л. Полiнгом, двiчi лауреатом Нобелiвської премiї). Л.Полiнгу належить велика заслуга i в її розвитковi (теорiя Полiнга).
Вона заснована на припущенi, що хiмiчний зв‘язок завжди двохелектронний, двоцентровий.
Звичайно атоми утворюють зв‘язки за рахунок e¯ рiзних пiдрiвнiв: Be (2s12p1), B (2s12p2), C (2s12p3) тощо.
Тому можна уявити, що у випадку зв‘язку цих елементiв з однаковими атомами, їх мiцнiсть буде рiзною.
13/43

Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Гiбридизацiя орбiталей
Наприклад, зв‘язок утворений s− електроном атома Be i атомом Cl та зв‘язок утворений p− електроном атома Be в збудженому станi i атомом Cl.
Однак, експерименти (довжина зв‘язку, енергiя зв‘язку) показують, що незважаючи на рiзницю форм електронних хмаринок, зв‘язки утворенi за їх участю рiвноцiнi i розмiщенi симетрично.
Для пояснення цього протирiччя ТВЗ вводить поняття про гiбридизацiю зв‘язкiв.
14/43

Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Гiбридизацiя орбiталей
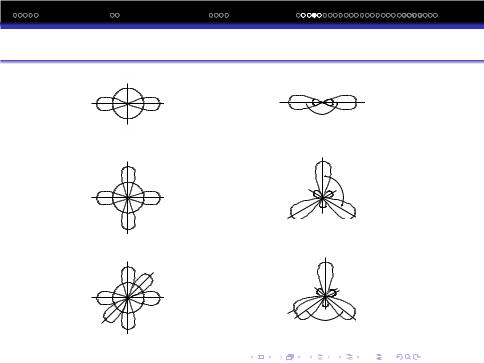
Вiдповiдно до iдеї про гiбридизацiю зв‘язкiв початкова форма та енергiя орбiталей (електронних хмаринок) потерпають певнi змiни, в результатi чого утворюються орбiталi нової, але уже однакової форми i енергiї.
Гiбридизованi орбiталi вiдрiзняються тiльки просторовою напрямленiстю. На рисунку показаний вигляд гiбридизованих орбiталей, що утворюються iз s− i p− орбiталей.
15/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Гiбридизацiя
=
180º
(s + p) |
|
2-i sp |
|
|
= |
(s + p + |
орбiталi |
3-и sp2 |
120
º
|
= |
|
109º28' |
(s + p + p + p)− орбiталi |
4-и sp3− орбiталi |
16/43

Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Гiбридизацiя орбiталей
Гiбридизована орбiталь має бiльшу витягнутiсть по один бiк вiд ядра, чим по другий. Отже, хiмiчний зв‘язок повинен бути мiцнiшим.
Гiбридизацiя зв‘язана з енергетичним виграшем за рахунок утворення бiльш мiцних зв‘язкiв i бiльш симетричного розподiлу електронної густини в молекулi.
Число гiбридизованих орбiталей дорiвнює числу початкових атомних орбiталей. Гiбридизацiя змiцнює ковалентний зв‘язок.
Розглянемо в межах ТВЗ характернi особливостi ковалентного зв‘язку: насиченiсть, направленiсть, поляризованiсть.
17/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Валентнiсть
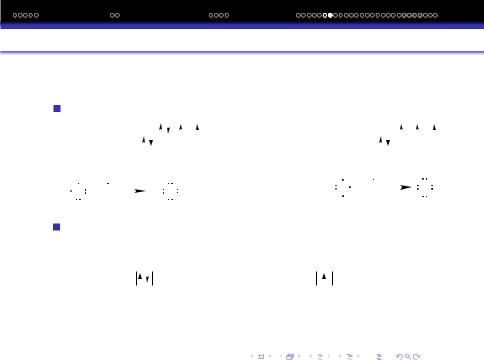
Одна iз важливих властивостей ковалентного зв‘язку – насиченiсть. Внаслiдок насиченостi зв‘язку молекули мають певний склад.
ТВЗ пояснює валентнiсть хiмiчних елементiв. Пiд валентнiстю елемента розумiють його здатнiсть до утворення хiмiчного зв‘язку.
Вмежах (рамках) ТВЗ числене значення валентностi вiдповiдає числу ковалентних зв‘язкiв, якi утворює даний атом.
Вутворенi ковалентного зв‘язку приймають участь усi одноелектроннi хмаринки, оскiльки знаходження 2-х електронiв з протилежними спiнами у полi 2-х ядер енергетично є бiльш вигiдним, чим знаходження кожного e¯ в полi свого власного ядра.
18/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Наприклад: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
O: 2s22p4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N: 2s22p3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
2p |
|
|
|
|
|
|
|
|
|
|
|
2p |
||||||||
|
|
|
|
2s |
|
|
|
|
2s |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N H |
|||||||||
O + 2H |
|
|
|
|
|
H O |
|
|
N + 3H |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
H
У рядi випадкiв число неспарених e¯ збiльшується в результатi збудження атома:
C(2s22p2) 




 = > C (2s12p3)
= > C (2s12p3) 






|
|
|
|
2p |
|
|
|
2p |
|
|
|||||||
|
2s |
2s |
||||||
19/43

Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Донорно-акцепторний механiзм
F
 C
C + 4
+ 4  F
F
 F C F
F C F
F
Промотування e¯. Енергiя промотування компенсується при утворенi хiмiчних зв‘язкiв.
Донорно-акцепторний механiзм утворення ковалентного зв‘язку.
Окрiм викладеного механiзму утворення ковалентного зв‘язку вiдомий дещо своєрiдний механiзм. Його називають донорноакцепторним.
Спiльна електронна пара може утворитися не тiльки за рахунок спарювання електронiв, що належали орбiталям окремих атомiв, а й внаслiдок взаємодiї неподiленої електронної пари одного атома та вiльної орбiталi iншого.
20/43
