
Вьюник. Лекция № 9
.pdf
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Донорно-акцепторний механiзм
Утворення молекули H2 за:
1 обмiнним механiзмом H·+ · H −−→ H : H
2 донорно-акцепторним механiзмом H+ +: H− −−→ H : H
акцептор донор
: NH3 + H+ −−→ NH+4
Донорно-акцепторний механiзм лежить в основi утворення бiльшостi координацiйних сполук. Його називають ще координацiйним (семиполярним).
21/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Насиченiсть зв‘язку
Максимальна валентнiсть елементiв i насиченiсть зв‘язку. Здатнiсть атома утворювати ковалентнi зв‘язки зумовлюється не лише числом одноелектроннних хмаринок, а й числом вiльних орбiталей (або числом двохелектронних атомних хмаринок).
Таким чином, валентнiсть елемента, в загальному випадку, характеризується загальним числом валентних орбiталей, якi приймають участь в утворенi ковалентного зв‘язку. Валентнi можливостi елементiв 2-го перiоду представленi в таблицi:
22/43

Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Насиченiсть зв‘язку
B |
C |
|
N |
2s22p1 |
2s22p2 |
2s22p3 |
|
BH3 |
CH4 |
: NH3 |
|
BH – |
CH |
4 |
NH+ |
4 |
|
4 |
|
акцептор |
|
|
донор : |
|
|
|
|
У елементiв 2-го перiоду максимальне число ковалентних зв‘язкiв дорiвнює числу зовнiшнiх валентних електроних орбiталей – 4, 3-го перiоду – 9 i т.п.
Фiзична суть насиченостi ковалентного зв‘язку полягає в тiм, що при числi зв‘язкiв вище максимального взаємне вiдштовхування e¯ рiзних зв‘язкiв приводить до руйнування останнiх.
23/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Направленiсть ковалентного зв‘язку
Направленiсть ковалентного зв‘язку. Як вiдомо електроннi
хмаринки (s,pX,pY,pZ,dX2−Y2,dXY ,dXZ ,dYZ ,dZ2) мають рiзну форму i певну орiєнтацiю в просторi.
Тому в залежностi вiд типу взаємодiючих електронiв ковалентний зв‘язок буде мати певну направленiсть в просторi.
В залежностi вiд способу перекривання i симетрiї утвореної хмаринки розрiзняють σ−,π−,δ−зв‘язки.
σ-зв‘язок виникає мiж 2-ма атомами при перекриванi електронних хмаринок уздовж лiнiї, що з‘єднує центри атомiв i спiвпадає з осьовою лiнiєю симетрiї, ординарний зв‘язок.
Проте мiж атомами можуть виникати i кратнi зв‘язки: подвiйнi (π) та потрiйнi (δ); Mo  Mo , де 1σ , 2π, 1δ.
Mo , де 1σ , 2π, 1δ.
24/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Направленiсть ковалентного зв‘язку
π−зв‘язок виникає при перекриванi електронних хмаринок по обидва боки вiд лiнiї сполучення атомiв. Зв‘язуюча електронна хмаринка має лише площину симетрiї, що проходить через ядра.
δ−зв‘язок утворюється при перекриванi усiх 4-х пелюсткiв d−орбiталей, розмiщених в паралельних площинах.
π−,δ− зв‘язки менш мiцнi, чим σ− зв‘язок. Зазвичай вони зустрiчаються в сполуках з кратним числом зв‘язкiв.
− |
4 – |
(1σ,2π,1δ). |
N−N(1σ,2π); Mo2Cl8 |
||
− |
|
|
25/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Направленiсть ковалентного зв‘язку
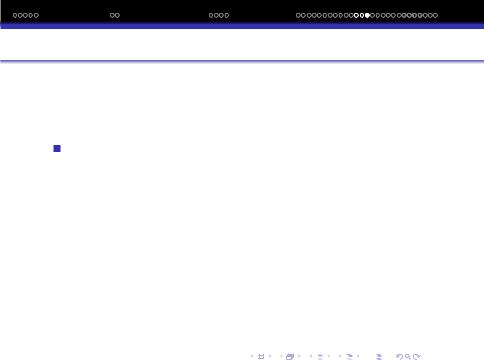
Пiдвищення кратностi зв‘язкiв приводить до змiцнення мiжатомного зв‘язку i до зменшення мiж‘ядерної вiдстанi:
|
|
|
◦ |
Кратнiсть зв‘язку |
Eзв,Кдж/моль |
Кратнiсть зв‘язку |
dзв,A |
F−F |
159 |
C−C |
1.543 |
|
|
|
|
− |
494 |
− |
1.353 |
O−O |
C−C |
||
− |
947 |
− |
1.205 |
− |
− |
||
N−N |
C−C |
26/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Просторова конфiгурацiя молекул
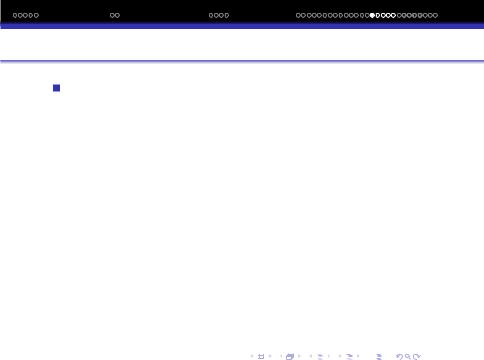
Просторова конфiгурацiя молекул. Характер гiбридизацiї валентних орбiталей i їх просторове розмiщення зумовлюють просторову конфiгурацiю молекул.
У таблицi наведено данi щодо типу молекулярних структур та їх зв‘язку з характером гiбридизацiї.
Гiбридизуємi |
Тип |
Кут |
мiж |
Геометрiя молеку- |
Приклади сполук |
||||
орбiталi |
гiбри- |
зв‘язками |
ли |
|
|
|
|
||
|
дизацiї |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1s + 1p |
sp− |
1800 |
|
лiнiйна BeCl2 |
BeCl2, CO2 |
||||
1s + 2p |
sp2 |
− |
1200 |
|
плоска трикутна |
BCl |
3 |
, SnCl |
|
|
|
|
|
|
|
|
|
2 |
|
1s + 3p |
sp3 |
− |
109028′ |
тетраедрична |
CCl , CH |
4 |
|||
|
|
|
|
|
|
|
4 |
|
|
1d+1s+3p |
dsp3− |
1200 |
i 900 |
тетрагональна бiпi- |
PCl |
5 |
, SbCl |
||
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
рамiдальна |
|
|
|
|
1s+3p+2d |
sp3d2− |
900 |
|
октаедрична |
SF , SiF 2 – |
||||
|
|
|
|
|
|
6 |
|
6 |
|
27/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Просторова конфiгурацiя молекул
Вплив незв‘язуючої електронної пари центрального атома на будову молекул (комплексiв).
До цього часу ми розглядали молекули, що мають правильнi геометричнi розмiри з валентними кутами 1800, 1200,
109028′, 900.
Проте експеримент показує, що на практицi значно частiше зустрiчаються молекули з трохи другими значеннями валентних кутiв.
Наприклад молекула амiаку має пiрамiдальну будову з атомом нiтрогену у вершинi пiрамiди i однаковими кутами мiж зв‘язками i рiвними HNH = 107.30. У водi HOH = 104.50.
Причиною цього є згiдно з ТВЗ неподiлена електронна пара у центрального атома.
28/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Просторова конфiгурацiя молекул
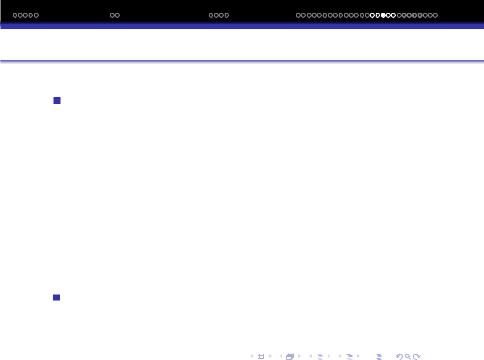
Центральний атом - це атом навколо якого координуються другi атоми або iони. Викривлення викликанi взаємним вiдштовхуванням зв‘язуючої та незв‘язуючої електронних пар. Вплив числа незв‘язуючих ЕП iлюструють данi слiдуючої таблицi:
Молекула |
CH4 |
NH3 |
H2O |
Число незв‘язуючих ЕП |
0 |
1 |
2 |
|
|
|
|
Величина кута |
109028′ |
107.30 |
104.50 |
Форма молекули |
тетраедр |
тригон. пiрамiда |
кутова |
|
|
|
|
Збiльшення числа незв‘язуючих ЕП ЦА змiнює просторову конфiгурацiю молекул.
29/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Просторова конфiгурацiя молекул
Нелокалiзований π-зв‘язок. До цього часу ми розглядали зв‘язок, що здiйснюється парою електронiв, яка обслуговує два атомнi центри. Такi зв‘язки називаються локалiзованими.
Проте у багатьох сполук проявляються нелокалiзованi хiмiчнi зв‘язки. Вони обумовленi бiльш нiж двома e¯i об‘єднують бiльше 2-х атомiв.
Iон CO32− має трикутну будову, атом карбону знаходиться в sp2−гiбридному станi з 3-ма σ− i 1-ним π−зв‘язками.
30/43
