
Вьюник. Лекция № 9
.pdf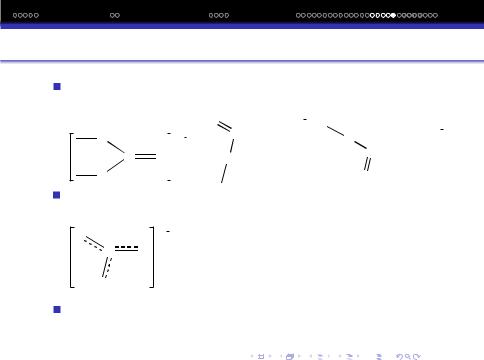
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Просторова конфiгурацiя молекул
Недолiком такого зображення структури є локалiзацiя i уявна нерiвозначнiсть
|
2 |
|
|
|
O |
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Можна припустити делокалiзацiю π−зв‘язку i вiд‘ємного заряду на всi атоми оксигену.
2
O
Порядок зв‘язку в iонi CO3 |
2− дорiвнює 1 |
1 |
◦ |
||
, dCO = 1.29A, |
|||||
3 |
|||||
◦ |
◦ |
|
|
||
|
|
|
|||
dC-O= 1.4A |
, dC= O = 1.22A. |
|
|
|
|
31/43

Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Умови стiйкої гiбридизацiї
Умови стiйкої гiбридизацiї: Необхiдною умовою утворення стiйкого гiбридного стану атома є близькiсть енергiй, достатня електронна густина гiбридизованих орбiталей, а також достатнiй ступiнь перекривання гiбридизованих орбiталей з орбiталями других атомiв при утворенi зв‘язку.
По перiодах енергетична рiзниця E2S − E2P вiд Li до Ne збiльшується; E3S−E3P вiд Na до Ar збiльшується; E4S−E4P вiд K до Kr збiльшується.
Збiльшення енергетичної рiзницi ENS −ENP орбiталей зменшує можливiсть sp3−гiбридного стану.
Цим пояснюється i зниження стабiльностi тетраедричних iонiв в ряду SiO44 – – PO43 – – SO42 – – ClO4– .
32/43

Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Умови стiйкої гiбридизацiї
Вплив електронної густини гiбридних орбiталей на стiйкiсть sp3 -гiбридного стану можна прослiдкувати на слiдуючому прикладi:
Сполука |
NH3 |
PH3 |
AsH3 |
SbH3 |
HEH |
107.3◦ |
94◦ |
92◦ |
91◦ |
sp3−гiбридизацiя стає все менш характерною. Про це свiдчить зменшення валентного кута в цьому рядi молекул. В SbH3 s−електрони участi в sp3− гiбридизацiї практично не приймають.
Аналогiчна ситуацiя i в ряду:
H2O (104.5◦) H2S(92◦) H2Se (91◦) H2Te(90◦).
33/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Теорiя ВЕПВО (теорiя Гiллеспi)
Теорiя ВЕПВО (теорiя Гiллеспi). Гiллеспi на основi принципу Паулi та моделi вiдштовхування електронних пар запропонував теорiю, яка пояснює i прогнозує форму молекул.
Просторова будова молекули визначається загальним числом ЕП (зв‘язуючих та незв‘язуючих). Вона носить назву теорiї вiдштовхування електронних пар валентної оболонки.
Сумарне число неподiлених електронних пар центрального атома i других атомiв зв‘язаних з центральним атомом називається стеричним числом (СЧ ).
••
Наприклад, X••EF4, атом Xe зв‘язаний з 4-ма атомами F i
має 2-i неподiленi електроннi пари, тобто стеричне число СЧ = 6.
34/43

Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Теорiя ВЕПВО (теорiя Гiллеспi)
Виходячи iз вимоги максимального вiддалення локалiзованих пар ЦА i симетричного їх розмiщення, обидвi неподiленi ЕП атома Xe просторово розмiстяться у напрямку до вершин октаедра.
Розглянемо деякi iз цих правил для неперехiдних елементiв, що характеризують роль неподiлених ЕП.
1ЕП приймають таке розмiщення, при якому вони максимально вiддаленi одна вiд одної, тобто ЕП ведуть себе начеб-
то вони взаємно вiдштовхуються.
2Неподiленi ЕП (Е) оказують бiльш сильнiшу вiдштовхуючу дiю на сусiднi в порiвняннi iз звязуючими ЕП (Х): E−E > X−E > X−X.
При розмiщенi на валентнiй оболонцi Е вони намагаються заняти такi положення, при яких їх взаємодiя мiнiмальна. В молекулах AX4E2 вони займуть транс-положення.
35/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Теорiя валентних зв‘язкiв
Теорiя ВЕПВО (теорiя Гiллеспi)
3Iз збiльшенням ЕН зв‘язаного атома вiдштовхування, зумовлене зв‘язуючою Х зменшується: NH3(107.3◦) > NF3(102◦);
H2O(104.5◦ > F2O(103.2◦).
4Кратнiсть зв‘язку практично не впливає на стереохiмiю молекул. Їх геометричнi форми визначаються в першу чергу
числом σ-зв‘язуючих (X) i числом неподiлених ЕП(E).
5Вiдштовхування мiж ЕП заповненого рiвня бiльше, нiж мiж e¯ незаповненого рiвня.
Фiзично це пов‘язано з тим, що ЕП заповненого рiвня займають ввесь доступний простiр бiля центрального атома. Викривлення таких структур утруднене.
36/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Полярнiсть зв‘язку
Полярнiсть та поляризованiсть зв‘язку. Зв‘язок мiж атомами рiзних елементiв завжди бiльш або менш полярний.
Полярнiсть обумовлена рiзницею розмiрiв та ЕН атомiв.
Наприклад, в HCl зв‘язуюча електронна хмаринка змiщена в бiк бiльш ЕН атома хлору. Внаслiдок цього заряд ядра на атомi гiдрогену уже не компенсується, а на атомi Cl електронна густина стає надлишковою в порiвняннi з зарядом ядра.
Атом H поляризований позитивно, а Cl негативно. Виникаючий на атомi H позитивний, а на атомi Cl негативний заряд називається ефективним (δ): δH = +0.18, δCL = −0.18, вiд абсолютного заряду e¯.
37/43

Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Полярнiсть зв‘язку
Можна стверджувати, що зв‘язок в HCl на 18% має iонний характер, тобто молекула полярна. В таблицi наведено значення ефективних зарядiв на атомi оксигену для оксидiв 3-го перiоду:
Оксид |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
δ0 |
-0.81 |
-0.42 |
-0.31 |
-0.23 |
-0.13 |
-0.06 |
-0.01 |
Зниження полярностi вiдповiдає зменшенню рiзницi в ЕН. За ступенем деформацiї (змiщення) поляризацiї зв‘язуючої електронної хмаринки зв‘язок може бути неполярним, полярним i iонним.
Неполярний i iонний зв‘язок крайнi випадки полярного зв‘язку.
38/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Полярнiсть зв‘язку
Поляризованiсть - здатнiсть зв‘язку ставати полярним або бiльш полярним в результатi дiї на молекулу зовнiшнього електричного поля.
Кожна молекула, кожний атом чинять поляризуючу дiю на сусiднi молекули.
В результатi поляризацiї може вiдбутися повний розрив зв‘язку з переходом зв‘язуючої електронної пари до одного iз атомiв з утворенням позитивно i негативно заряджених iонiв.
39/43
Теорiї хiмiчного зв‘язку Характеристики зв‘язку Ковалентний зв‘язок Теорiя валентних зв‘язкiв Полярнiсть зв‘язку
Полярнiсть зв‘язку
Ступiнь або стан окиснення
Процес дисоцiацiї i iонiзацiї. Необхiдно розрiзнювати гомота гетеролiтичний розрив зв‘язку:
H+ Cl −−− HCl −−− H+ + Cl –
−−−−−−
Ступiнь або стан окиснення - це кiлькiсна оцiнка стану атома в сполуцi.
Пiд ступенем окиснення розумiють електричний заряд атома в сполуцi, розрахований в припущенi, що сполука складається iз iонiв.
Позначають арабською цифрою з ” +” або ” −”. Наприклад: в HCl H+ , Cl – .
У випадку позитивного ступеню окиснення останiй позначається римськими цифрами в дужках, наприклад, FeCl3 – хлорид феруму (III), CuSO4 – купруму(II) сульфат , AgNO3– аргентуму (I) нiтрат.
40/43
