
Вьюник. Лекция № 8
.pdf
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Перiодичнiсть властивостей хiмiчних
елементiв
В‘юник I. М.
Хiмiчний факультет
Харкiвський нацiональний унiверситет iменi В.Н. Каразiна
Кафедра неорганiчної хiмiї
1/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Перiодична система – графiчне зображення Перiодичного закону
Оскiльки Перiодична система є графiком на площинi, вона повина вiдображувати закономiрностi змiни властивостей по вертикалi та горизонталi.
Перiодичнiсть накопичення e¯ бiля ядра обумовлює перiодичнiсть в змiнi властивостей елементiв.
Перiодично змiнюються: валентнiсть, rат, riон, окисно-вiдновнi властивостi, I1, спорiдненiсть до електрона, Tпл , Tкип, атомнi об‘єми i т.iнш.
2/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Атомний об‘єм
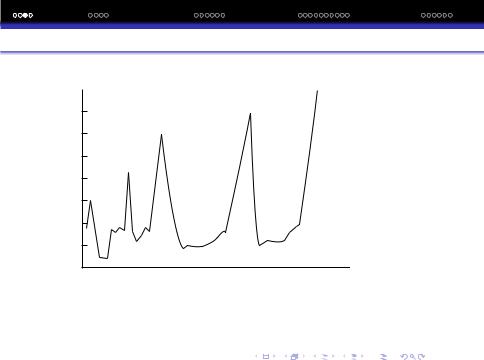
Атомний об‘єм. Вперше на перiодичну змiну атомного об‘єму в залежностi вiд маси вказав Майєр.
Оскiльки структура електронної оболонки змiнюється перiодично в Перiодичнiй системi, то i атомнi об‘єми змiнюються перiодично.
На кривiй залежностi атомного об‘єму вiд заряду ядра (Z) видно рiзко вираженi максимуми, що вiдповiдають лужним металам, дещо меншi атомнi об‘єми мають iнертнi гази i s-елементи 2-ої групи.
Найменшi атомнi об‘єми мають елементи середини перiодiв i перехiднi метали.
3/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Атомний об‘єм
Cs
Vат |
|
|
|
70 |
|
|
Rb |
|
|
|
|
60 |
|
|
K |
|
|
|
|
50 |
Na |
|
|
|
|
|
|
40 |
|
|
|
30 |
Li |
|
|
20 |
N F |
P |
Se |
10 |
O Ne |
|
S |
|
|
|
Z
Залежiсть атомного об‘єму вiд Z.
4/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Атомний об‘єм
Слiд замiтити, що при переходi вiд N до O i вiд P до S атомнi об‘єми зменшуються. Поява першої пари e¯ веде до
зменшення rат. |
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|||||||||||
5/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Атомнi та iоннi радiуси
Атомнi та iоннi радiуси. Внаслiдок хвильового характеру руху e¯ не має строго визначенних меж, тобто вимiряти абсолютнi розмiри атомiв неможливо.
Як радiус атома можна приняти теоретично розраховане положення головного максимуму густини зовнiшнiх електронних хмаринок, так званий орбiтальний радiус.
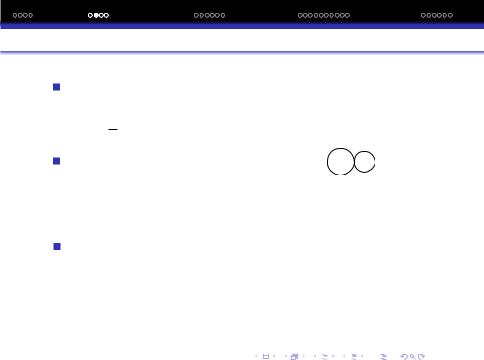
r¯= a |
Z2 |
|
3 |
− |
l(l + 1) |
|
2 |
|
2 |
||||
|
n |
2 |
|
2n |
||
Практично мають справу з ефективними радiусами, якi визначають при вивченi структури кристалiв i молекул. Щоб обчислити ефективний радiус припускають, що атом має форму шара (кулi): атоми в кристалi торкаються один одного сферами.
6/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Атомнi та iоннi радiуси
Вiдстань мiж двома сусiднiми атомами в кристалiчнiй гратцiстала кристалiчної гратки (d,l). Для простої речовини
d
rеф = 2.
Для складної речовини d = r‘ |
+ r” . |
d |
|
||
еф |
еф |
|
Користуючись цими даними i величинами d для кристалiчних граток фторидiв i оксидiв можливо обчислити радiуси рiзних iонiв.
Стала кристалiчної гратки (d) приймає рiзнi значення в залежностi вiд природи зв‘язку: iонний, ковалентний, металiчний,вандерваальсiвський.
Звiдси рiзними будуть i радiуси: iоннi, ковалентнi, металiчнi, вандерваальсiвськi. rнегат.iон > rат > rпоз.iон
7/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Атомнi та iоннi радiуси
Аналогiчно атомним об‘ємам rат i riон. iз збiльшенням Z змiнюються перiодично (максимальнi значення для лужних металiв).
В перiодах iз збiльшенням заряда ядра при однаковому числi електронних рiвнiв rат зменшуються. У великих перiодах в сiдловинах розмiщуються d-елементи, радiуси яких мало вiдрiзняються один вiд iншого, внаслiдок забудови внутрiшнього d-пiдрiвня.
У межах родин d- i f - елементiв у великих перiодах спостерiгається бiльш пологе зменшення радiусiв. Це зменшення називається d−,f − стисненням (лантаноїдна, актиноїдна контракцiя).
Зменшення радiусiв зв‘язано iз збiльшенням заряда ядра, а число e¯ на зовнiшньому шарi d-елементiв одне i теж.
8/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Атомнi та iоннi радiуси
В групах rат i riон, в загальному, збiльшуються для s- i p- елементiв в бiльшiй мiрi, нiж для d- елементiв.
Елемент |
◦ |
Елемент |
◦ |
r,A |
r, A |
||
|
|
|
|
As |
1.48 |
V |
1.34 |
|
|
|
|
Sb |
1.61 |
Nb |
1.45 |
|
|
|
|
Bi |
1.82 |
Ta |
1.46 |
|
|
|
|
Збiльшення радiуса при переходi вiд 5-го до 6-го перiоду компенсується f − стисненням.
9/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Iонiзацiйний потенцiал
Iонiзацiйний потенцiал. Як вiдомо хiмiчнi властивостi елемента, його природа обумовлюються можливiстю його атома втрачати або приєднувати e¯. Цю здатнiсть кiлькiсно можна оцiнити величинами I1 або Eсп вiдповiдно.
I називається кiлькiсть енергiї, яку потрiбно затратити, щоб вiдiрвати e¯ вiд незбудженого атома, iона або молекули: A + I1 <=> A+ + e¯.
Енергiю iонiзацiї виражають в Кдж/моль, або в eB/атом, eB-електрон-вольт (1 еВ/моль = 96.14 Кдж/моль; 1 еВ/атом = 1.6·10−22Кдж/моль).
Це мiра, яка визначає здатнiсть атома до утворення позитивно зарядженого iона. Мiрою енергiї iонiзацiї є потенцiал iонiзацiї.
10/31
