
Вьюник. Лекция № 8
.pdf
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Спорiдненiсть до електрона
Змiна окисно–вiдновних властивостей
Енергiя iонiзацiї та спорiдненостi до електрона певною мiрою характеризують здатнiсть елементiв взаємодiяти мiж собою.
Наприклад, вiдновнi властивостi нейтральних атомiв знаходяться в тiсному зв‘язку з I1. Очевидно, що чим менше I1, тим легше вiдiрвати e¯, тим яскравiше вираженi вiдновнi властивостi.
В перiодах: злiва направо падають вiдновнi властивостi. Самий сильний вiдновник у кожному перiодi - лужний метал, найбiльш слабкий - галоген.
21/31

Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Спорiдненiсть до електрона
Електронегативнiсть
В групах: 1, 2, 3, 13, для f −елементiв вiдновна активнiсть зростає зi збiльшенням заряду ядра.
У d−елементiв, крiм 3-ї групи, падає.
Окиснювальна здатнiсть нейтральних атомiв тiсно зв‘язана з Eсп. В перiодах: справа налiво падає. В групах: зверху вниз зменшується (iз збiльшенням rA).
Оскiльки обидвi величини (I1 , Eсп) характеризують властивостi тiльки iндивiдуальних атомiв, їх практичне використання обмежене.
Для передбачення реакцiйної здатностi елементiв введено спецiальну умовну величину, яку назвали електронегативнiстю (ЕН).
Введена Л. Полiнгом.
22/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Спорiдненiсть до електрона
Електронегативнiсть
Вона не є точно визначеною фiзичною величиною. Це емпiрична вiдносна характеристика. Електронегативнiсть дозволяє оцiнити здатнiсть атома до вiдтягування електронної густини.
Iснує бiля 20 шкал ЕН. За Л. Полiнгом ЕН(F)= 4.0.
Для розрахунку ЕН застосовують рiзнi пiдходи. Полiнг використав емпiричний пiдхiд для визначення рiзницi еле-
ктронегативностей ( ): = EA-B − 12(EA-A + EB−B).
Оскiльки це рiвняння дає можливiсть визначити тiльки рiзницю ЕН, то одному з елементiв треба було б приписати умовне значення ЕН. Саме Л. Полiнг приняв для атома фтору ЕН = 4.0.
23/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Спорiдненiсть до електрона
Електронегативнiсть
Малiкен для визначення ЕН використав рiвняння:
1
EH = 2(I1 + Eсп).
Не дивлячись на те, що шкали ЕН грунтувалися на рiзних уявленнях, отриманi числовi значення ЕН для конкретних елементiв мало вiдрiзняються одне вiд одного.
Уперiодах ЕН падає справа налiво, тобто в мiру збiльшення радiуса атома та зменшення ефективного заряду.
Уголовних групах найбiльшi ЕН мають елементи, якi починають групу, тобто елементи другого перiоду.
24/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Спорiдненiсть до електрона
Електропозитивнiсть
Поряд з поняттям електронегативностi для характеристики металiчностi використовується поняття електропозитивностi (ЕП).
ЕП характеризує здатнiсть атома елемента вiддавати електрони.
Здатнiсть атомiв вiддавати e¯є найвищою для великих атомiв, якi перетворюються на однозаряднi катiони: Li, Na, K, Rb, Cs.
ЕП зменшується зi зменшенням розмiрiв атома, а також зi збiльшенням заряду катiона, що утворюється при iонiзацiї.
Зазвичай, чим вища ЕП елемента, тим iмовiрнiшим є основний характер оксиду, гiдроксиду, стiйкiшими є солi кисневмiсних кислот тощо.
25/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Внутрiшня та вторинна перiодичнiсть
Внутрiшня та вторинна перiодичнiсть. Вивчення Перiодичної системи елементiв виявило, що крiм класичної (менделєєвської) перiодичностi, вiдомi i iншi види перiодичностi.
Внутрiшня перiодичнiсть спостерiгається в межах великих перiодiв.
Наприклад, двiчi вiдбувається зростання металiчних властивостей в рядах:
а) Sc, Ti, V, Cr,Mn, Fe, Co, Ni, Cu, Zn ;
б) Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu.
Перший раз це обумовлено заповненням вiдповiдно d−, f − орбiталей спочатку по одному e¯, а потiм по другому.
26/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Внутрiшня та вторинна перiодичнiсть
Вторинна перiодичнiсть. Вiдкрив в 1831р росiйський хiмiк Базаров, в 1916р проаналiзував Бiрон, Щукарьов зробив спробу теоретичного пояснення цього явища.
Вторинна перiодичнiсть полягає в тому, що в межах груп елементiв повних електронних аналогiв змiна деяких властивостей вiдбувається не монотонно, а в деякiй мiрi перiодично. Наприклад:
1здатнiсть галогенiв до утворення оксигенвмiсних сполук. У F вона майже не проявляється, яскраво проявляється у Cl. При переходi до Br ця здатнiсть рiзко зменшується, а у I
– вона знову зростає. Бром за цiєю здатнiстю повторює флуор, а йод - хлор.
27/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Внутрiшня та вторинна перiодичнiсть
2Перiодично змiнюються властивостi оксигенвмiсних сполук у елементiв головних груп 14,15,16.
3 I1,
4HF оксидiв,
5 rI,
6 атомнi об‘єми.
28/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Внутрiшня та вторинна перiодичнiсть
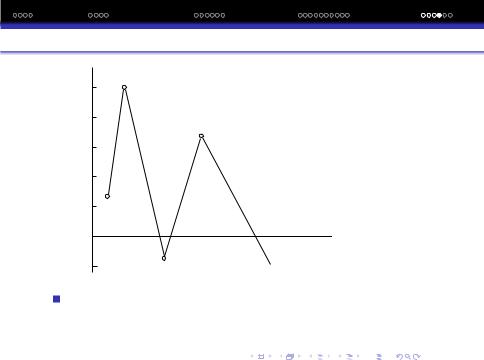
ΔHF SIO
200
160
SNO
120
80
40 CO
0
Z
-40 GEO  PBO
PBO
Причини вторинної перiодичностi не зовсiм зрозумiлi. Їх пов‘язують з ефектами проникнення e¯ та екранування заряду ядра.
29/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Ядерна перiодичнiсть
Ядерна перiодичнiсть - вiдображує перiодичну залежнiсть у змiнi будови самих ядер.
Ядерна перiодичнiсть вiдрiзняється вiд менделєєвської. Ядра мають пошарову будову.
Причиною ядерної перiодичностi є перiодичнiсть в заповненi нуклонних шарiв в ядрi.
30/31
