
Вьюник. Лекция № 8
.pdf
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Iонiзацiйний потенцiал
Потенцiал iонiзацiї найменша напруга в вольтах, яку треба прикласти, щоб вiддалити e¯ вiд атома на ∞ вiдстань
E∞ −Eнорм. = hν
Енергiя iонiзацiї кiлькiсно характеризує зв‘язок електронiв з ядром в окремо взятому атомi.
Як i слiдувало очiкувати, вiдщеплення кожного наступного e¯ потребує все бiльших енергетичних затрат. Позначення
I1,I2,I3,...IN: I1 < I2 < I3 ....
Величина iонiзацiйного потенцiалу залежить вiд структури електронної оболонки атома, радiуса, а при рiвностi останнiх i вiд заряду ядра.
Заповненi електроннi оболонки виявляють пiдвищену стiйкiсть до вiдриву e¯. Найменше значення I1 у s− елементiв 1-ої групи. Найбiльше його значення у s− i p− елементiв 18 групи (iнертнi гази).
11/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Iонiзацiйний потенцiал
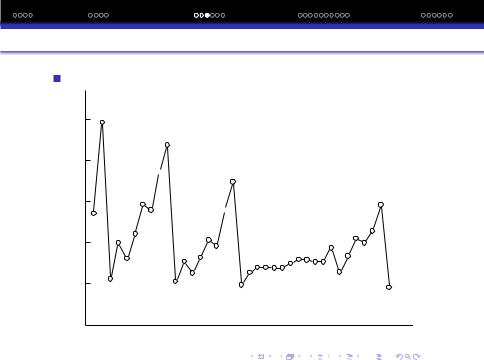
В залежностi I1 вiд Z є явна перiодичнiсть.
ев
1 I
25
20
15
10
5
He
Ne
F Ar
Ar
N
Cl
HO
Be |
|
P |
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
Mg |
S |
Ti |
|
B |
Si |
Ca |
|
|
|
|
Sc |
|
|
|
Na Al |
|
|
Li |
|
K |
|
|
|
|
|
|
|
|
|
Kr |
|
|
Zn |
As Br |
|
|
|
|
|
Fe |
Ni |
Se |
Cr |
|
Ge |
|
|
Mn Co Cu |
||
V |
|
||
|
Ga |
|
|
|
|
|
|
Rb
Z
12/31
Атомний об‘єм Атомнi та iоннi радiуси Iонiзацiйний потенцiал Спорiдненiсть до електрона Перiодичнiсть
Iонiзацiйний потенцiал
Вплив екранування та проникнення електронiв
Зростання I1 при переходi вiд елементiв 1-шої групи до елементiв 18-ої групи обумовлене збiльшенням ефективного заряду ядра. На залежностi I1 − Z спостерiгаються максимуми i мiнiмуми.
Сильно вираженi: максимуми у He, Ne,Ar, Kr, Xe, мiнiмуми у Li, Na, K, Rb, Cs;
слабко вираженi: максимуми у Be, N, Mg, P, Zn, As; слабко вираженi мiнiмуми у B, O, Al, S, Ga, Se.
Пояснення даються з допомогою уявлень про екранування заряда ядра i про проникнення e¯ до ядра.
Максимуми обумовленi пiдвищеною стiйкiстю конфiгурацiй s2 (Be, Mg, Zn); p3 (N, P, As).
Екранування заряду ядра: (B, Al, Ga) – s2; взаємовiдштовхування 2-х електронiв ( O, S, Se).
13/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Iонiзацiйний потенцiал
Вплив екранування та проникнення електронiв
У вiдповiдностi з особливостями електронної будови у d− i f − елементiв I1 близькi: MN(3d54s2) ; ZN(3d104s2), одна площадка, 4s2 електрон проникає пiд екран 3d- пiдрiвня.
В групах s- i p- елементи iз зростанням Z зменшується I1, а для d- елементiв збiльшується:
Елемент |
I1,eB |
Елемент |
I1,eB |
As |
9.81 |
V |
6.74 |
|
|
|
|
Sb |
8.64 |
NB |
6.88 |
|
|
|
|
Bi |
7.29 |
TA |
7.88 |
|
|
|
|
Зменшення в пiдгрупах s- i p- елементiв пояснюється посиленням екранування заряда ядра e¯попереднiх електронних оболонок.
14/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Iонiзацiйний потенцiал
Вплив екранування та проникнення електронiв
Зростання в пiдгрупах d-елементiв пояснюється ефектом проникнення електронiв 4s,5s,6s пiд екран 3d,4d а у випадку 6s2 електрони проникають пiд подвiйний екран 5d i 4f . Це призводить до збiльшення мiцностi зв‘язку електронiв з ядром.
Енергiю iонiзацiї розраховують теоретично i визначають експериментально за даними спектроскопiї.
15/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Спорiдненiсть до електрона
Спорiдненiсть до електрона (Eсп). Взагалi можливе i приєднання додаткового e¯ до любого атома, iона або молекули.
Енергiю, яка при цьому процесi видiляється або поглинається називають енергiєю спорiдненостi до електрона.
Енергiя спорiдненостi до електрона (Eсп) характеризує процес: A + e¯ = A− + Eсп , який можна розглядати як протилежний процесу iонiзацiї атома.
Слiд зауважити, що знак енергiї спорiдненостi до електрона за умовою протилежний знаку I1, проте негативна спорiдненiсть до e¯ все таки вiдома.
16/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Спорiдненiсть до електрона
Як i енергiю iонiзацiї, Eсп також виражають у Кдж/моль або в eB/атом.
Енергiя спорiдненостi до електрона залежить вiд низки чинникiв:
1 радiусiв атомiв;
2 ефективного заряду ядра атома;
3електронної конфiгурацiї атома.
Умiру зменшення розмiрiв атомiв Eсп збiльшується. Ця величина збiльшується також при зростанi ефективного заряду ядра.
Eсп визначають масспектрометричним способом. Надiйнi величини вiдомi лише для небагатьох елементiв.
17/31
Атомний об‘єм Атомнi та iоннi радiуси Iонiзацiйний потенцiал Спорiдненiсть до електрона Перiодичнiсть
Спорiдненiсть до електрона
Порiвняння залежностей Eсп − Z i I1 − Z показує, що максимуми i мiнiмуми на залежностi Eсп змiщенi в порiвнянi з I1 на один елемент влiво.
Найбiльша спорiдненiсть характерна для p-елементiв 17-ої групи.
Найменшу спорiдненiсть мають атоми з конфiгурацiями: s2 (Be, Mg, Zn ) та s2p6 (Ne, Ar, Kr) або з наполовину заповненим p-пiдрiвнем (N, P, As).
Сила притягання 1 e¯ до ядра атомiв O, S, C i iнших бiльше сили вiдштовхування 1 e¯ i електронної оболонки цих атомiв.
Вiдповiдно до квантово-механiчних розрахункiв приєднання 2-х i бiльшої кiлькостi e¯ завжди потребує затрати енергiї. Тому у вiльному станi багатозаряднi анiони (O 2 – , S 2 – , N 3 – ) не iснують.
18/31
Атомний об‘єм |
Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал |
Спорiдненiсть до електрона |
Перiодичнiсть |
Спорiдненiсть до електрона
Навiть у кристалiчних гратках з такими iонами вiдбувається перерозподiл електронної густини мiж катiоном i анiоном, внаслiдок чого величина негативного заряду анiона зменшується.
Вперiодах: чим менше радiус атома, тим легше атом приєднує e¯.
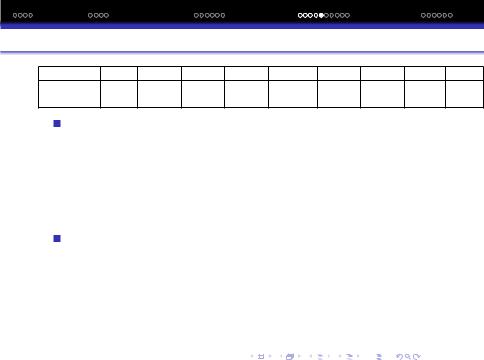
Вгрупах знизу вверх посилюється тенденцiя до приєднання e¯. Проте iз цiєї закономiрностi випадають елементи другого перiоду F, O, N (таблиця):
19/31
Атомний об‘єм Атомнi та iоннi радiуси |
Iонiзацiйний потенцiал Спорiдненiсть до електрона |
Перiодичнiсть |
|||||||
Спорiдненiсть до електрона |
|
|
|
|
|
||||
Елемент |
H |
F |
Cl |
Br |
J |
O |
S |
N |
P |
Eсп, |
72.8 |
322.7 |
351.4 |
338.9 |
325.09 |
141.5 |
200.4 |
-20.0 |
77.0 |
Кдж/моль |
|
|
|
|
|
|
|
|
|
Це пояснюється малими розмiрами атомiв F, O, N, внаслiдок чого великою є у них електронна густина.
Приєднання в цьому випадку зайвого e¯ настiльки збiльшує мiжелектронне вiдштовхування, що енергiя спорiдненостi до електрона цих атомiв стає меншою, нiж у наступних за ними.
Вiд‘ємне значення Eсп атома нiтрогену пояснюють пiдвищеною стiйкiстю його напiвзаповненого p−пiдрiвня.
Для атомiв елементiв, що мають повнiстю заповненi ns− та np− пiдрiвнi, значення Eсп також вiд‘ємнi, тобто атоми таких елементiв подiбно до атома нiтрогену ”змушенi” приєднувати електрони.
20/31
