
- •Задание 1
- •Задание 2,3,4
- •Задание 5
- •Задание 6
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10
- •Задание 11
- •Задание 12
- •Задание 13
- •Задание 14
- •Задание 15
- •Задание 16
- •Задание 17
- •Задание 18
- •Задание 19
- •Задание 20
- •Задание 21
- •Задание 22
- •Задание 23
- •Задание 24
- •Задание 25
- •Задание 26
- •Задание 27
- •Задание 28
- •Задание 29
- •Задание 30
Задание 11
Буферные растворы, классификация буферных растворов. Механизм буферного действия. рН буферных растворов. Уравнение Хендериксона - Хоссельбаха для буферных растворов кислотного и основного типов.
Буферные растворы – растворы, способные оставлять неизменным значение Рн при добавлении небольшого количества сильных кислот или сильных оснований.
В качестве буферных смесей могут быть использованы системы:
слабая кислота и её соль с сильным основанием, например, ацетатный буфер СН3СООН + CH3COONa
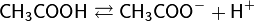
слабое основание и его соль с сильной кислотой, например, аммиачный буфер NH4OH + NH4Cl
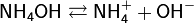
кислая соль и средняя соль слабой кислоты с сильным основанием, например, карбонатный буфер Na2CO3 + NaHCO3

Буферная система представляет собой смесь слабой кислоты и ее соли, образованной сильным основанием (например, уксусной кислоты СН3СООН и ацетата натрия CH3COONa), или смесь слабого основания и его соли, образованной сильной кислотой (например, смесь гидроокиси аммония NH4OH и хлористого аммония NH4Cl). Величина рН буферного раствора зависит от величины константы диссоциации слабой кислоты или слабого основания и от соотношения концентраций компонентов, образующих буферную систему. Буферные системы играют большую роль в сохранении постоянства рН в жидкостях и тканях организма.
Из уравнения Гендерсона-Гассельбахаследует ряд важных выводов:
рн буферных растворов зависит от отрицательности десятичного логарифма константы диссоциации слабой кислоты pKa или основания pKв и от отношения концентраций кислотно-основной пары, но практически не зависит от разбавления раствора.
Значения pKa любой кислоты и рКв любого основания можно вычислить по измеренному рН раствора, если известны молярные концентрации компонентов.
Уравнение Гендерсона-Гассельбаха позволяет рассчитать рН буферного раствора, если известны значения рКа (рКв) и молярные концентрации компонентов.
Уравнение можно использовать для определения отношения компонентов буфера, чтобы приготовить раствор с заданным значением рН.
СпособностьбуферныхрастворовсохранятьрНограничена. Прибавлять кислоту и щелочь, существенно не меняярН буферного раствора, можнолишь в небольшихколичествах.
Задание 12
Буферная емкость. Буферные системы в организме человека, их роль в поддержании гомеостаза рН. Буферные системы крови.
Буферная емкость – количество молей эквивалента сильной кислоты или сильного основания, которое необходимо добавить к одному литру буферного раствора, чтобы изменить значение его Рн на единицу. Измеряется количеством моль эквивалента кислоты или основания, добавление которого к 1л буферного раствора рН на единицу.
Буферная емкость является количественной мерой буферного действия раствора. Буферный раствор имеет максимальную буферную емкость при pH = pK кислоты или основания, образующей смесь при соотношении ее компонентов, равном единице. Чем выше исходная концентрация буферной смеси, тем выше ее буферная емкость. Буферная емкость зависит от состава буферного раствора, концентрации и соотношения компонентов.
Нужно уметь правильно выбрать буферную систему. Выбор определяется необходимым интервалом pH. Зона буферного действия определяется силовым показателем кислоты (основания) ±1 ед.
При выборе буферной смеси необходимо учитывать химическую природу ее компонентов, так как вещества раствора, к которым добавляется буферная система, могут образовывать нерастворимые соединения, взаимодействовать с компонентами буферной системы.
Буферные растворы имеют большое значение для протекания реакций в живых организмах. Например, в крови постоянство водородного показателя рН (химический гомеостаз) поддерживается тремя независимыми буферными системами: бикарбонатной, фосфатной и белковой. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Буферная система представляет собой смесь слабой кислоты и ее соли, образованной сильным основанием (например, уксусной кислоты СН3СООН и ацетата натрия CH3COONa), или смесь слабого основания и его соли, образованной сильной кислотой (например, смесь гидроокиси аммония NH4OH и хлористого аммония NH4Cl). Величина рН буферного раствора зависит от величины константы диссоциации слабой кислоты или слабого основания и от соотношения концентраций компонентов, образующих буферную систему. Буферные системы играют большую роль в сохранении постоянства рН в жидкостях и тканях организма.
Кровь содержит 4 основные буферные системы.
1. Гидрокарбонатная. На ее долю приходится 50% емкости. Она работает главным образом в плазме и играет центральную роль в транспорте СО2.
2. Белковая. На ее долю приходится 7% емкости.
3. Гемоглобиновая, на нее приходится 35% емкости. Она представлена гемоглобином и оксигемоглобином.
4. Гидрофосфатная буферная система - 5% емкости. Гидрокарбонатная и гемоглобиновая буферные системы выполняют центральную и чрезвычайно важную роль в транспорте СО2 и установлении pH. В плазме крови pH 7,4. СО2 - продукт клеточного метаболизма, выделяющийся в кровь. Диффундирует через мембрану в эритроциты, где реагирует с водой с образованием Н2СО3. Соотношение устанавливается равным 7, и pH будет 7,25.
Основания также связываются буферным раствором крови и выделяются с мочой, главным образом в виде одно- и двузамещенных фосфатов.
В клиниках всегда определяют резервную щелочность крови.
