
BASKAKOV
.pdf
C. П. Баскаков
ПЕРЕВОЗКА СЖИЖЕННЫХ ГАЗОВ
МОРЕМ
Сформатировано: 3RD OFF V.Nedyelkov 2ND ENG P. Kovalenko
2002 “ GAZ SUN”
|
2 |
ОГЛАВЛЕНИЕ |
|
Основы химии газов ............................................................................................................................. |
6 |
Строение атома. Периодическая таблица элементов ..................................................................... |
6 |
Масса атома ......................................................................................................................................... |
7 |
Закон Авогадро .................................................................................................................................... |
7 |
Классификация углеводородов .......................................................................................................... |
8 |
Основные химические войства углеводородов.............................................................................. |
11 |
Полимеризация.................................................................................................................................... |
11 |
Катализаторы ....................................................................................................................................... |
12 |
Ингибиторы.......................................................................................................................................... |
13 |
Пахучие вещества .............................................................................................................................. |
13 |
Реакция углеводородов с водой — образование гидратов (SLUSH).............................................. |
13 |
Химическая совместимость газов ..................................................................................................... |
16 |
Неорганические газы .......................................................................................................................... |
17 |
Транспортные характеристики газов ................................................................................................. |
17 |
Общие положения................................................................................................................................ |
17 |
Основные группы газов, перевозимых морем................................................................................... |
18 |
Химические грузы................................................................................................................................ |
19 |
Основные физические свойства газов .............................................................................................. |
19 |
Воздействие низких температур (Brittle Fracture).............................................................................. |
20 |
Всплескивание груза (sloshing) .......................................................................................................... |
20 |
Переворачивание груза (rollover)........................................................................................................ |
20 |
Статическое электричество................................................................................................................ |
.20 |
Основные опасности на танкерах и газовозах................................................................................. |
23 |
Статическое электричество на танкерах и газовозах ...................................................................... |
23 |
Способы уменьшения возникновения статических зарядов ........................................................... |
26 |
Пожароопасность ................................................................................................................................ |
27 |
Воспламеняемость .............................................................................................................................. |
27 |
Классификация опасных грузов .......................................................................................................... |
30 |
Токсичность сжиженных газов и сопутствующих веществ ............................................................. |
32 |
Предельно допустимая концентрация .............................................................................................. |
32 |
Классификация токсинов .................................................................................................................... |
34 |
Пути проникновения токсинов в организм ......................................................................................…35 |
|
Побочные опасности ........................................................................................................................... |
38 |
Оказание первой помощи при отравлении вредными и токсичными веществами ....................... |
41 |
Приборы контроля атмосферы танков................................................................................................ |
43 |
Типы приборов контроля атмосферы ................................................................................................ |
43 |
Приборы для измерения взрывоопасных концентраций газов........................................................ |
44 |
Эксплозиметры .................................................................................................................................... |
44 |
Интерферометр.................................................................................................................................... |
47 |
Анализаторы содержания кислорода................................................................................................. |
48 |
Приборы и устройства для измерения концентрации токсичных газов....................................... |
…50 |
Приборы для измерения точки росы ................................................................................................. |
51 |
Типы газовозов........................................................................................................................................ |
55 |
Типы и группы газовозов..................................................................................................................... |
55 |
Газовозы напорного типа.................................................................................................................... |
56 |
Газовозы полунапорного типа ........................................................................................................... |
58 |
Газовозы-химовозы ............................................................................................................................ |
59 |
Суда рефрижераторного типа........................................................................................................... |
.60 |
Суда для перевозки природного газа — метановозы ...................................................................... |
61 |
|
3 |
Конструктивные особенности газовозов............................................................................................. |
62 |
Конструкции грузовых танков............................................................................................................... |
62 |
Защита грузовых емкостей от повреждений....................................................................................... |
65 |
Материал, используемый для изготовления танков ......................................................................... |
65 |
Изоляция грузовых танков................................................................................................................... |
66 |
Основные системы газовозов.............................................................................................................. |
68 |
Специальные системы газовозов........................................................................................................ |
74 |
Оборудование. Инструменты .............................................................................................................. |
75 |
Основы термодинамики сжиженных газов.......................................................................................…78 |
|
Идеальный газ .................................................................................................................................... |
..78 |
Основы термодинамики ................................................................................................................... |
…81 |
Расчет температуры смеси жидкой фазы груза ................................................................................ |
83 |
Закон Дальтона..................................................................................................................................... |
84 |
Взаимные превращения жидкостей и газов........................................................................................ |
85 |
Работа при изменении объема газа................................................................................................... |
.87 |
Энтропия ................................................................................................................................................ |
87 |
Теплопроводность................................................................................................................................ |
88 |
Расчет изоляции грузовых танков ...................................................................................................... |
88 |
Диаграмма Молье................................................................................................................................. |
90 |
Установки повторного сжижения газов ..........................................................................................…. 94 |
|
Принципы искусственного охлаждения............................................................................................... |
94 |
Циклы УПСГ........................................................................................................................................... |
94 |
Схема и принцип работы одноступенчатой УПСГ ............................................................................ |
95 |
Схема и принцип действия двухступенчатой УПСГ.......................................................................... |
99 |
Каскадная УПСГ.................................................................................................................................. |
101 |
Расчет общего времени погрузки судна в порту ………………………………………………………..102 |
|
Насосы грузовых систем газовозов................................................................................................. |
104 |
Основные понятия и определения.................................................................................................... |
104 |
Математические основы расчета рабочих параметров насоса..................................................... |
105 |
Типы насосов грузовых систем газовозов........................................................................................ |
106 |
Напорные характеристики насосов................................................................................................... |
109 |
Напорные характеристики трубопроводов....................................................................................... |
111 |
Работа центробежных насосов в составе трубопроводов.............................................................. |
113 |
Особенности действия грузовых насосов........................................................................................ |
114 |
Меры предосторожности при эксплуатации грузовых систем ....................................................... |
118 |
Меры безопасности на газовозах....................................................................................................... |
121 |
Общие принципы обеспечения безопасности на газовозах ......................................................... .. |
121 |
Конструктивное обеспечение пожарной безопасности.................................................................. |
121 |
Оборудование газовоза активными средствами пожаротушения................................................. |
124 |
Системы обнаружения пожаров….................................................................................................... 127 |
|
Переносные средства пожаротушения ............................................................................................ |
128 |
Дыхательные аппараты...................................................................................................................... |
128 |
Организационные мероприятия по обеспечению пожаробезопасности....................................... |
129 |
Меры безопасности при выполнении судовых работ..................................................................... |
131 |
Грузовые операции .............................................................................................................................. |
141 |
Основные этапы обработки груза на борту судна .......................................................................... |
141 |
Расчет времени на погрузку.............................................................................................................. |
145 |
Выгрузка .............................................................................................................................................. |
146 |
Специальные правила....................................................................................................................... |
147 |
|
4 |
Замеры и подсчет груза. Грузовая документация ........................................................................ |
151 |
Общие положения................................................................................................................................ |
151 |
Особенности подсчета груза на газовозах....................................................................................... |
155 |
Плотность груза.................................................................................................................................. |
156 |
Стандартные способы подсчета груза.............................................................................................. |
158 |
Общие правила определения веса груза......................................................................................... |
158 |
Расчет газовой фазы груза................................................................................................................ |
163 |
Перевод процентных соотношений смесей в весовые или объемные соотношения, |
|
и наоборот ………………………………………………..……………………………………………………163 |
|
Подсчет линейной скорости потока жидкости.................................................................................. |
165 |
Грузовая документация ..................................................................................................................... |
165 |
Подготовка грузовых танков…............................................................................................................166 |
|
Методы замены атмосферы танка...................................................................................................…168 |
|
Метод разбавления атмосферы (DILUTION METHOD)................................................................... |
.170 |
Организация процесса замены атмосферы танков......................................................................... |
.174 |
Смена груза и условия предъявления судна под погрузку ..........................................................….180 |
|
Мойка танков........................................................................................................................................ |
182 |
Заключительная обработка поверхности танка............................................................................... |
183 |
Аварийные мероприятия на газовозах ............................................................................................. |
185 |
Аварийное планирование .................................................................................................................. |
186 |
Организация борьбы с пожарами..................................................................................................... |
186 |
Инциденты с грузом ........................................................................................................................... |
189 |
Операция с грузом............................................................................................................................. |
190 |
Подвижка судна у причала................................................................................................................ |
190 |
Посадка на мель................................................................................................................................. |
191 |
Касание грунта .................................................................................................................................... |
191 |
Столкновение ...................................................................................................................................... |
192 |
Аварийная перекачка груза с судна на судно ..............................................................................….192 |
|
Подготовка экипажа к оставлению судна......................................................................................... |
192 |
Словарь терминов. Общепринятые сокращения.......................................................................….. 194 |
|
Приложения......................................................................................................................................... |
203 |

5
6
ОСНОВЫ ХИМИИ ГАЗОВ
СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ЭЛЕМЕНТОВ
Согласно современным представлениям, все вещества, находящиеся в жидком или парообразном состоянии, имеют молекулярную структуру. В твердом виде только органические вещества состоят из молекул, как и некоторые неметаллы, оксиды углерода и вода. Строение же большинства твердых неорганических веществ определяется решеткой, состоящей из атомов и ионов, образующих макротела — кристаллы. Молекулярной структуры не имеют соли, оксиды металлов, кремний, алмаз, металлы и т. д.
Химические связи между молекулами менее прочные, чем между атомами, и поэтому температуры плавления и кипения веществ с молекулярной структурой сравнительно низкие. Современная химия изучает свойства микрочастиц (молекул, атомов, ионов) и макротел.
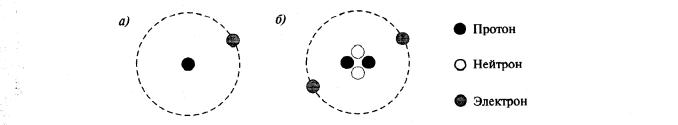
Из школьного курса физики известно, что вокруг положительно заряженного ядра атома движутся электроны, имеющие единичный отрицательный заряд. В целом атом электрически нейтрален, следовательно число электронов, движущихся вокруг ядра атома, должно быть равно заряду ядра атома
(рис. 1).
Рис. 1. Структура атома водорода (о) и гелия (б)
Ядро атома состоит из протонов (частицы с массой 1 и зарядом +1). Поскольку масса атомов, кроме атома водорода, всегда больше той массы, которая приходится на долю протонов, было естественно предположить, что в состав ядра входят и электрически нейтральные частицы с массой 1, впоследствии названные нейтронами.
Было установлено, что свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов.
!В Периодической таблице элементов порядковый номер элемента совпадает с зарядом ядра его атома.
Электроны в атомах обладают различным запасом энергии, и в зависимости от величины этой энергии они располагаются на различных энергетических уровнях или орбитах относительно ядра атома.
На первом энергетическом уровне может быть не более 2 электронов, а внешней орбите может быть расположено не более 8 электронов. Заряд атомного ядра (порядковый номер) определяет химические свойства элемента.
Количество электронов на внешнем энергетическом уровне определяет валентность элемента (его химическую активность), поэтому они называются валентными электронами.
Сущность явления периодичности объясняется тем, что с возрастанием заряда ядра атома элементов наблюдается периодическая повторяемость элементов с одинаковым числом валентных электронов. Это определяет периодическую повторяемость свойств химических элементов и их соединений.
В вертикальных колонках периодической таблицы (рис. 2) расположены группы элементов, имеющих одинаковое количество электронов на внешней орбите (определяющих валентность элемента). Всего в
таблице восемь основных групп элементов.
Периодическая таблица имеет также семь горизонтальных строк — периодов, поскольку каждый атом не может иметь более семи электронных орбит. Можно сказать, что количество электронных орбит определяет энергетический уровень электронов.
Когда два или более атомов объединяются между собой, образуется молекула вещества.
Если два атома имеют одну или несколько пар электронов, являющихся общими для них, т. е. электроны перескакивают с орбиты одного атома на орбиту другого, возникает так называемая ковалентная связь. Основную часть неорганических элементов составляют металлы, они формируют металлические связи между атомами. При этом атомы располагаются очень близко друг к другу и образуют структурную (кристаллическую) решетку, В правой части периодической таблицы элементов расположены инертные газы, которые существуют только в виде атомов.
7
МАССА АТОМА
Одной из основных характеристик любого химического элемента является его относительная атомная масса.
(Атомная единица массы — это 1/12 массы атома углерода, масса которого принимается равной 12 а. е. м. и составляет 1,66 • 10 24 г.
Сравнивая массы атомов элементов с одной а.е.м., находят численные значения относительной атомной массы (Аг).
Относительная атомная масса элемента показывает, во сколько раз масса его атома больше 1/12 массы атома углерода.
Например, для кислорода Аг (О) = 15,9994, а для водорода Аг (Н) = 1,0079.
Для молекул простых и сложных веществ определяют относительную молекулярную массу, которая численно равна сумме атомных масс всех атомов, входящих в состав молекулы. Например, молекулярная масса воды Н2 О
Мг (Н2O) = 2 • 1,0079 + 1 • 15,9994 = 18,0153.
ЗАКОН АВОГАДРО
В химии наряду с единицами массы и объёма используется единица количества вещества, называемая молем.
!МОЛЬ (v) — единица измерения количества вещества, содержащего столько структурных единиц (молекул, атомов, ионов), сколько атомов содержится в 0,012 кг (12 г) изотопа углерода "С’’.
Это означает, что 1 моль любого вещества содержит одно и то же число структурных единиц, равное 6,02 • 1023. Эта величина носит название постоянной Авогадро (обозначение NА, размерность 1/моль).
Итальянский ученый Амадео Авогадро в 1811 году выдвинул гипотезу, которая в дальнейшем была подтверждена опытными данными и получила впоследствии название закона Авогадро. Он обратил внимание на то, что все газы одинаково сжимаются (закон Бойля—Мариотта) и обладают одинаковыми коэффициентами термального расширения (закон Гей-Люссака). В связи с этим он предположил, что:
в равных объёмах различных газов, находящихся при одинаковых условиях, содержится одинаковое число молекул.
При одинаковых условиях (обычно говорят о нормальных условиях: абсолютное давление равно 1013 миллибар и температура 0° С) расстояние между молекулами у всех газов одинаково, а объём молекул ничтожно мал. Учитывая все вышесказанное, можно сделать предположение:
!если в равных объемах газов при одинаковых условиях содержится одинаковое число молекул, то и массы, в которых содержится одинаковое число молекул,должны иметь одинаковые объёмы.
Другими словами,
При одинаковых условиях 1 моль любого газа занимает одинаковый объем. При норальных условиях 1 моль любого газа занимает объем v, равный 22,4 л. Этот объем называется молярным объемом газа (размерность л/моль или м³/моль).
Точное значение молярного объёма газа при нормальных условиях (давление 1013 миллибар и температура 0° С) составляет 22,4135 ± 0,0006 л/моль. При стандартных условиях (t =+15° С, давление
= 1013 мбар) 1 моль газа занимает объём 23,6451 л, а при t=+20° С и давлении 1013 мбар 1 моль занимает объём около 24,2 л.
В численном выражении молярная масса совпадает с массами атомов и молекул (в а. е. м.) и с относительными атомными и молекулярными массами.
Следовательно, 1 моль любого вещества имеет такую массу в граммах, которая численно равна молекулярной массе данного вещества, выраженной в атомных единицах массы.
Например, М(O2) = 16 а. е. м. • 2 = 32 а. е. м., таким образом, 1 моль кислорода соответствует 32 г. Плотности газов, измеренные при одинаковых условиях, относятся как их молярные массы. Так как при перевозке сжиженных газов на газовозах основным объектом практических задач являются молекулярные вещества (жидкости, пары, газы), то и основными искомыми величинами будут молярная масса М (г/моль), количество вещества v в молях и масса т вещества в граммах или килограммах.
8
Зная химическую формулу того или иного газа, можно решить некоторые практические задачи, возникающие при транспортировке сжиженных газов.
Пример 1. В дек-танке находится 22 т сжиженного этилена (С2Н4). Необходимо определить, достаточно ли на борту груза, для того чтобы продуть три грузовых танка объёмом 5000 м3 каждый, если после продувки температура танков будет составлять 0° С, а давление 1013 миллибар.
Решение.
1.Определяем молекулярную массу этилена:
М= 2 • 12,011 + 4 • 1,0079 = 28,054 г/моль.
2.Рассчитываем плотность паров этилена при нормальных условиях:
ρ= M/V = 28,054 : 22,4 = 1,232 г/л.
3.Находим объём паров груза при нормальных условиях:
22·106 : 1,252= 27544 м3.
Общий объём грузовых танков составляет 15000 м3. Следовательно, на борту достаточно груза, для того чтобы продуть все грузовые танки парами этилена.
Пример 2. Необходимо определить, какое количество пропана (С3Н8) потребуется для продувки грузовых танков общей вместимостью 8000 м3, если температура танков составляет +15° С, а давление паров пропана в танке после окончания продувки не будет превышать 1013 миллибар.
Решение.
1.Определим молярную массу пропана С3Н8
М= 3 • 12,011 + 8 • 1,0079 = 44,1 г/моль.
2.Определим плотность паров пропана после продувки танков:
ρ= М : v = 44,1 : 23,641 = 1,865 кг/м3.
3.Зная плотность паров и объём, определяем общее количество пропана, необходимое для продувки
танка:
m = ρ • v = 1,865 • 8000 = 14920 кг ≈ 15 т.
КЛАССИФИКАЦИЯ УГЛЕВОДОРОДОВ
И природный газ, и нефтяные газы представляют собой сложные смеси органических и неорганических соединений. Промышленные же газы получают путем переработки вышеупомянутых газов. Однако в основе всех промышленных газов лежат углеводороды, которые в соединении с галогенами (фтор, хлор, бром, йод), кислородом, азотом и т. п. дают весь спектр промышленных газов.
Органическая химия — это наука, изучающая соединения углерода. Углеводороды — простейшие по составу органические соединения, в которых содержатся атомы лишь двух элементов — углерода и водорода.
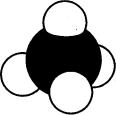
Сырая нефть, например, представляет собой смесь огромного числа углеводородов. Простейшая форма углеводородов — это метан, состоящий из одного атома углерода и четырех атомов водорода (рис. 3).
Во всех органических соединениях атом углерода является четырехвалентным.
Общая формула углеводородов Сm, Нn, где m и n — целые числа.
В настоящее время насчитывается около 5 миллионов органических соединений, тем не менее ежегодно открывают или синтезируют примерно 200
тысяч новых органических соединений. И каждое соединение должно быть Рис 3. Молекула метана названо таким образом, чтобы в его названии отражалось строение вещества.
Поэтому уже в 1892 году в Женеве на Международном конгрессе были заложены основы номенклатуры органических соединений. Сейчас действуют Правила Международного союза чистой и прикладной химии (UIPAC). В соответствии с этими Правилами можно составлять специализированные коды перевозимых газов, которыми пользуются в настоящее время все перевозчики.
Для классификации углеводородов по типам в молекуле органического соединения выделяют углеродный скелет, т. е. тип взаимодействия атомов углерода между собой, в функциональные
9
группы, т. е. группы элементов, определяющие основные физические и химические свойства веществ.
Ряд сходных по строению органических соединений, обладающих близкими химическими свойствами, в которых отдельные члены ряда отличаются друг от друга лишь количеством в них групп —СН2—, называется гомологическим. Свойства органического соединения в основном определяются составом его функциональной группы (наиболее легко изменяющейся и вступающей в реакции частью молекулы). Это и дает возможность классифицировать органические соединения по гомологическим рядам или же классам органических соединений. Для любого гомологического ряда может быть выведена формула, отображающая соотношение атомов углерода и водорода у членов этого ряда.
Для того чтобы легче разобраться с разновидностями углеводородов, рассмотрим классы углеводородов в зависимости от сложности их состава. Такими классами (гомологическими рядами) являются:
•алканы (парафины) — ряд метана,
•алкены (олефины) — ряд этилена,
•алкадиены (диеновые углеводороды),
•алкины — ряд ацетилена,
•циклоалканы (циклопарафины),
•ароматические углеводороды ряда бензола (арены).
Алканы — предельные углеводороды ряда метана. Все названия предельных углеводородов оканчиваются суффиксом aн. Простейшими представителями таких органических соединений являются:
•метан
•этан
•пропан
•бутан
•изобутан
С увеличением числа атомов углерода в молекуле значительно меняются плотность вещества и его свойства. Если, например, молекулы, содержащие от 1 до 4 атомов углерода, являются газами, то вещества, молекулы которых содержат от 5 до 17 атомов углерода, — уже жидкости, а молекулы, в которых содержание углерода более 17 атомов, представляют собой твердые вещества.
Начиная с молекул углеводородов, в которых содержится 4 атома углерода и более, меняется пространственная структура молекул, т. е. взаимное расположение атомов углерода. При этом изменяются все свойства веществ.
| Вещества, имеющие одинаковый состав (одинаковую молекулярную формулу), но разное пространственное строение молекул, называются ИЗОМЕРАМИ.
Бутан, состоящий из 4 атомов углерода и 10 атомов водорода, имеет 2 изомера, а октан, состоящий из 8 атомов углерода и 18 атомов водорода, имеет уже 18 изомеров. Изомеры отличаются друг от друга температурой кипения, плавления, температурой воспламенения, вязкостью и пр., т. е. физическими свойствами.
Отличительная особенность алканов — это то, что все четыре валентные связи углерода одинарные, следствием этого является инертность таких углеводородов в обычных условиях.
Углеводороды только с одинарными связями между атомами углерода называются насыщенными, или предельными.
Общая химическая формула алканов имеет вид
СnН2n+2 , где n — Целое число.
Алканы не взаимодействуют между собой и не растворяются в воде. При высокой температуре и под действием ультрафиолетового излучения они вступают в реакцию с хлором и бромом с образованием галогенных углеводородов.
Хлоропроизводные метана широко используются в промышленности. Хлорметан — газ, который легко сжижается и при последующем испарении поглощает значительное количество теплоты. Этот газ получил широкое применение в холодильных установках.
Алкены. Следующей важной группой углеводородов, которые не встречаются в природе в свободном состоянии, но могут быть получены из нефти в процессе крекинга, являются алкены. Все названия непредельных углеводородов ряда этилена оканчиваются суффиксом ен.

10
|Алкенами называют непредельные углеводороды, которые содержат одну двойную связь меяду атомами углерода, т. е. количество атомов водорода в составе непредельных углеводородов всегда меньше, чем в предельных.
Общая формула алкенов СnН2n, где n — целое число. Простейший из алкенов — этилен (этен):
Двойная связь между атомами углерода непрочная, поэтому алкены химически более активны, чем алканы. Как и алканы, алкены образуют целый ряд изомеров, причем такие изомеры отличаются как структурой молекулы, так и расположением двойной связи
между атомами углерода, а также пространственным расположением атомов элементов. Из-за наличия двойных связей алкены могут присоединять еще один атом водорода и поэтому могут вступать в реакцию с алканами.
| Углеводороды, содержащие одну или несколько двойных или тройных связей между б атомами углерода, называются непредельными, или ненасыщенными.
Алкадиеиы также являются ненасыщенными углеводородами и содержат в составе молекулы две двойные связи между атомами углерода. Названия диеновых углеводородов образуются от соответствующих названий предельных углеводородов с суффиксом диен. Общая формула диеновых углеводородов СnHn+2.
Так же как и все остальные углеводороды, алкадиены образуют изомеры, начиная с 5-го атома углерода. Изомеры, образующиеся при этом, различаются по скелетному расположению атомов углерода, расположению двойных связей и ориентации элементов молекулы в пространстве. Простейшим представителем диеновых углеводородов является бутадиен: С4Н6, структура которого имеет вид
Большинство алкадиенов используются как сырье для получения синтетических пластмасс, в частности, бутадиен — для получения синтетического каучука.
Алкины, или, как их еще называют, ацетиленовые углеводороды также являются непредельными углеводородами и содержат в структурной формуле молекул одну тройную связь между атомами углерода.
Все названия непредельных углеводородов ряда ацетилена оканчиваются суффиксом ин. Общая формула для алкинов СnН2n-2, т. е. точно такая же, как и для алкадиенов.
Простейшими представителями этой группы являются
ацетилен (этан) СН ≡ СН и
пропин СНз – С ≡ СН
Характерными реакциями являются реакции присоединения, окисления и полимеризации. При взаимодействии ацетилена с соляной кислотой (НСl) образуется винилхлоридмономер (VCM), который может полимеризовываться в поливинилхлорид. Данный продукт широко используется для получения пластмасс.
