
лекции термодинамика и теплопередача
.pdf
Теплоемкостьгазов
Отношение количества теплоты Q, полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела dT , на-
зывается теплоемкостью тела в данном процессе:
C Q/ dT .
Обычно теплоемкость относят к единице количества вещества и в зависимости
от выбранной единицы различают:
удельную массовую теплоемкость c , отнесенную к 1 кг газа,
Дж/(кг·К); |
|
удельную объемную теплоемкость |
c´, отнесенную к количеству газа, |
содержащегося в 1 м3 объема при нормальных физических условиях, Дж/(м3·К); |
|
удельную мольную теплоемкость |
c, отнесенную к одномукиломолю, |
Дж/(кмоль·К). |
|
Зависимость между удельными теплоемкостями устанавливается очевидными
соотношениями: c с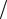 ; c c н
; c c н
Здесь н — плотность газа при нормальных условиях.
Изменение температуры тела при одном и том же количестве сообщаемой теп-
лоты зависит от характера происходящего при этом процесса, поэтому теплоемкость является функцией процесса. Это означает, что одно и то же рабочее тело в зависи-
мости от процесса требует для своего нагревания на 1 К различного количества теп-
лоты. Численно величина с изменяется в пределах от +∞ до -∞.
В термодинамических расчетах большое значение имеют:
теплоемкость при постоянном давлении
cp qp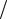 dT ,
dT ,
равная отношению количества теплоты qp , сообщенной телу в процессе при по-
стоянном давлении, к изменению температуры тела dT |
|
теплоемкость при постоянном объеме |
|
cv qv dT , |
(1.5) |
|
11 |

равная отношению количества теплоты , подведенной к телу в процессе при по-
стоянном объеме, к изменению температуры тела .
В соответствии с первым законом термодинамики для закрытых систем, в ко-
торых протекают равновесные процессы q (du pdv).
В процессе v=const теплота, сообщаемая газу, идет лишь на изменение его внутренней энергии, тогда как в процессе р = const теплота расходуется и на увели-
чение внутренней энергии и на совершение работы против внешних сил. Поэтому ср
больше сv на величину этой работы.
Обычно теплоемкости определяются экспериментально, но для многих ве-
ществ их можно рассчитать методами статистической физики.
Числовое значение теплоемкости идеального газа позволяет найти классиче-
ская теория теплоемкости, основанная на теореме о равномерном распределении энергии по степеням свободы молекул. Согласно этой теореме внутренняя энергия идеального газа прямо пропорциональна числу степеней свободы молекул и энергии kТ/2, приходящейся на одну степень свободы. Для 1 моля газа
U i N0kT i RT ,
2 2
где Nо — число Авогадро; i — число степеней свободы (число независимых
координат, которые нужно задать для того, чтобы полностью определить положе-
ние молекулы в пространстве) .
Молекула одноатомного газа имеет три степени свободы соответственно трем составляющим в направлении координатных осей, на которые может быть разложено поступательное движение. Молекула двухатомного газа имеет пять степеней свобо-
ды, так как помимо поступательного движения она может вращаться около двух осей, перпендикулярных линии, соединяющей атомы (энергия вращения вокруг оси,
соединяющей атомы, равна нулю, если атомы считать точками). Молекула трехатом-
ного и вообще многоатомного газа имеет шесть степеней свободы: три поступа-
тельных и три вращательных.
12
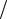
Поскольку для идеального газа cv dU |
dT |
1 |
i R, то мольные теплоемко- |
|
|||
|
2 |
|
|
сти одно-, двух- и многоатомных газов равны соответственно:
cv |
3 |
R 12,5 |
кДж |
; cv |
5 |
R 20,8 |
кДж |
; cv |
6 |
R 24,9 |
кДж |
. |
2 |
|
кмольК |
2 |
|
кмольК |
2 |
|
кмольК |
||||
Результаты классической теории теплоемкости достаточно хорошо согласуются с экспериментальными данными в области комнатных температур (табл. 1.1), однако основной вывод о независимости от температуры эксперимент не подтверждает. Рас-
хождения, особенно существенные в области низких и достаточно высоких темпера-
тур, связаны с квантовым поведением молекул и находят объяснения в рамках кван-
товой теории теплоемкости.
Теплоемкость некоторых газов при t = 0°С в идеально-газовом состоянии Таблица 1.1
|
Число |
Мольная |
|
|
|
теплоемкость, |
|
||
Газ |
степеней |
|
||
|
k=ср /сv |
|||
|
свободы |
|
||
|
кДж/кмольК |
|
||
|
|
|
||
|
|
|
|
|
Гелий Не |
3 |
12,60 |
1,660 |
|
|
|
|
|
|
Аргон Аг |
3 |
12,48 |
1,660 |
|
|
|
|
|
|
Кислород 02 |
5 |
20,96 |
1,397 |
|
|
|
|
|
|
Водород Н2 |
5 |
20,30 |
1,410 |
|
|
|
|
|
|
Азот М2 |
5 |
20,80 |
1,400 |
|
|
|
|
|
|
Метан СН4 |
6 |
26,42 |
1,315 |
|
|
|
|
|
|
Аммиак ЫН3 |
6 |
26,67 |
1,313 |
|
|
|
|
|
|
Диоксид угле- |
6 |
27,55 |
1,302 |
|
рода СО2 |
||||
|
|
|
Эта теория устанавливает, прежде всего, несправедливость теоремы о равно-
мерном распределении энергии по степени свободы в области низких и высоких тем-
ператур. С уменьшением температуры газа происходит «вымораживание» числа сте-
пеней свободы молекулы. Так, для двухатомной молекулы происходит «выморажи-
вание» вращательных степеней свободы и она вместо пяти имеет три степени свободы,
а следовательно, и меньшую внутреннюю энергию и теплоемкость. С увеличением температуры у многоатомных молекул происходит возбуждение внутренних степеней
13

свободы за счет возникновения колебательного движения атомов молекулы (молеку-
ла становится осциллятором). Это приводит к увеличению внутренней энергии, а
следовательно, и теплоемкости с ростом температуры.
Теплоемкость реального газа зависит от давления, правда, очень слабо.
Поскольку теплоемкость реального газа зависит от температуры, в термоди-
намике различают истинную и среднюю теплоемкости.
Средней теплоемкостью сср данного процесса в интервале температур от t1 до t2 называется отношение количества теплоты, сообщаемой газу, к разности конечной и начальной температур:
cср |
t2 q (t2 t1) |
|
t1 |
Выражение |
|
|
c дq dT * |
определяет теплоемкость при |
данной температуре или так назы- |
ваемую истинную теплоемкость. Из * следует, что
t2 q cdt
t1
поэтому
t2
cср tt12 cdt (t2 t1). t1
(t2 t1). t1
Для практических расчетов теплоемкости всех веществ сводят в таблицы,
причем с целью сокращения объема таблиц средние теплоемкости приводят в них для интервала температур от 0 до t.
14
Лекция 2
Смеси идеальныхгазов
Все зависимости, полученные выше для идеальных газов, справедливы и для их смесей, если в них подставлять газовую постоянную, молекулярную массу и теп-
лоемкость смеси.
Закон Дальтона. В инженерной практике часто приходится иметь дело с газо-
образными веществами, близкими по свойствам к идеальным газам и пред-
ставляющими собой механическую смесь отдельных компонентов различных газов,
химически не реагирующих между собой. Это так называемые газовые смеси. В
качестве примера можно назвать продукты сгорания топлива в двигателях внутрен-
него сгорания, топках печей и паровых котлов, влажный воздух в сушильных уста-
новках и т. п.
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давле-
ний всех входящих в нее компонентов:
n
p pi
1
Парциальное давление pi — давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем смеси.
Способы задания смеси. Состав газовой смеси может быть задан массовыми,
объемными или мольными долями.
Массовой долей называется отношение массы отдельного компонента Мi, к
массе смеси М:
|
gi Mi M . |
n |
n |
Очевидно, что M Mi |
и gi 1. |
1 |
1 |
Массовые доли часто задаются в процентах. Например, для сухого воздуха
gN2 77%; gO2 23%.
Объемная доля представляет собой отношение приведенного объема газа
V, к полному объему смеси V: r Vi V .
V .
15
Пр иведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси.
Для вычисления приведенного объема запишем два уравнения состояния i-го компонента:
piV MiRiT ; |
(2.1) |
pVi MiRiT .
Первое уравнение относится к состоянию компонента газа в Смеси, когда он имеет парциальное давление pi и занимает полный объем смеси, а второе уравнение
— к приведенному состоянию, когда давление и температура компонента равны, как и для смеси, р и Т. Из уравнений следует, что
Vi Vpi |
p. |
|
|
(2.2) |
Просуммировав соотношение (2.2) для всех компонентов смеси, |
получим с |
|||
n |
|
n |
|
|
учетом закона Дальтона Vi V ,откуда |
ri 1. |
Объемные |
доли также |
|
1 |
|
1 |
|
|
часто задаются в процентах. Для воздуха ro2 |
21%,rN2 |
79%. |
|
|
Иногда бывает удобнее задать состав смеси мольными долями. Мольной до-
лей называется отношение количества молей Ni рассматриваемого компонента к об-
щему количеству молей смеси N.
Пусть газовая смесь состоит из N1 молей первого компонента, N2 молей второго
n
компонента и т. д. Число молей смеси N Ni , а мольная доля компонента
1
будет равна Ni N.
N.
Всоответствии с законом Авогадро объемы моля любого газа при одинаковых
ри Т, в частности при температуре и давлении смеси, в идеально газовом состоянии одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля V на число молей этого компонента, т. е. Vi V Ni а
объем смеси — по формуле V V N . Тогда Vi  V ri Ni
V ri Ni  N , и, следовательно,
N , и, следовательно,
задание смесильных газов мольными долями равно заданию ее объемными долями.
16

Газовая постоянная смеси газов. Просуммировав уравнения (2.1) для всех
n |
n |
n |
компонентов смеси, получим V giRi giMRiT . Учитывая p pi , можно
1 |
1 |
1 |
записать |
|
|
|
pV MRcмT , |
(2.3) |
где |
|
|
|
n |
|
Rсм 8314 gi мi . |
(2.4) |
|
|
1 |
|
Из уравнения (2.3) следует, что смесь идеальных газов также подчиняется уравнению Клапейрона. Поскольку Ri 8314 i то из (2.4) следует, что газовая постоянная смеси [Дж/(кг-К)] имеет вид
i то из (2.4) следует, что газовая постоянная смеси [Дж/(кг-К)] имеет вид
n |
|
|
Rсм 8314 gi |
i |
(2.5) |
1 |
|
|
Кажущаяся молекулярная масса смеси. Выразим формально газовую по-
стоянную смеси R, введя кажущуюся окулярную массу смеси см :
Rсм 8314/ cм |
(2.6) |
Сравнивая правые части соотношений (2.5) и (2.6), найдем
см |
|
1 |
. |
n |
|
gi |
i |
1 |
|
Из определения массовых долей следует, что
gi Mi  M iNi
M iNi  ( смN) iri
( смN) iri 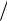 см
см
Просуммировав это соотношение для всех компонентов и учитывая, что
n
gi 1, получим выражение для кажущейся молекулярной и массы смеси, задан-
1
ной объемными долями:
|
n |
|
см |
ri i . |
(2.7) |
|
1 |
|
17

Соотношение между объемными и массовыми долями. Учитывая (2.7), по-
|
n |
|
|
|
|
лучаем gi iri |
ri i . |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
n |
|
|
Поскольку |
ri Ni |
N Ni |
Ni , то |
|
|
|
|
|
1 |
|
|
|
|
|
ri |
Mi |
i |
|
|
|
n |
|
|
|
|
|
|
Mi |
i |
|
|
|
|
1 |
|
Разделив числитель и знаменатель этой формулы на массу смеси М, получим
r |
gi |
i |
. |
n |
|
||
i |
|
|
|
|
gi |
i |
|
|
1 |
|
|
Аналитическое выражение первого закона термодинамики
Первый закон термодинамики представляет собой частный случай всеобщего закона сохранения и превращения энергии применительно к тепловым явлениям.
Закон сохранения и превращения энергии является фундаментальным законом природы, который получен на основе обобщения огромного количества эксперимен-
тальных данных и применим ко всем явлениям природы. Он утверждает, что энер-
гия не исчезает и не возникает вновь, она лишь переходит из одной формы в другую,
причем убыль энергии одного вида дает эквивалентное количество энергии другого вида.
В числе первых ученых, утверждавших принцип сохранения материи и энергии,
был наш соотечественник М. В. Ломоносов (1711 — 1765 гг.).
Пусть некоторому рабочему телу с объемом V и массой М, имеющему тем-
пературу Т и давление р, сообщается извне бесконечно малое количество теплоты
дQ. В результате подвода теплоты тело нагревается на dT и увеличивается в объеме
на dV.
Повышение температуры тела свидетельствует об увеличении кинетической энергии его частиц. Увеличение объема тела приводит к изменению потенциальной энергии частиц. В результате внутренняя энергия тела увеличивается на dU. По-
18
скольку рабочее тело окружено средой, которая оказывает на него давление, то при расширении оно производит механическую работу дL против сил внешнего давле-
ния. Так как никаких других изменений в системе не происходит, то по закону со-
хранения энергии
δQ dU δL |
(2.8) |
т. е. теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы.
Полученное уравнение является математическим выражением первого закона термодинамики. Каждый из трех членов этого соотношения может быть поло-
жительным, отрицательным или равным нулю. Рассмотрим некоторые частные слу-
чаи.
1. δQ 0— теплообмен системы с окружающей средой отсутствует, т. е. теп-
лота к системе не подводится и от нее не отводится. Процесс без теплообмена на-
зывается адиабатным. Для него уравнение (2.8) принимает вид:
δL dU .
Следовательно, работа расширения, совершаемая системой в адиабатном про-
цессе, равна уменьшению внутренней энергии данной системы. При адиабатном сжатии рабочего тела затрачиваемая извне работа целиком идет на увеличение внут-
ренней энергии системы.
2. дL 0 — при этом объем тела не изменяется, dV=0 . Такой процесс на-
зывается изохорным, для него
δQ dU ,
т. е. количество теплоты, подведенное к системе при постоянном объеме, равно
увеличению внутренней энергии данной системы.
3. dU=0 – внутренняя энергия системы не изменяется и
δQ δL,
т.е. сообщаемая системе теплота превращается в эквивалентную ей внешнюю
работу. |
|
Для системы, содержащей 1 кг рабочего тела |
|
δq du δl. |
(2.9) |
19
Проинтегрировав уравнения (2.8) и (2.9) для некоторого процесса, получим вы-
ражение первого закона термодинамики в интегральной форме:
Q U L; q u l .
Внутренняя энергия
Внутренняя энергия системы включает в себя:
кинетическую энергию поступательного, вращательного и колебательного дви-
жения частиц;
потенциальную энергию взаимодействия частиц;
энергию электронных оболочек атомов;
внутриядерную энергию.
В большинстве теплоэнергетических процессов две последние составляющие остаются неизменными. Поэтому в дальнейшем под внутренней энергией будем понимать энергию хаотического движения молекул и атомов, включающую энергию поступательного, вращательного и колебательного движений как молекулярного,
так и внутримолекулярного, а также потенциальную энергию сил взаимодействия между молекулами.
Кинетическая энергия молекул является функцией температуры, значение по-
тенциальной энергии зависит от среднего расстояния между молекулами и, следова-
тельно, от занимаемого газом объема V, т. е. является функцией V. Поэтому внут-
ренняя энергия U есть функция состояния тела.
Для сложной системы она определяется суммой энергий отдельных частей, т. е.
обладает свойством аддитивности. Величина и=U/М, называемая удельной внутренней энергией (Дж/кг), представляет собой внутреннюю энергию единицы массы вещества.
В дальнейшем для краткости будем называть величину и просто внутренней энергией. Поскольку внутренняя энергия есть функция состояния тела, то она может быть представлена в виде функции двух любых независимых параметров, опреде-
ляющих это состояние:
u p,v ; |
u p,T ; |
u v,T . |
20
