
- •Составители:
- •Т.Б.Мошкова, доц., канд. С.-х. Наук
- •Общие методические указания
- •Обязательный минимум содержания дисциплины
- •Специальные вопросы химии
- •Контрольное задание 1
- •Моль. Эквиваленты и молярные массы
- •Эквивалентов простых и сложных веществ
- •Закон эквивалентов
- •Строение атома
- •Периодическая система элементов д.И.Менделеева
- •Химическая связь и строение молекул
- •Элементы химической термодинамики Энергетика химических процессов
- •Кинетика химических процессов Химическое равновесие
- •Способы выражения концентрации растворов
- •Общие свойства растворов
- •Электролитическая диссоциация Реакции в растворах электролитов
- •Гидролиз солей
- •Контрольное задание 2 Окислительно-восстановительные реакции
- •Электродные потенциалы и электродвижущие силы
- •Электролиз расплавов и растворов
- •Коррозия металлов
- •Комплексные соединения
- •Жесткость воды и методы ее устранения
- •Органические соединения Полимеры
- •Химические элементы Их соединения и аналитические реакции
- •Теоретические основы аналитической химии
- •Задания
- •Качественный анализ
- •Количественный анализ
- •Задания
- •Органические соединения
Строение атома
Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. Движение электрона в атоме носит вероятностно-волновой характер.
Пример 1.Что такое квантовые числа? Какие значения они могут принимать?
Решение.Околоядерное пространство, в котором с наибольшей вероятностью (90-95%) находится электрон, называется атомной орбиталью. Атомная орбиталь характеризуется квантовыми числами (n,l,m).
n– главное квантовое число, характеризует общую энергию электрона - энергетический уровень и размер орбитали. Принимает значения целых чисел от 1 до. Чем большеn, тем больше энергия электрона и размер орбитали.
l– орбитальное квантовое число, характеризует энергию электронов на подуровнях данного уровня (энергетический подуровень) и форму орбитали. Принимает все целочисленные значения от 0 до (n- 1). Например, при n = 4, орбитальное квантовое число принимает значения 0, 1, 2, 3. Чем больше орбитальное квантовое числоlпри данном n, тем больше энергия электрона на подуровне. Число подуровней в каждом энергетическом уровне равно значению его главного квантового числа (табл. 1). Обычно подуровни обозначаются буквами:
l0 1 2 3
обозначение подуровня spdf
Атомные орбитали, для которых l= 0, 1, 2, 3, соответственно называютсяs-,p-,d-,f–орбиталями, а электроны, занимающие эти орбитали, называются s-, p -, d -, f-электронами.
m– магнитное квантовое число, характеризует магнитный момент количества движения и пространственную ориентацию атомных орбиталей. Принимает целочисленные значения от –lдо +l, включая 0. Каждому значениюmпри данномlсоответствует определенная ориентация орбитали в пространстве: так, дляs-орбитали (l= 0) возможно одно значениеm(m= 0) и одно положение в пространстве; дляp-орбиталей (l= 1) возможно три значенияm(-1, 0, +1) и три ориентации по координатным осям (х,у,z);d-орбиталям соответствует пять, аf-орбиталям семь различных ориентаций в пространстве. Число возможных значений магнитного квантового числа при заданномlравно (2l+1) и определяет количество орбиталей в подуровне. Следовательно, s - подуровень состоит из одной орбитали, р – из трех, d – из пяти, f – из семи орбиталей.
Графическое изображение орбиталей в подуровнях s,p,d
l=3






 l=2
l=2




 l=1
l=1



 l=0
f
l=0
f
p d
s
Состояние электрона в атоме описывает также спиновое квантовое число ms, которое характеризует собственный момент количества движения электрона (вращение вокруг своей оси – спин электрона) и принимает два значения +1/2 или –1/2 (ms = 1/2), обозначаемых в электронно-графических формулах стрелкой или .
Распределение электронов в многоэлектронных атомах основано на трех положениях: принципе Паули, принципе наименьшей энергии и правиле Хунда.
В
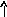
 атоме не может быть двух электронов,
имеющих одинаковый набор всех четырех
квантовых чисел (принцип Паули), поэтому
на атомной орбитали может находиться
не более двух электронов, отличающихся
своими спинами (ms=1/2).
В связи с этим на подуровне может
находиться максимально 2(2l+
1) электронов, а на уровне 2n2электронов.
атоме не может быть двух электронов,
имеющих одинаковый набор всех четырех
квантовых чисел (принцип Паули), поэтому
на атомной орбитали может находиться
не более двух электронов, отличающихся
своими спинами (ms=1/2).
В связи с этим на подуровне может
находиться максимально 2(2l+
1) электронов, а на уровне 2n2электронов.
В таблице 1 приведены значения и обозначения квантовых чисел, а также число электронов на соответствующем уровне и подуровне.
Таблица 1. Максимальное число электронов на атомных энергетических уровнях и подуровнях.
|
Энергетический уровень |
Энергетический подуровень |
Возможные значения магнитного квантового числа m
|
Число орбиталей в подуровне
|
Максимальное число электронов | |
|
На под- уровне |
На уровне 2n2 | ||||
|
К (n=1) |
s (l=0) |
0 |
1 |
2 |
2 1s2 |
|
L (n=2) |
s (l=0) p (l=1) |
0 -1; 0; +1 |
1 3 |
2 6 |
2s2 8 2p6 |
|
М (n=3) |
s (l=0) p (l=1) d (l=2) |
0 -1; 0; +1 -2; -1; 0; +1; +2 |
1 3 5 |
2 6 10 |
3s2 18 3p6 3d10 |
|
N (n=4) |
s (l=0) p (l=1) d (l=2) f (l=3) |
0 -1; 0; +1 -2; -1; 0; +1; +2 -3; -2; -1; 0; +1; +2; +3 |
1 3 5 7 |
2 6 10 14 |
4s2 4p6 32 4d10 4f14 |
Пример 2.Составьте электронные и электронно-графические формулы атомов элементов с порядковыми номерами 4, 16, 22. К какому электронному семейству относится каждый из этих элементов. Какие электроны являются валентными? Постоянную или переменную валентность имеют эти элементы?
Решение.Электронные формулы изображают распределение электронов в атоме по энергетическим уровням и подуровням. При записи электронной формулы вначале ставится номер уровня, затем буквенное обозначение подуровня, в виде степени указывается число электронов, имеющихся на данном подуровне. Число электронов в атоме элемента равно его порядковому номеру в периодической системе элементов Д.И.Менделеева. Число уровней, на которых располагаются электроны данного элемента, соответствует номеру периода.
Последовательность размещения электронов по уровням и подуровням атома должна соответствовать наименьшей энергии электрона и атома в целом. В этом случае устойчивость электронной системы будет максимальной и связь электронов с ядром – наиболее прочной. Увеличение энергии и соответственно заполнение энергетических уровней и подуровней происходит в порядке возрастания суммы значений квантовых чисел (n+l), а при равной сумме значений (n+l) сначала заполняется подуровень с меньшим значениемn(правило Клечковского), что соответствует для многоэлектронного атома следующей последовательности:
1s 2s 2p 3s 3p4s 3d 4p 5s 4d 5p 6s
(5d1)4f5d6p7s(6d1)5f6d7p
Элемент с порядковым номером 4 – бериллий, расположен во втором периоде, следовательно, 4 электрона расположены на двух энергетических уровнях. Электронная формула атома бериллия 4Be1s22s2.
Элемент с порядковым номером 16 – сера, расположен в третьем периоде, следовательно, 16 электронов расположены на трех энергетических уровнях. Электронная формула атома серы 16S1s22s22p63s23p4.
Элемент с порядковым номером 22 – титан, расположен в четвертом периоде, следовательно, 22 электрона расположены на четырех энергетических уровнях. Заполнение электронами энергетических подуровней в атоме титана в соответствии с принципом наименьшей энергии:
22Ti1s22s22p63s23p64s23d2 . После 3p-подуровня заполняется 4sподуровень (n+l= 4+0 = 4), затем 3dподуровень (n+l= 3+2 = 5). При составлении электронной формулы возможна такая запись: сначала последовательно записать все состояния электронов с меньшим значениемn, (в атоме титана сn= 3), а затем уже переходить к состояниям с более высоким значениемn(в атоме титанаn=4). Электронная формула атома титана
22Ti1s22s22p63s23p63d24s2.
Э


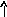

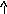
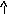 лектронно-графические
формулы отражают распределение электронов
по атомным орбиталям (квантовым ячейкам),
изображаемых в виде клеточки или
черты – , в которых один неспаренный
электрон обозначается или ()
, а два спаренных электрона (электронная
пара)
лектронно-графические
формулы отражают распределение электронов
по атомным орбиталям (квантовым ячейкам),
изображаемых в виде клеточки или
черты – , в которых один неспаренный
электрон обозначается или ()
, а два спаренных электрона (электронная
пара)
(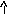
 или). Распределение
электронов по орбиталям на подуровне
подчиняется правилу Хунда: электроны
заполняют максимальное число свободных
орбиталей, чтобы число неспаренных
электронов было наибольшим, т.е. сначала
по одному с одинаковыми спинами, а затем
по второму электрону с противоположными
спинами.
или). Распределение
электронов по орбиталям на подуровне
подчиняется правилу Хунда: электроны
заполняют максимальное число свободных
орбиталей, чтобы число неспаренных
электронов было наибольшим, т.е. сначала
по одному с одинаковыми спинами, а затем
по второму электрону с противоположными
спинами.
Электронно-графические формулы атомов бериллия, серы и титана:
р


 s
s
4
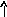
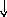 Be
n =2
Be
n =2



n=1
d




 p
p



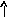
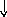

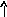 s
s


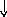 n =3
n =3



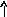
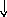
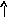

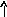
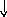
1
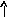
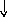 6S
n =2
6S
n =2

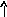

n=1
f











 d
d


 s P
s P

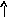
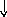 n = 4
n = 4








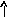
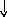
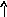

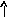
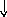
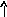


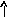
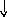 n = 3
n = 3
2


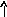
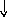
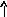
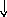
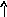
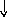 2Ti
2Ti

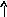
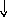 n= 2
n= 2


 n= 1
n= 1
В зависимости от того, на какой энергетический подуровень в атоме поступает последний электрон, элементы делятся на s-,p-,d-,f- элементы (электронные семейства). При этомs-элементы составляют главные подгруппыI-IIгрупп периодической системы – металлы, а также Н и Не;
р-элементы – металлы и неметаллы, составляют главные подгруппы III–VIIIгрупп;d-элементы - металлы составляют побочные подгруппыI–VIIIгрупп; кf-элементам относятся лантаноиды и актиноиды (металлы).
Бериллий находится во второй группе, главной подгруппе, последний электрон занимает s– подуровень. Бериллий –s– элемент. Сера находится в четвертой группе, главной подгруппе, последний электрон занимает р-подуровень. Сера – р-элемент. Титан находится в четвертой группе, побочной подгруппе, последний электрон в соответствии с правилом Клечковского занимаетd-подуровень. Титан –d-элемент.
Номер группы указывает максимальное число валентных электронов, которые могут участвовать в образовании химических связей. Валентность элемента определяется числом неспаренных электронов в основном (нормальном) и возбужденном состоянии атома. Основное состояние атома (состояние с минимальной энергией) характеризует электронная конфигурация атома, соответствующая положению элемента в периодической системе. Возбужденное состояние – это более высокое энергетическое состояние атома с иным распределением электронов в пределах валентного уровня. Источником энергии возбуждения может быть энергия тепла, света, энергия, выделяющая при образовании новых веществ в процессе химической реакции.
Для s- и р-элементов валентными могут быть электроны внешнего энергетического уровня; дляd-элементов – электроны внешнего уровня и неспаренныеd-электроны предвнешнего уровня.
Бериллий – s– элемент. Валентными являютсяs– электроны внешнего уровня: 2s2.
Сера – р-элемент. Валентными электронами являются sи р электроны внешнего уровня: 3s23р4.
Титан – d-элемент. Валентные электроны: 3d24s2.
В основном состоянии у атома бериллия нет неспаренных электронов, валентность его равна нулю (В=0). Однако у бериллия имеется три свободных орбитали 2p- подуровня. При возбуждении атома происходит распаривание электронов внешнего уровня и один из 2s– электронов переходит на свободную 2pорбиталь. Число неспаренных электронов становится равным двум. Бериллий в соединениях проявляет постоянную валентность равную 2.
Основное состояние Возбужденное состояние
4Be…2s2 4Be …2s12p1
р p








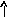 ss
ss



 n= 2
n= 2
В основном состоянии атом серы содержит два неспаренных электрона и ее валентность равна двум. Однако у серы есть пять свободных орбиталей 3d – подуровня, за счет этого число неспаренных электронов, а, следовательно, и валентность может увеличиваться. При возбуждении атома спаренные электроны внешнего уровня могут распариваться и переходить на свободные орбитали другого подуровня в пределах того же (валентного) уровня. При возбуждении атома серы происходит переход 3р – электрона (первое возбужденное состояние S), затем 3s- электрона на свободныеd-орбитали (второе возбужденное состояниеS*). Число неспаренных электронов становится равным соответственно 4 и 6. Сера проявляет переменную валентность равную 2, 4, 6.
Основное состояние Возбужденное состояние
16S…3s23p416S*…3s23p33d1
pd







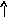
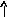
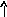
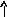
 s
s

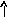
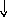

p d










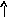
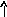 s
p d
s
p d

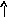
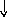






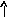
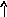
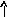




 s
s

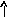
16S* … 3s13p33d2
В основном состоянии атом титана содержит 2 неспаренных электрона и его валентность равна двум. При возбуждении спаренные 4s- электроны внешнего уровня распариваются и один 4s- электрон переходит на 4р - подуровень, число неспаренных электронов становится равным четырем. Титан проявляет переменную валентность равную 2 и 4.
Основное состояние Возбужденное состояние
22Ti…3s23p63d24s2 22Ti* ...3s23p63d24s14p1
p d p d

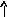
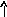





 s
s
s
s
 n
= 4
n
= 4
n = 4
p d p d
















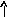



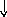
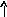
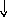
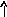
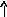


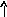 s
s
s
s


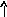
 n
= 3
n
= 3
n = 3
Пример 3. Охарактеризуйте с помощью квантовых чиселn,l,m,msвалентные электроны атома марганца.
Решение. Электронная формула атома марганца:
25Mn1s22s22p63s23p63d54s2. Марганец –dэлемент, валентными электронами являютсяs-электроны внешнего и неспаренныеd-электроны предвнешнего уровней. Электронная и электронно-графическая формулы валентных электронов атома марганца в основном состоянии:
25Mn…3d54s2
s
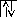 dn=4
dn=4
n =3
=3
а) валентные dэлектроны (3d5) находятся на третьем энергетическом уровне, что соответствует значению главного квантового числа, т.е.n=3. Буквенное обозначение подуровняdсоответствует значению орбитального квантового числа равного двум, т.е.l=2. Приl=2 магнитное квантовое число для пяти электронов занимающихdорбиталь принимает значения -2, -1, 0, +1, +2. Так как каждыйd– электрон расположен в отдельной квантовой ячейке и спины у всех электронов одинаковы (), то значения спинового квантового числа для всех электронов одинаково и равноms= +1/2
 d
d
n=3
l=2
m = -2 m = -1 m=0 m=+1 m=+2
ms=+1/2 ms=+1/2 ms=+1/2 ms=+1/2 ms=+1/2
б) валентные sэлектроны (4s2) находятся на четвертом энергетическом уровне, что соответствует значению главного квантового числа, т.е.n=4. Буквенное обозначение подуровняsсоответствует значению орбитального квантового числа, равного нулю, т.е.l=0. Приl=0 магнитное квантовое число для обоих электронов, заполняющихsорбиталь, равно нулю, т.е.m=0. Значение спинового квантового числа различны (ms=+1/2, -1/2), так как электроны наsорбитали имеют различные спины ().
s
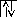 n=4l=0,m=0,ms=+1/2,ms=
-1/2
n=4l=0,m=0,ms=+1/2,ms=
-1/2
ЗАДАНИЯ
21.Напишите электронные и электронно-графические формулы атомов элементов с порядковыми номерами 5, 20, 43. Укажите период, группу, подгруппу, в которых находятся элементы. К какому электронному семейству относится каждый из них? Какие электроны являются валентными?
22.Напишите электронные и электронно-графические формулы атомов фосфора, ванадия, стронция. В каком периоде, группе, подгруппе находятся элементы? К какому электронному семейству относится каждый из этих элементов? Какие электроны являются валентными?
23.Какие энергетические уровни не имеют: а) p-, б)d-, в)f- подуровней? Возможно ли отсутствиеs-подуровня? Приведите по одному примеру
p-,d-,f- элементов. Составьте электронные и электронно-графические формулы атомов этих элементов. В каком периоде, группе, подгруппе они находятся?
24.Напишите электронные и электронно-графические формулы атомов калия, марганца, селена в основном и возбужденном состоянии. Укажите период, группу, подгруппу в которых находятся элементы. К какому электронному семейству относится каждый из них? Какие электроны являются валентными? Какой подуровень в атоме селена заполняется раньше: а) 3dили 4s; б) 3dили 4p. Объясните на основании правил Клечковского.
25.Напишите электронные и электронно-графические формулы атомов элементов с порядковыми номерами: 12, 14, 23. В каком периоде, группе, подгруппе находятся эти элементы? К какому электронному семейству они относятся? Укажите значения квантовых чисел nиl для валентных электронов атомов данных элементов.
26.Напишите электронные и электронно-графические формулы атомов элементов с порядковыми номерами 17, 19, 29 в основном и возбужденном состояниях. В каком периоде, группе, подгруппе они находятся? К какому электронному семейству относится каждый из этих элементов? Какие электроны являются валентными?
27.Напишите электронные и электронно-графические формулы атомов натрия, селена и фтора. В каком периоде, группе, подгруппе находятся эти элементы? К какому электронному семейству относится каждый из них? Какие электроны являются валентными. Объясните, почему селен проявляет переменную валентность, а фтор - постоянную.
28.Напишите электронные и электронно-графические формулы атомов магния, хлора и ванадия. В каком периоде, группе, подгруппе находится каждый из этих элементов? К какому электронному семейству они относятся? Какие электроны являются валентными? Объясните, почему хлор проявляет переменную, а магний - постоянную валентность.
29.Напишите электронные и электронно-графические формулы атомов хрома, селена, рубидия. В каком периоде, группе, подгруппе находится каждый из этих элементов? К какому электронному семейству они относятся? Какие электроны являются валентными? Сформулируйте правило Хунда и, пользуясь этим правилом, распределите электроны по энергетическим ячейкам, соответствующим низшему энергетическому состоянию атомов.
30.Напишите электронные и электронно-графические формулы атомов элементов с порядковыми номерами 11, 15 и 40 в основном и возбужденном состояниях. В каком периоде, группе, подгруппе находится каждый из этих элементов? К какому электронному семейству относится каждый из этих элементов? Какие электроны являются валентными? Охарактеризуйте квантовыми числами валентные электроны фосфора.
31.Напишите электронные и электронно-графические формулы атомов технеция, хлора, фтора в основном и возбужденном состояниях. В каком периоде, группе, подгруппе находится каждый из этих элементов? К какому электронному семейству они относятся? Какие электроны являются валентными? Объясните, почему у элементов одной группы – хлора и фтора разные валентные возможности.
32.Напишите электронные и электронно-графические формулы атомов элементов с порядковыми номерами 12, 26, 35 в основном и возбужденном состоянии. В каком периоде, группе, подгруппе находится каждый из этих элементов? К какому электронному семейству они относятся? Какие электроны являются валентными? Какой подуровень в атоме брома заполняется раньше: а) 3dили 4s; б) 3dили 4p? Объясните на основании правил Клечковского.
33.Какие четыре квантовых числа определяют состояние электрона в атоме? Дайте характеристику этих квантовых чисел. Какие значения может принимать каждое из них? Напишите электронную и электронно-графическую формулу атома мышьяка и охарактеризуйте квантовыми числами его валентные электроны. В каком периоде, группе, подгруппе находится мышьяк, к какому электронному семейству он относится?
34.Сколько и какие значения может принимать магнитное квантовое число mпри орбитальном квантовом числе: а)l= 0; б)l =1; в)l =2; г)l =3? Какие элементы в периодической системе носят названиеs-,p-,d-,f-элементов? Приведите примеры этих элементов и напишите их электронные и электронно-графические формулы. Укажите период, группу, подгруппу, в которых находятся эти элементы.
35.Какой элемент имеет в атоме три электрона, для каждого из которых n=3,l=1? Чему равно для них значение магнитного квантового числа? Должны ли они иметь антипараллельные спины? Напишите электронную и электронно-графическую формулу атома этого элемента. В каком периоде, группе, подгруппе находится этот элемент? К какому электронному семейству он относится? Какие электроны являются валентными?
36.На основании правил Клечковского объясните, какие орбитали заполняются раньше: а) 4sили 3d; б) 5sили 4d? Напишите электронные и электронно-графические формулы атомов элементов с порядковыми номерами 34 и 46, учитывая, что последний, находясь в пятом периоде, на пятом энергетическом уровне не содержит ни одного электрона. Укажите период, группу, подгруппу в которых находится каждый из этих элементов. К какому электронному семейству они относятся?
37.Напишите электронные и электронно-графические формулы атомов элементов с порядковыми номерами 24, 33, 37 в основном и возбужденном состояниях. Укажите, к какому электронному семейству относится каждый из этих элементов. Какие электроны являются валентными?
38.Дайте формулировку принципа Паули и правила Хунда. Пользуясь правилом Хунда, распределите электроны по энергетическим ячейкам, соответствующим низшему энергетическому состоянию, для атомов элементов с порядковыми номерами 14, 23, 37. К какому электронному семейству относится каждый из этих элементов? Какие электроны являются валентными?
39.В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7- или d12-электронов? Почему? Напишите электронные электронно-графические формулы атомов элементов с порядковыми номерами 34 и 40. К какому электронному семейству относится каждый из этих элементов? Какие электроны являются валентными?
40.Напишите электронные и электронно-графические формулы атомов элементов с порядковыми номерами 7,32,42. К какому электронному семейству относится каждый из этих элементов? Какие электроны являются валентными? Охарактеризуйте с помощью квантовых чисел p- электроны атома азота.
