
кванты лекции
.pdf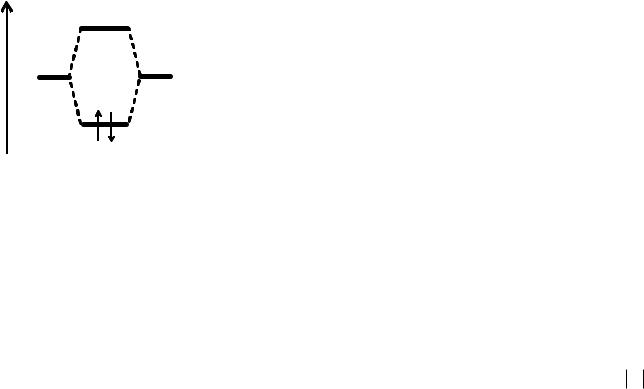
|
∞ |
|
En |
= ∑λk En(k) , |
(96) |
|
k=0 |
|
|
∞ |
|
Ψn |
= ∑λk Ψn(k) , |
(97) |
k =0
где k – порядок возмущения. Энергия нулевого порядка (k = 0) равна сумме энергий одноэлектронных МО. Первый порядок теории возмущений соответствует приближению Хартри – Фока (MP1 = ССП). Часто ряд разложения полной энергии по энергиям различных порядков возмущения обрывают на члене при k = 2 (MP2).
Выражения для энергии Мёллера – Плессета третьего (MP3), четвертого (MP4) и последующих (MP5, MP6 и т.д.) порядков существенно усложняются и требуют больших компьютерных ресурсов. В принципе теория возмущений способна полностью учесть энергию электронной корреляции при использовании поправок вплоть до бесконечного порядка (MP∞). Однако, так же как и в случае FCI, такой метод расчета требует астрономических ресурсов и практически неприменим. В настоящее время чаще всего используют MP2 и MP4. Метод MP2 в типичных случаях обеспечивает 80 – 90%-ный учет корреляционной энергии.
3.3.4. Характеристики молекулярных орбиталей
Существуют три типа МО: связывающие, разрыхляющие и несвязывающие. Электроны на связывающих МО упрочняют связь, а на разрыхляющих как бы дестабилизируют (расшатывают). Молекула является устойчивой лишь в том случае, если число электронов на связывающих орбиталях превышает число электронов на разрыхляющих.
Электроны, находящиеся на несвязывающих МО, участия в образовании химической связи не принимают. В простейшем
Энергия |
S-орбиталь |
S-орбиталь |
случае при образовании двухатомной молекулы |
H2 из s- |
|
|
орбиталей двух атомов Н возникают две двухцентровые МО – |
||
|
|
одна энергетически более выгодная (связывающая), другая |
||
|
|
|
||
|
|
|
менее выгодная (разрыхляющая), чем исходные АО (рис. 11). На |
|
|
|
|
связывающей МО электрон большую часть времени пребывает |
|
|
|
Связывающая МО |
между ядрами (повышается электронная |
плотность), |
|
Рис. 11. Образование МО из |
способствуя их химическому связыванию. На разрыхляющей же |
||
|
МО электрон большую часть времени находится |
за ядрами, |
||
|
|
|
||
s-орбиталей атомов водорода.
вызывая отталкивание ядер друг от друга. При записи МО у разрыхляющей орбитали ставят значок *.
Важнейшей характеристикой МО является ее симметрия (см. гл. 4). В то время как АО имеет один центр – ядро атома, МО, например, в двухатомной молекуле имеет два центра, ядра a и b. Здесь в отличие от атома уже не все направления в пространстве равноценны. Между атомами возникает сильное электрическое поле. Таким образом, направление межъядерной оси – особое направление в пространстве для молекулярного электрона. Симметрия МО относительно этой оси определяет ее главные свойства.
Для классификации состояний электрона в молекуле с осевой симметрией используют абсолютное значение магнитного квантового числа электрона (обозначаемое λ0 = ml ),
определяющее проекцию момента количества движения электрона на межъядерную ось. МО обозначаются строчными греческими буквами:
Квантовое число λI . . . . . . . . . . . . . . . . . . |
0 |
1 |
2 |
Символ МО . . . . . . . . . . . . . . . . . . . . . . . . |
σ |
π |
δ |
Симметрии σ- и π-орбиталей относительно межъядерной оси различны: σ-орбиталь не изменяет знака при отражении в плоскости, проходящей через ось молекулы (рис. 12а), π-орбиталь – изменяет (рис. 12б). В обозначении МО указывается их поведение относительно центра инверсии i. Инверсия относительно центра симметрии состоит в том, что каждая точка молекулы перемещается в центр молекулы, а затем откладывается на равное расстояние с другой
15

стороны. Орбиталь, сохраняющую знак при инверсии, обозначают индексом «g» (gerade – четный), а меняющую – «u» (ungerade – нечетный). Четность и нечетность МО лежат в основе правил отбора разрешенных электронных переходов. Возможны переходы u ↔ g и невозможны переходы u ↔ u и g ↔ g.
а
A
–  +
+
2PX(A)
|
. |
|
р |
B |
з |
а |
|
|
р |
+ |
– |
2P (B) |
с |
я |
|
|
в |
X |
з |
|
. |
AB
– |
+ σ u - |
AB
+  σ g+
σ g+
б
|
|
. |
|
|
р |
|
|
з |
|
|
а |
+ |
+ |
р |
|
||
A – |
– B |
|
|
|
с |
|
|
в |
|
|
я |
2PZ(A) |
2PZ(B) |
з |
. |
AB
+–
–+
 +
+ 
 –
– 
πg -
πu+
A B
Рис. 12. Симметрия σ- и π-орбиталей в двухатомной молекуле относительно межъядерной оси.
Для основного состояния иона H2+ связывающая орбиталь сохраняет знак при инверсии – это σg-орбиталь, разрыхляющая МО меняет знак – это σu*-орбиталь. МО определяется типом АО, из которых она построена и в которые она переходит при увеличении межъядерного расстояния. Например, запись σ2pz означает, что данная МО σ-типа построена из 2pz-АО и переходит в них при Rab → ∞ (рис. 12), pz-АО дают σg и σu*-МО, а px- и py-АО образуют, соответственно, πu- и πg*- МО. π-МО дважды вырождены, т.к. каждая π-МО состоит из двух (py и px) АО, имеющих одинаковую энергию. Это вырождение, однако, сразу снимается при отражении молекулы в плоскости, перпендикулярной межъядерной. Индексы (+) и (–) характеризуют симметрию МО по отношению к этой плоскости.
Характер распределения электронов по МО определяет порядок (кратность) связи, ее энергию, длину, магнитные свойства молекул и др. Заполнение МО подчиняется тем же правилам, что и заполнение АО: принципу наименьшей энергии, принципу Паули, правилу Хунда. Порядок, в котором возрастают энергии МО, устанавливается экспериментально или расчетным путем. Величина зарядов ядер может влиять на очередность заполнения орбиталей. Для гомоядерных молекул, более тяжелых, чем N2, Малликеном установлена последовательность орбиталей по энергии для молекул, построенных из атомов первого и второго периодов:
σg1s < σu*1s < σg2s < σu*2s < πu2px = πu2py < σg2pz < πg*2px = πg*2py < σu*2pz.
Орбитали σg2pz и вырожденные πu2py имеют близкие энергии и могут меняться местами в зависимости от конкретной молекулы. Так, для молекул B2, C2, N2 уровень МО σg2pz лежит
выше πu2px(y).
Кратность связи в теории МО определяется выражением
N = |
nS − nA |
, |
(98) |
|
|||
2 |
|
|
|
где nS и nA – суммарные количества электронов на связывающих и разрыхляющих орбиталях соответственно.
Для молекулы можно записать терм, который выражает состояние электронов и содержит квантовые числа и другие характеристики симметрии молекул. Молекулярные термы определяют из спектроскопических экспериментальных данных или квантово-химических расчетов. Точное знание термов молекул важно, например, при расчете энергии активации (см. раздел 5.3.3).
Систематика электронных термов молекул ведется по значениям квантового числа Λ, определяющего проекцию орбитального момента всей молекулы на линии связи. Для
многоэлектронных линейных систем Λ = ∑mi . Для обозначения молекулярных термов используются прописные греческие буквы:
16
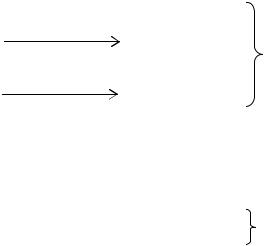
Квантовое число Λ . . . . . . . . . . . . . . . . . . |
0 |
1 |
2 |
3 |
Молекулярный терм . . . . . . . . . . . . . . . . . |
Σ |
Π |
|
Ф |
Символ МО . . . . . . . . . . . . . . . . . . . . . . . . |
σ |
π |
δ |
ϕ |
Мультиплетность терма равна |
|
|
|
|
M = 2S + 1, |
|
|
|
(99) |
где S – суммарный спин состояния. Мультиплетность указывается в верхнем левом углу символа молекулярного терма. Для молекул характерны состояния со взаимно скомпенсированными (спаренными) спинами (S = 0) и, следовательно, синглетные термы (M = 1). Для σ-электронов Λ = 0, поэтому σ-электроны в любой комбинации дают только Σ-термы.
Термы с Λ ≠ 0 будут двукратно вырожденными соответственно двум значениям ml:
ml = 1 |
ml |
= 1 |
1 |
|
2 |
|
|
∑ml |
= 2 |
|
∑ml |
|
|
|
|
|
|||
ml = −1 |
ml |
= −1 |
Λ = |
|
= 2 ; -терм. |
|
|
|
|
|
|||
1 |
|
2 |
|
|
|
|
∑ml = −2
Вырождение Σ-термов зависит от их «происхождения»: Σ-термы, образованные σ-электронами, будут невырожденными, т.к. ml для этих электронов равно нулю, а любая комбинация нулей дает нуль. Σ-Термы, образованные π-электронами, будут двукратно вырожденными:
m1 |
= +1 |
m2 |
= –1 |
Λ = 0; |
Σ-терм. |
|
m1 |
= –1 |
m2 |
= +1 |
|||
|
|
Это вырождение, однако, снимается при отражении молекулы в плоскости, перпендикулярной межъядерной, и получаются термы Σ+ и Σ- с разной энергией.
Четность термов (g- или u-характер) определяется числом «нечетных электронов» (σu-, πu-). При определении четности терма используют правила перемножения характеристик симметрии g и u: g × g = g, u × u = g, g × u = u × g = u. Эти правила распространяются на любое число электронов. Если число электронов четное, то термы имеют g-характер, а если нечетное, то u- характер.
В Приложении H приведено в качестве примера определение терма молекулы С2. Приведем термы некоторых гомоядерных молекул в основном состоянии:
H2 (σg1s)2 |
1Σ+g |
O2 KK (σg2s)2 (σu*2s)2 (σg2pz)2 (πu2px)2 (πu2py)2 (πg*2px)2 |
3 Σ−g |
N2 (CO) KK (σg2s)2 (σu*2s)2 (πu2px)2 (πu2py)2 (σg2pz)2 |
1Σ+g |
Cl2 KKLL (σg3s)2 (σu*3s)2 (σg3pz)2 (πu3px)2 (πu3py)2 (πg*3px)2 (πg*3py)2 |
1Σ+g |
17
4.СИММЕТРИЯ МОЛЕКУЛЯРНЫХ СИСТЕМ
Вструктурной химии часто используется понятие симметрии. Мы имеем дело с симметричными молекулами или, по крайней мере, фрагментами молекул. Симметрия ядерного остова создает симметричное силовое поле, в котором движутся электроны. Следовательно, в этом случае неизбежно проявление симметрии МО, а значит, и реакционная способность химических соединений зависит от наличия или отсутствия элементов симметрии в исследуемой системе.
4.1. Операции симметрии |
|
|
|
|
|
|
|
|
|
|
|
||||
Операция симметрии – это преобразование пространства (и времени) и перестановка частиц, |
|||||||||||||||
переводящая систему в физически тождественный объект (саму в себя). В применении к |
|||||||||||||||
молекулам операции симметрии включают перемещения атомов, повороты фрагментов молекулы. |
|||||||||||||||
Операции симметрии связаны с наличием определенных элементов симметрии. Различают |
|||||||||||||||
четыре типа операций симметрии. |
|
|
|
|
|
|
|
|
|
|
|
||||
1. Поворот вокруг оси симметрии на угол 2πk/n, где k и n – целые числа (k ≤ n). Данная |
|||||||||||||||
операция симметрии обозначается Ck , а ось называется осью вращения n-го |
|
|
|
||||||||||||
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
порядка. Например, в молекуле хлороформа имеется ось вращения третьего |
|
|
Cl |
||||||||||||
порядка, проходящая через атомы C и |
H. При последовательных поворотах |
Cl |
|||||||||||||
Cl |
|||||||||||||||
на 120 градусов физически и химически неразличимые атомы хлора |
|
|
|||||||||||||
|
|
C |
|||||||||||||
отображаются друг на друга, приводя к трем идентичным состояниям |
|
|
|
||||||||||||
молекулы хлороформа (рис. 13). |
|
|
|
|
|
|
|
|
|
|
H |
||||
Если в молекуле имеется несколько осей, то выделяют главную ось |
|
|
|||||||||||||
|
|
|
|||||||||||||
вращения, обладающую наибольшим порядком. В пространственной |
|
|
|
||||||||||||
системе координат главную ось обычно совмещают с координатной осью z. |
|
Рис. 13. Ось |
|||||||||||||
2. |
Отражение |
в |
плоскости. |
|
Атомы |
претерпевают |
|
зеркальное |
|
||||||
|
|
|
симметрии третьего |
||||||||||||
|
z |
|
|
|
отражение в некоторой плоскости |
|
порядка молекулы |
||||||||
|
|
|
|
либо сами в себя (если они |
|
хлороформа. |
|||||||||
|
|
|
|
|
|
||||||||||
|
|
σ2 |
|
|
принадлежат |
этой |
|
плоскости), |
|
|
|
||||
Cl' |
σ1 |
|
Cl'' |
|
либо |
в |
эквивалентные им |
атомы. |
Данная операция |
||||||
|
|
симметрии обозначается σ. Например, молекула цис- |
|||||||||||||
|
|
|
|||||||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
1,2-дихлорэтилена, наряду с осью |
вращения второго |
|||||||||
|
C' |
|
C'' |
y |
порядка |
С2, |
обладает |
двумя |
плоскостями симметрии |
||||||
|
|
|
|
|
(рис. 14). Отражение в плоскости σ1 переводит все |
||||||||||
H' |
|
|
H'' |
|
атомы сами в себя, а отражение в плоскости σ2 – атомы |
||||||||||
|
|
|
с индексом ′ в ′′ и наоборот. Обе плоскости проходят |
||||||||||||
|
|
|
|
|
|||||||||||
x |
|
|
|
|
через ось симметрии С2, такие плоскости называются |
||||||||||
|
|
|
|
вертикальными и обозначаются σv. |
|
|
|||||||||
|
|
|
|
|
|
|
|||||||||
Рис. 14. Вертикальные плоскости симметрии |
|
|
У транс-1,2-дихлорэтилена имеется ось вращения |
||||||||||||
молекулы цис-1,2-дихлорэтилена. |
|
С2, |
а |
также |
одна |
плоскость |
симметрии, |
||||||||
|
z |
|
|
|
перпендикулярная оси. Такая плоскость называется |
||||||||||
|
|
|
|
|
горизонтальной и обозначается σh (рис. 15). Наконец |
||||||||||
|
Cl |
|
H |
|
встречаются |
диагональные плоскости симметрии σd, |
|||||||||
|
|
|
которые делят пополам угол между двумя осями |
||||||||||||
|
|
|
|
|
|||||||||||
|
C' |
|
C'' |
|
симметрии Сn. Например, в плоскоквадратном анионе |
||||||||||
|
|
|
[PtCl4]2- есть главная ось симметрии C4, четыре |
||||||||||||
|
|
|
|
|
|||||||||||
|
H |
|
Cl |
|
перпендикулярные ей оси C2, плоскость σh, две |
||||||||||
|
|
|
|
|
плоскости σv и две плоскости σd. |
|
|
|
|||||||
|
|
|
|
|
|
3. Инверсия относительно некоторой точки i. |
|||||||||
Рис. 15. Горизонтальная плоскость симметрии |
Например, в одном из стереоизомеров хладона-132 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
молекулы транс-1,2-дихлорэтилена. |
|
центр инверсии делит связь C–C пополам (рис. 16а). |
|||||||||||||
|
|
|
|
|
Другой |
стереоизомер |
не имеет |
центра |
инверсии, но |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18 |
|

имеет ось вращения C2, проходящую через середину связи C–C и перпендикулярную плоскости
F-C-C-F (рис. 16б).
а H Cl |
|
б |
|
|
|
H |
H |
|
|
|
F |
F |
I |
|
|
|
|
|
|
|
F |
F |
|
|
Cl |
Cl |
|
|
|
Cl H
Рис. 16. Центр инверсии одного из стереоизомеров молекулы 1,2-дифтор-1,2-дихлорэтана (а) и ось вращения второго порядка другого стереоизомера (б).
4. Тождественное преобразование E, оставляющее неизменным положение молекулы. Остальные операции симметрии сводятся к комбинации вышеперечисленных операций.
Большое значение имеет еще одно преобразование – зеркальный поворот. Данная операция симметрии состоит из поворота Сn с последующим отражением молекулы в плоскости σh; она обозначается Sn. Из определения зеркального поворота очевидно, что операция симметрии S2 тождественна инверсии молекулы, т.е. Sn ≡ i.
4.2. Точечные группы симметрии
Совокупность операций симметрии молекулы образует математическую точечную группу симметрии. Элементы симметрии должны быть согласованны. Так, две зеркальные плоскости могут располагаться лишь под определенными углами друг к другу, а если они взаимно перпендикулярны, то линия их пересечения является осью симметрии второго порядка (как это имеет место в [PtCl4]2-).
Точечные группы симметрии молекул включают повороты Сn, отражения σ, зеркальные повороты Sn и инверсию относительно начала системы координат i. Каждая из точечных групп включает и тривиальную операцию E, отвечающую отсутствию преобразования пространства. Для каждой точечной группы симметрии есть хотя бы одна неподвижная при всех операциях этой группы точка, в качестве которой у молекулы выступает центр масс.
При рассмотрении симметрии для точечных групп обычно используют обозначения Шёнфлиса.
С1 – группа, содержащая только тождественное преобразование E. К ней относятся все несимметричные молекулы, например, втор-бутанол.
Простейшие точечные группы включают всего лишь единичную операцию и один нетривиальный элемент симметрии. Ими являются:
С2 – группа, содержащая вращение вокруг оси второго порядка. Пример – молекула пероксида водорода;
Cs – группа, содержащая отражение в плоскости. Данной точечной группе соответствует, например, молекула уксусной кислоты;
Ci – группа, содержащая инверсию. Сюда можно отнести рассмотренный выше один из стереоизомеров хладона-132. Более сложными являются группы Cn, включающие поворот вокруг оси n-го порядка и усложненные дополнительными элементами:
Cnv – группа, возникающая при расширении Cn операциями отражения σv в n плоскостях, проходящих через ось симметрии (группа симметрии правильных n-угольных пирамид). Значение n может изменяться от 2 (вода), 3 (хлороформ) до бесконечности – группа C∞v (циановодород);
Cnh – группа, включающая в дополнение к операциям Cn отражение σh в плоскости, ортогональной оси симметрии. Примером молекулы, отвечающей данной точечной группе, является рассмотренный выше транс-1,2-дихлорэтилен;
Sn – группа, состоящая из зеркального поворота на угол (π/n)l, где l = 1, 2, … n. Например, циклическая сера S8 по случайному совпадению обозначений имеет группу симметрии S8.
19
Диэдрические группы Dn, включающие все повороты, которые совмещают правильную n- угольную призму саму с собой, подразделяются на:
Dnh – расширение группы Dn операциями отражения. Значение n может изменяться от 2 (этилен), до бесконечности – группа D∞h. Последняя соответствуют линейным симметричным молекулам, например, диацетилену или углекислому газу;
Dnd – группа симметрии правильных n-угольных антипризм. Точечными группами такого рода обладают молекулы циклобутана (D2d), этана (D3d), скошенной конформации ферроцена (D5d).
Наконец, точечные группы высшей симметрии включают группы, содержащие несколько поворотных осей более высоких порядков, чем второй:
Td – группа симметрии правильного тетраэдра, например, метан;
Oh – группа симметрии правильного октаэдра, которой соответствует, например, молекула гексафторида серы;
Ih – группа симметрии правильного икосаэдра. Химические соединения, относящиеся к данной точечной группе, крайне редко встречаются. Пример – молекула фуллерена C60.
Отнесение исследуемой структуры к определенной точечной группе состоит в нахождении главной оси симметрии (если таковая существует) и выявлении всех остальных элементов симметрии молекулы.
Все действия с точечными группами симметрии подчиняются положениям и правилам общей математической теории групп * . Полные совокупности операций симметрии основных точечных групп приводятся в таблицах характеров их неприводимых представлений или типов симметрии.
4.3. Орбитальная симметрия
Симметрия ядерной конфигурации влечет за собой вполне определенное поведение электронной волновой функции, а именно: при операциях симметрии она преобразуется по одному из неприводимых представлений группы симметрии молекул. Как правило, волновые функции для заданного собственного значения энергии образуют базис неприводимого представления группы пространственной симметрии рассматриваемой молекулы. Основываясь на этом, можно анализировать собственные состояния молекулы, не решая уравнения Шрёдингера.
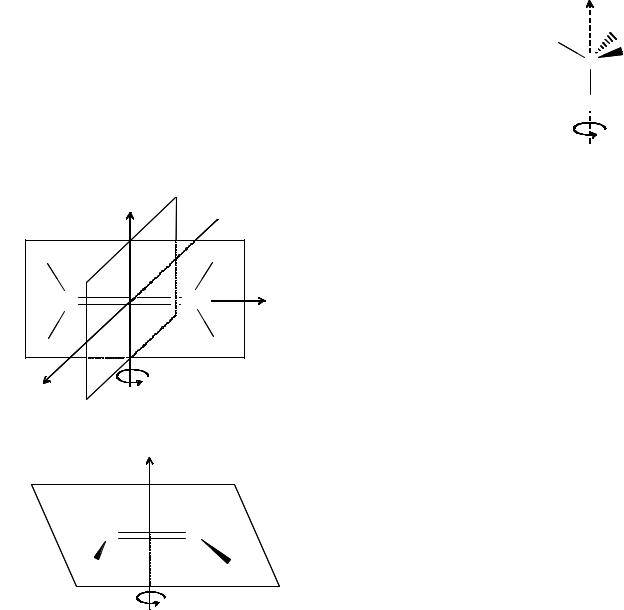
Обозначения неприводимых представлений (см. Приложение А) даются по отношению к главной поворотной оси: симметричные обозначают символом A, несимметричные – B. В качестве примеров приведем МО, составленные для простоты понимания из несложных комбинаций АО (рис. 17а,б). Если в молекуле имеются плоскости симметрии σv, то симметричные преобразования орбиталей относительно этих осей обозначаются подстрочным символом 1, несимметричные – 2. Примеры орбиталей симметрии A1 и B2 приведены на рис. 18.
Рис. 18. Различные симметрии орбиталей.
* Основные положения теории групп изложены в Приложении А.
20
В точечных группах, включающих центр инверсии, добавляются индексы g (см. раздел 3.3.4) для симметричных по отношению к центру инверсии и u – для несимметричных представлений. Если необходимо указать свойства симметрии орбиталей по отношению к плоскости σh, то добавляют верхний индекс – штрих для симметричных и два штриха для несимметричных представлений. Вырожденные неприводимые представления обозначают буквами E (двойное вырождение) и F (тройное вырождение).
21

5. КВАНТОВО-ХИМИЧЕСКИЙ ПОДХОД К ОЦЕНКЕ РЕАКЦИОННОЙ СПОСОБНОСТИ МОЛЕКУЛ
5.1. Общие положения
Реакционная способность молекул – это их способность вступать в химическое взаимодействие, характеристика их относительной химической активности. Качественно о реакционной способности судят по числу и разнообразию превращений, в которые способно вступать вещество. Для количественной оценки реакционной способности рассматривают реакционные серии, т.е. ряды однотипных реакций, проводимых в одинаковых условиях, например:
ZoX k0  P0
P0
Z1X |
k1 |
P1 |
|
. . . |
|||
|
|
ZnX kn  Pn
Pn
где Х – общая группа атомов, которая претерпевает изменения в данной реакции (реакционный центр); Z0, Zl, ..., Zn – неизменяющиеся молекулярные фрагменты; Р0, Р1,..., Рn – продукты реакции. Отношения констант скоростей k1/k0, ..., kn/k0 количественно характеризуют реакционную способность в ряду реагентов ZiX (i = 0, 1, ..., n) (см. табл. 2). В правильно составленной реакционной серии изменение механизма реакции должно быть исключено, т.е. константы скорости должны характеризовать одну и ту же элементарную реакцию.
Таблица 2. Относительные константы скорости k реакции (100) при 65 оС
№ п/п |
Олефин* |
k/k0** |
№ п/п |
Олефин |
k/k0 |
|
|
|
|
|
|
1 |
Этилен |
1 |
9 |
2-Винилпиридин |
80 |
2 |
Бутадиен |
59 |
10 |
4-Винилпиридин |
80 |
3 |
Стирол |
47 |
11 |
Винилацетат |
2 |
4 |
1-Фенилбутадиен |
135 |
12 |
Акрилонитрил |
102 |
5 |
1-Винилнафталин |
48 |
13 |
Метилакрилат |
61 |
6 |
1,1-Дифенилэтилен |
94 |
14 |
Метилвинилкетон |
112 |
7 |
Стильбен |
52 |
15 |
Винилэтиловый эфир |
0,47 |
8 |
1,4-Дифенилбутадиен |
190 |
|
|
|
|
|
|
|
|
|
*Присоединение к наименее замещенному атому С двойной связи;
**k0 – константа скорости реакции с этиленом.
Вкачестве примера реакционной серии можно назвать реакции электрофильного замещения
вароматическом ряду. В зависимости от заместителя R образуются те или иные изомеры,
например, при нитровании:
R |
R |
R |
R |
|
|
NO2 |
|
|
нитрование |
+ |
+ |
|
|
NO2
NO2
Электронодонорные заместители [R = СН3, ОСН3, N(CH3)2] стимулируют образование орто- и пара-продуктов, а электроноакцепторные (R = СООН, SO3H, NO2) – мета-продуктов, причем в

первом случае реакция идет легче, чем с незамещенным бензолом (R = Н), а во втором – труднее. Эти закономерности называются правилами ориентации в ароматическом ряду. При нуклеофильном замещении правила ориентации обращаются.
В данном примере нет необходимости в количественных кинетических измерениях, реакционная способность определяется по относительному выходу изомеров. Пример широкой реакционной серии – реакции радикального присоединения по двойной связи:
|
|
CH.3 + CHR'=CHR |
|
k |
|
|
|
|
|
(100) |
||
|
|
|
|
H3C |
|
CHR' |
|
CHR |
||||
|
|
|
|
|
|
|||||||
В данном |
случае |
реакционная |
способность характеризуется отношением константы |
|||||||||
скорости k к константе скорости k0 реакции с этиленом (R, R' = Н) (см. табл. 2). |
|
|||||||||||
Современная |
теоретическая |
химия |
|
позволяет |
|
|
непосредственно |
рассчитать |
||||
абсолютные константы |
скорости только для |
несложных |
химических систем. |
В теории |
||||||||
реакционной способности качественно закономерности могут быть выявлены для объектов любой сложности. При этом используют различные подходы. При эмпирическом подходе классифицируют влияние заместителей по нескольким типам (эффекты сопряжения, полярные, пространственные и др.) и применяют корреляционные соотношения. Традиционный квантово- химический подход основан на теории активированного комплекса. С этой точки зрения элементарный акт взаимодействия молекул состоит в постепенной перестройке химических связей, при которой начальная конфигурация атомов в исходных молекулах переходит в конечную у продуктов реакции при непрерывном изменении межатомных расстояний. Предполагается, что для всех реакций, составляющих реакционную серию (без пространственных и сольватационных эффектов), остается примерно постоянным предэкспоненциальный множитель А в уравнении Аррениуса для константы скорости:
k = Aexp(− Ea / RT ). |
(101) |
Поэтому характеристикой реакционной способности служит энергия |
активации реакции Eа, |
которая практически совпадает с высотой потенциального барьера ППЭ. |
|
5.2. Поверхность потенциальной энергии и химическая реакция
Понятие ППЭ, введенное ранее (см. раздел 2.1) при рассмотрении механической модели молекулы и применяемое для анализа сил, действующих в молекуле, может выступать вещественным образом химической реакции. В терминах ППЭ химическая реакция означает переход молекулярной системы из одного минимума в другой. Путь минимальной энергии для такого перехода есть движение по дну долины ППЭ, связывающей два ее минимума через точку перевала, являющейся точкой минимакса или седловой точкой. Физический смысл этой точки в том, что она является мерой той минимальной энергии, которую необходимо затратить для протекания химической реакции. Геометрическая конфигурация молекулярной системы в седловой точке называется переходным состоянием (активированным комплексом) данной реакции. Это – ключевое понятие в теории химической кинетики, т.к. энергия переходного состояния относительно исходного минимума ППЭ определяет энергию активации и, следовательно, скорость химической реакции.
Таким образом, точка переходного состояния наряду с минимумами ППЭ является важнейшей характеристикой ППЭ. Идентификация этой точки проводится путем расчета гессиана
(6)для данного набора ядерных координат. Диагонализированная матрица силовых постоянных
(7)имеет в этой точке одно и только одно отрицательное значение или, как говорят, отрицательную кривизну. Молекулярная система, находясь в неустойчивой седловой точке, «скатывается» вдоль направления отрицательной кривизны, называемом координатой реакции, в один или другой минимум по пути минимальной энергии реакции. Таким образом, классическая
траектория поступательного движения изображающей точки из долины реагентов в долину продуктов через точку переходного состояния называется путем химической реакции*. Области
* Термины «путь реакции», «поступательное движение» и другие относятся не к перемещениям самого активированного комплекса в пространстве, а к движению его фигуративной точки по энергетической поверхности.
2
ППЭ, в гессиане которых содержится две (или более) отрицательные силовые постоянные, не имеют химического значения, и система избегает попадания в эти области ППЭ.
Рассмотрим механизм реакции
A + BC → AB + C |
(102) |
При сближении атома А с молекулой BC ослабляется связь B–C и возникает связь A–B. Процесс |
|
завершается образованием молекулы AB и атома С, для чего система должна пройти через |
|
активированный комплекс ABC≠, когда атом B в одинаковой степени принадлежит молекулам BC |
|
и AB: |
|
A + BC → ABC≠ → AB + C |
(103) |
В процессе реакции изменяются расстояния A–B и B–C |
и соответственно потенциальная |
энергия системы. Указанные изменения могут быть представлены в виде трехмерной (в общем
случае многомерной) ППЭ. Чтобы получить |
|
||||||||
визуальное |
представление |
о |
|
строении |
|
||||
многомерной ППЭ, прибегают к анализу ее |
|
||||||||
различных сечений по двум независимым |
|
||||||||
внутренним координатам. На рис. 19 показана |
|
||||||||
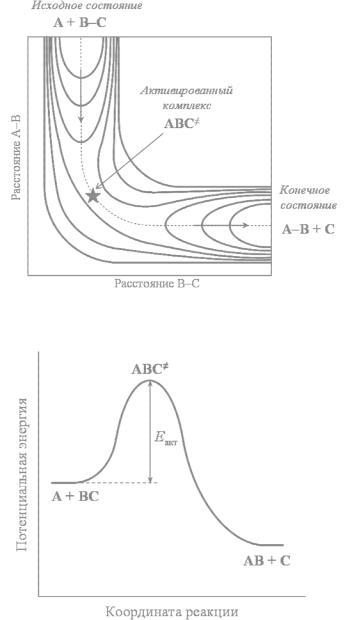
карта поверхности |
потенциальной |
энергии |
|
||||||
реакции (102). Такая карта строится |
|
||||||||
аналогично |
географической |
карте: |
на |
|
|||||
плоскости |
вычерчиваются изоэнергетические |
|
|||||||
(или эквипотенциальные) линии, соединяющие |
|
||||||||
точки |
|
различных |
геометрических |
|
|||||
конфигураций молекулярной системы, которые |
|
||||||||
имеют одинаковую потенциальную энергию. |
|
||||||||
Относительное |
расположение |
локальных |
|
||||||
минимумов ППЭ, соответствующих реагентам |
|
||||||||
и продуктам, и седловой точки переходного |
|
||||||||
состояния определяется тем, является ли |
Рис. 19. Карта ППЭ для реакции (102). Кривые – |
||||||||
рассматриваемая реакция экзотермической. |
|
||||||||
Связывающий продукты и реагенты путь |
изоэнергетические линии. |
||||||||
|
|||||||||
минимальной энергии проходит через точку |
|
||||||||
переходного состояния. Этот путь и является |
|
||||||||
координатой реакции. На рис. 20 показана |
|
||||||||
зависимость потенциальной |
энергии |
системы |
|
||||||
от этой координаты. Видно, что для протекания |
|
||||||||
реакции |
|
система |
должна |
преодолеть |
|
||||
энергетический барьер величиной Eа. Эту |
|
||||||||
величину также называют энергией активации |
|
||||||||
или активационным барьером реакции. |
|
||||||||
Величина Eа в первом приближении равна |
|
||||||||
экспериментальной |
энергии |
газофазной |
|
||||||
реакции. Более строгая оценка величины |
|
||||||||
энергетического |
|
барьера |
учитывает |
|
|||||
температурную поправку и коррекцию на |
|
||||||||
энергии |
нулевых |
колебаний |
участников |
|
|||||
реакции. В рамках теории химической |
|
||||||||
кинетики энергия активации не вычисляется, а |
Рис. 20. Изменение потенциальной энергии системы |
||||||||
рассматривается как опытная величина. |
|
вдоль координаты реакции (102) во время |
|||||||
Квантовая |
теория выявила |
физический |
элементарного акта. |
||||||
|
|||||||||
смысл |
вышеперечисленных |
интуитивных |
|
||||||
представлений и дала им строгие определения. Это позволило разработать методы расчета величин, описывающих химические реакции. Кроме того, квантовая химия позволяет не только
3
