- •Физическая химия
- •Содержание
- •I. Рабочая программа дисциплины
- •1. Цели и задачи изучения дисциплины
- •2. Требования к уровню освоения содержания дисциплины
- •3. Объем дисциплины
- •3.1. Распределение часов по темам и видам учебной работы Форма обучения очная
- •3.2. Распределение часов по темам и видам учебной нагрузки Форма обучения очная
- •4. Содержание дисциплины Введение
- •Основы химической термодинамики
- •Равновесия Термодинамика химического равновесия
- •Фазовые равновесия
- •Растворы Растворы неэлектролитов
- •Растворы электролитов
- •Электрохимия
- •Химическая кинетика и катализ
- •Современная теория химического строения.
- •5. Темы практических/ семинарских занятий
- •6. Лабораторные работы (лабораторный практикум)
- •Тема 1. Предмет и метод термодинамики, основные понятия. Энергия. Закон сохранения и превращения энергии. Первый закон термодинамики. Энтальпия
- •Тема 2. Термохимия. Второй закон термодинамики. Энтропия
- •Тема 3. Фазовые переходы. Термодинамика химического равновесия
- •Тема 4. Фазовые равновесия
- •Тема 5. Растворы неэлектролитов
- •Тема 6. Растворы электролитов
- •Тема 7. Термодинамика и кинетикаэлектродных процессов
- •Тема 8. Химическая кинетика. Катализ
- •Тематика курсовых/контрольных работ/рефератов
- •Темы рефератов
- •Требования к оформлению реферата
- •8. Учебно-методическое обеспечение дисциплины
- •8.3. Методические указания студентам
- •Вопросы и задачи для самоконтроля
- •Подготовленности к проведению лабораторных работ
- •Лабораторная работа №1
- •Лабораторная работа №2
- •Лабораторная работа №3
- •Лабораторная работа №4
- •Лабораторная работа №5
- •Лабораторная работа №6
- •Лабораторная работа №7
- •Лабораторная работа №8
- •Лабораторная работа №9
- •Индивидуальные задания Законы идеального газа и идеальных газовых смесей
- •I. Теоретические вопросы (все каждому студенту)
- •II. Задачи (каждому студенту номера задач только своего варианта)
- •Приложение 1 закона термодинамики к термодинамическим и химическим процессам
- •Растворы
- •Электрохимия
- •Кинетика и катализ химических реакций
- •8.4. Методические указания преподавателям
- •Рейтинговая система обучения Общие положения
- •Текущий контроль
- •Самостоятельная работа
- •Обобщающий контроль
- •Итоговый контроль
- •Механизм формирования рейтинга
- •II. Материалы, устанавливающие содержание и порядок проведения промежуточных и итоговых аттестаций
- •1. Тематика контрольных работ Химическая термодинамика
- •Фазовое равновесие
- •Химическое равновесие
- •Молекулярные растворы
- •Растворы электролитов
- •Кинетика и катализ
- •Электрохимия
- •2. Вопросы и задачи для самоконтроля Химическая термодинамика
- •Фазовые и химические равновесия
- •Кинетика и катализ химических реакций Вопросы
- •3. Тестовые задания Химическая термодинамика
- •Фазовое и химическое равновесие
- •Растворы
- •Электрохимия
- •Кинетика и катализ
- •Вопросы для подготовки к экзамену
3. Тестовые задания Химическая термодинамика
№1. Свойства внутренней энергии системы в общем случае:
1) функция состояния системы;
2) функция процесса;
3) экстенсивная функция;
4) интенсивная функция;
5) функция, равная теплоте процесса;
6) функция, равная работе процесса;
7) абсолютное значение функции неизвестно.
№2. Выражения, справедливые для изохорной теплоемкости CV одного моля идеального газа:
-
1)

4)
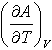 3)
3)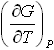 2)
2)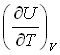
5) CP-R6) ΔU+W
№3. Выражение первого начала термодинамики, записанное с использованием работы системы W и теплоты процесса Q, имеет вид:
1) Q = ΔU – W;
2) Q = ΔU + W;
3) ΔU = Q + W;
4) ΔU = Q – W;
5) W = ΔU + Q.
№4. Выражения, справедливые для адиабатического процесса с идеальным газом (W – работа системы, Q – теплота процесса):
-
1) P = const;
2) V = const;
3) T = const;
4) PVγ = const;
5) γ=Cp/Cv;
6) ΔU = 0;
7) W = 0;
8) Q = 0;
9) ΔU = – W.
№5. Процесс обратимого расширения 1 моль идеального газа от объема V1до объема V2 , в котором изменение внутренней энергии газа будет наибольшим:
1) адиабатический;
2) изотермический;
3) изобарный;
4) изотермический до объёма V1+0,5V2, затем изобарный до V2;
5) изобарный до объёма V1+0,5V2,затем изотермический до V2.
№6. Работа системы при обратимом изобарном расширении n моль идеального газа от объёма V1до объёма V2:
1) P(V2 – V1);
2) nR(lnV2 – lnV1);
3) 0;
4) -nCV(T2 – T1).
№7. Теплота процесса при обратимом изохорном нагревании n моль идеального газа от температуры T1 до температуры T2 выражается как:
1) nR(T2 – T1);
2) nR(lnT2 – lnT1);
3) nCV(T2 – T1);
4) nCP(T2 – T1).
№8. Условия, отличающие изолированную термодинамическую систему:
1) совокупность материальных объектов, занимающих ограниченную область пространства;
2) совокупность материальных объектов, занимающих неограниченную область пространства;
3) исключен обмен веществом и энергией с окружающей средой; возможен обмен энергией с окружающей средой, но исключен обмен веществом;
4) возможен обмен веществом с окружающей средой, но исключен обмен энергией;
5) возможен обмен веществом и энергией с окружающей средой.
№9. Укажите реакции, для которых можно пренебречь разностью между изменением энтальпии и изменением внутренней энергии:
1) Ca(OH)2(p-p) + CO2(г) = CaCO3(тв) + H2O(ж);
2) CaO(тв) + CO2(г) = CaCO3(тв);
3) 2AsH3(г) = 2As(тв) + 3H2(г);
4) Pb(тв) + PbO2(тв) = 2PbO(тв);
№10. Термохимическое уравнение Кирхгофа может выражать зависимость:
1) энтальпии вещества от температуры при постоянном давлении;
2) теплоемкости вещества от температуры при постоянном давлении;
3) энтальпии вещества от давления при постоянной температуре;
4) теплоемкости вещества от давления при постоянной температуре;
5) изменения энтальпии в процессе от температуры при постоянном давлении;
6) изменения энтальпии в процессе от давления при постоянной температуре.
№11. Математическое выражение второго начала термодинамики в наиболее общем виде:
-
1) ΔS>0;
2) ΔS=ΔH/T;
3) dS=δQ/T;
4) TdS=dU + PdV;
5) ΔS=Q/T;
6) ΔS<0;
7) dS≥δQ/T;
8) TdS=dH – VdP.
№12. При самопроизвольном приближении к равновесию энтропия изолированной системы:
1) стремится к нулю;
2) стремится к бесконечности;
3) достигает минимума;
4) достигает максимума;
5) линейно убывает.
№13. Изменение энтропии при изохорном нагревании 1 моль идеального одноатомного газа в интервале температур T1 – T2 (CV = const):
-
4)
 1)
1)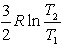
8)
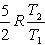 5)
5)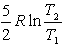 3)
3)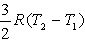 2)
2)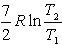
6)
![]() 7)
7)![]()
№14. Свойства химического потенциала компонента системы в общем случае:
1) функция состояния системы;
2) функция процесса;
3) экстенсивная функция;
4) интенсивная функция;
5) функция, равная теплоте процесса;
6) функция, равная работе процесса;
7) абсолютное значение функции равно парциальной мольной энергии Гиббса.
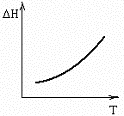
№15. В некоторой химической реакции суммарная теплоемкость CP продуктов меньше теплоемкости исходных веществ, причем соответствующая разность теплоемкостей уменьшается с ростом температуры. Укажите номер графика, соответствующего температурной зависимости изменения энтальпии в реакции.
-
1)

4)
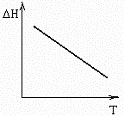 3)
3) 2)
2)
5)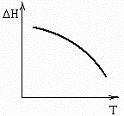 6)
6)