
misc / 32846_e06b06cd6e9ad04f315d37bd4131ce33
.pdf
Расчеты по уравнениям химических реакций |
|
|
|
|
91 |
|
|||||
|
|
|
4 моль |
х моль |
|
|
|
|
|||
|
|
|
|
2Fe + 3Cl2 = 2FeCl3. |
|
|
|
|
|||
|
|
|
2 моль |
2 моль |
|
|
|
|
|||
5. Составляем и решаем пропорцию на основе рассуждения: |
|
||||||||||
2 моль Fe образуют 2 моль FeCl3 |
|
|
а |
|
|||||||
4 моль Fe образуют х моль FeCl3 |
|
|
|
||||||||
|
2 |
= |
2 |
, отсюда х = 4 моль FeCl . |
|
|
|
||||
|
|
|
|
|
|||||||
4 |
|
x |
|
|
3 |
|
т |
|
|||
|
|
|
|
|
|
||||||
6. Находим массу FeCl3: |
|
|
|
|
|
||||||
|
|
|
|
|
m = n M; |
|
|
е |
|
|
|
Mr(FeCl3) = 56 + 35,5 3 = 162,5; |
|
|
|
|
|||||||
|
|
M(FeCl3) = 162,5 г/моль; в |
|
|
|
||||||
m(FeCl3) = n(FeCl3) |
M(FeCl3) = 4 моль 162,5 г/моль = 650 г. |
|
|||||||||
|
|
|
|
|
|
|
с |
|
|
|
|
Ответ: масса образовавшегося FeCl3 |
равна 650 г. |
|
|
|
|||||||
|
|
|
|
|
|
а |
|
|
|
|
|
Пример 2. Определите массу алюминия, прореагировавшего с |
|
||||||||||
кислородом, если в результате ре кции образовалось вещество Al2O3 |
|||||||||
химическим количеством 3,5 моль. я |
|||||||||
Дано: |
|
|
|
|
|
а |
|
Решение |
|
|
|
|
|
|
|
|
|
||
n(Al2O3) = 3,5 моль |
о |
|
|
|
|
||||
|
|
|
|
|
1. Составляем уравнение реакции, подчер- |
||||
m(Al) — ? |
|
|
|
|
киваемнформулы интересующих нас веществ: |
||||
|
а |
|
|
д |
|
4Al + 3O2 = 2Al2O3. |
|||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||
2. Под их фо мулами записываем химические количества вступив- |
|||||||||
шего и обр зов вшегося веществ по уравнению: |
|||||||||
Н |
р |
4Al + 3O2 |
= 2Al2O3. |
||||||
|
|
|
|
|
4 моль |
|
|
2 моль |
|
3. ад формулами интересующих нас веществ проставляем химические количества вступивших в реакцию и образовавшихся ве-
ществ:
х моль 3,5 моль
4Al + 3O2 = 2Al2O3.
4 моль 2 моль
Правообладатель Народная асвета

|
92 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Химические реакции |
||
|
|
4. Составляем и решаем пропорцию на основе рассуждения: |
|||||||||||||||||||||
|
|
|
|
|
4 моль Al образуют 2 моль Al2O3 |
а |
|||||||||||||||||
|
|
|
|
|
х моль Al образуют 3,5 моль Al2O3 |
||||||||||||||||||
|
|
|
|
|
4 |
= |
|
2 |
, отсюда x = 7 моль Al . |
|
|||||||||||||
|
|
|
|
|
|
|
x |
|
3,5 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
5. Находим массу Al: |
|
|
|
|
|
|
|
е |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m = n M; |
в |
т |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar(Al) = 27; |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M(Al) = 27 г/моль; |
|
||||||||
|
|
|
m(Al) = n(Al) M(Al) = 7 моль 27 г/моль = 189 г. |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
|
|
Ответ: масса прореагировавшего алюминия равна 189 г. |
|||||||||||||||||||||
|
|
Пример 3. Рассчитайте объем (н. у.) ки лорода, необходимого |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
я |
|
|
|
|
|
|
|
|
|
для полного сгорания фосфора м ссойс93 г. |
|
|
|
||||||||||||||||||
|
|
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Решение |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
m(Р) = 93 г |
|
1. Определ ем химическое количество фосфора: |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
m |
|
|
|
|
|||||
|
|
V(О2) — ? |
|
|
|
|
|
|
|
|
n = |
; |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аr(Р) = 31; М(Р) = 31 га/моль; n(P) = 93 г : 31 г/моль = 3 моль. |
|||||||||||||||||||||
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
2. По уравнению химической реакции определяем химическое ко- |
|||||||||||||||||||||
|
личество кисл р |
а, вступившего в реакцию: |
|
|
|
||||||||||||||||||
|
|
а |
|
д3 моль |
х моль |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
4Р + 5О2 = 2Р2О5. |
|
|
|
|||||||||||
|
|
|
р |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
Н |
|
|
|
|
|
4 моль |
5 моль |
|
|
|
|
|
|
||||||||
|
|
На 4 моль Р требуется 5 моль О2 |
|
||||||||||||||||||||
|
|
|
|
|
на 3 моль Р требуется х моль О2 |
|
|||||||||||||||||
|
|
|
|
|
|
4 |
= |
5 |
, отсюда х = 3,75 моль О . |
|
|||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
3 |
|
|
х |
|
|
|
|
|
|
|
|
2 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
3. Находим объем (н. у.) кислорода: |
|
|
|
|
|
||||||||||||||||
|
|
|
V(О ) = n(О |
) V |
m |
= 3,75 моль . 22,4 дм3/моль = 84 дм3 . |
|||||||||||||||||
|
|
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Ответ: объем кислорода равен 84 дм3.
Правообладатель Народная асвета

Расчеты по уравнениям химических реакций |
|
|
93 |
|
||||
Вопросы и задания |
|
|
|
|
|
|||
1. |
Перечислите основные количественные характеристики ве- |
|
||||||
ществ. |
|
|
|
|
|
|
|
|
2. |
Вычислите массу вещества Al2O3, образующегося при пол- |
|
||||||
ном сгорании в кислороде алюминия массой 10,8 г. |
|
|
||||||
3. |
Кислород химическим количеством 1,6 моль полнос ью про- |
|
||||||
реагировал с водородом. Рассчитайте химическое количас во об- |
|
|||||||
разовавшейся при этом воды. |
|
|
т |
|
||||
4. |
В результате |
полного разложения |
ещ ст а |
|
||||
KClO3 обра- |
|
|||||||
зовался кислород химическим количеством 6 молье. Рассчитайте |
|
|||||||
массу разложившегося исходного веще тва. |
в |
|
|
|||||
5. |
Углекислый |
газ |
|
|
известняка |
|
||
получают р зложением |
|
|||||||
CaCO |
3 |
при высокой температуре (более 1000 °С) |
по реакции: |
|
||||
|
|
|
|
с |
|
|
||
CaCO3 = CaO + CO2[. Рассчитайте м ссу известняка CaCO3, необ- |
|
|||||||
ходимого для получения углекислого газаамассой 8,8 кг. |
|
|||||||
6. |
Медь полностью |
проре гиров ла с |
кислородом объемом |
|
||||
(н. у.) 44,8 дм3. Рассчитайте м ссу образовавшегося при этом ве- |
|||||
щества CuO. |
|
|
|
|
я |
|
|
|
|
|
|
7. В результате непол ого сгорания сероводорода в кислороде |
|||||
|
|
|
|
а |
|
образуется сера: 2H2S + O2 = 2S |
+ 2H2O. Рассчитайте объем (н. у.) |
||||
кислорода, необх дим го ля получения серы массой 128 г. |
|||||
|
|
|
н |
|
|
8*. Придумайте усл вие задачи, для решения которой необхо- |
|||||
|
|
д |
|
|
|
димо использовать у авнение: 2Na + Cl2 = 2NaCl. |
|||||
|
о |
|
|
|
|
Изучениер |
П актическая работа 4 |
||||
признаков химических реакций |
|||||
а |
и условий их протекания |
||||
|
|
|
|
|
|
Цель работы: изучить признаки химических реакций и усло- |
|||||
вия их протеканияН ; научиться распознавать химические явления среди множества других.
Внимательно рассмотрите склянки с растворами веществ, выданные вам для проведения опытов. Прочитайте формулы веществ, ука-
Правообладатель Народная асвета

94 Химические реакции
занные на этикетках. Соблюдайте правила безопасного поведения при
выполнении опытов. |
|
а |
|
Опыт 1. Выделение газа при химической реакции. |
В пробир- |
ку поместите небольшой кусочек соды (Na2CO3) и прилейте к нему несколько капель раствора лимонной кислоты или столового уксуса
(раствор уксусной кислоты). Что вы наблюдае е? Ук жи е условия и |
||
признаки протекания данной реакции. |
|
е |
|
в |
|
Опыт 2. Образование осадка. В пробирку вн си е 5—6 капель |
||
раствора вещества CaCl2 и добавьте к нему прим трно столько же ка- |
||
с |
|
|
пель раствора соды (Na2CO3). Что вы наблюдаете? Укажите условия |
||
а |
|
|
и признаки протекания данной реакции. |
|
|
Опыт 3. Исчезновение осадка. К о дку, полученному в опыте 2, прилейте 1—2 см3 раствора уксусной кислоты. Опишите наблюдаемые явления. Какие признаки химической реакции вы отметили?
Какие условия вы создали для того, чтобы протекание этой реакции |
||||||
было возможно? |
|
|
а |
|
||
|
|
|
|
|||
Опыт 4. Изучение призн ков реакции горения. Зажгите спир- |
||||||
|
|
|
|
н |
|
|
товку (спичку, свечу). К кие признакия |
химической реакции вы наблю- |
|||||
даете? |
|
|
д |
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
р |
|
|
|
|
|
а |
|
|
|
|
|
|
Н |
|
|
|
|
|
|
Правообладатель Народная асвета

|
|
|
|
а |
§ 19. Воздух как смесь газов |
|
|
т |
|
|
|
|
||
Вы уже знаете, что вещества могут находиться различных агре- |
||||
|
е |
|
||
гатных состояниях: газообразном, жидком и т ердом. |
|
|
||
В окружающей нас природе многие веще тва при обычных усло- |
||||
|
в |
|
|
|
виях находятся в газообразном состоянии. Прежде в его, это компо- |
||||
ненты воздушной оболочки Земли — тмосферыс. Очень много газов |
||||
растворено в водах Мирового океана. Во времяаизвержения вулканов в атмосферу также выбрасывается большое количество вулканичес-
ких газов. В недрах нашей пл неты хр н тся огромные запасы при-
родного газа. |
я |
Атмосфере принадлежит в ж ейш я роль в жизни человека, жи- |
|
вотных и растений. Ее иссле овааиям были посвящены труды мно- |
|
гих ученых прошлого. С авних времен был известен лишь один |
|
вид газа — воздух. При этнм он изучался в основном физиками и |
|
интереса у химик в не вызывал. Лишь во второй половине XVIII в. |
|
|
д |
было установлено, что в здух представляет собой смесь газов. |
|
о |
|
р |
|
Состав воздуха
Основные компоненты воздуха — азот и кислород. При нормальных условиях в воздухе объемом 100 дм3 содержится азот объемом
ных газовНприходится около 1 дм3. В заметных количествах в воздухе присутствуют аргон, углекислый газ, озон и другие газы (табл. 7).
3 |
3 |
около 78 дмаи кислород объемом около 21 дм , а на долю всех осталь- |
|
Для решения некоторых задач и проведения расчетов в физике, химии, технике очень удобно рассматривать воздух не как смесь газов, а как одно газообразное вещество. Экспериментальным путем мож-
Правообладатель Народная асвета

96 Кислород
|
|
Таблица 7. |
Состав воздуха |
||||
|
|
|
|
||||
|
Объем (дм3) газа, содержащегося |
|
Массовая |
||||
Название газа |
в воздухе объемом 100 дм3 |
|
а |
|
|||
|
|
доля газа, % |
|||||
Азот |
78,08 |
|
|
т |
|
|
75,51 |
Кислород |
20,95 |
|
|
|
|
|
23,15 |
|
|
|
|
|
|
|
|
Аргон |
0,93 |
|
е |
|
|
1,28 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Углекислый газ |
0,03 |
в |
|
|
|
0,05 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Озон |
с |
|
|
|
0,00006 |
||
0,00004 |
|
|
|
|
|||
но установить, что при нормальных у ло иях масса воздуха объемом 22,4 дм3 равна 29 г. Поскольку т кой объем при н. у. занимает любой
газ химическим количеством 1 моль, то молярную массу воздуха мож- |
||||||
|
|
|
|
|
я |
2 |
но условно считать равной 29 г/моль: |
|
|||||
|
|
|
|
а |
|
|
|
|
|
M(воздуха) =а29 г/моль. |
|||
Все газы, |
молярн я м сса которых меньше 29 г/моль, при- |
|||||
|
|
|
н |
|
|
|
нято называть газами легче воздуха (например, водород H , аммиак |
||||||
|
|
д |
|
|
|
|
NH3, угарный газ CO, метан CH4), а газы, у которых она больше |
||||||
29 г/моль — газами тяжелее воздуха (например, кислород O2, озон |
||||||
|
о |
|
|
|
|
|
O3, углекислый газ CO2). |
|
|
|
|||
|
р |
|
|
|
|
|
Получение, с бирание и хранение газов |
||||||
Газы имеют важн е значение в жиз- |
|
|||||
ни и деятельности человека. Поэтому |
|
|||||
необходимо уметь их получать, соби- |
|
|||||
рать и хр нить. |
|
|
|
|
||
В химической лаборатории неболь- |
|
|||||
шие объемыагазов можно получать раз- |
|
|||||
личными способами. Например, газы |
|
|||||
выделяются при нагревании некоторых |
|
|||||
твердыхН |
веществ (рис. 66). Газообраз- |
|
||||
|
||||||
ные вещества могут образовываться |
Рис. 66. Получениегазовизтвер- |
|||||
при действии |
некоторых жидких ве- |
дых веществ |
||||
Правообладатель Народная асвета
Воздух как смесь газов |
|
|
|
|
|
|
|
97 |
||
|
|
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
|
|
|
т |
|
|
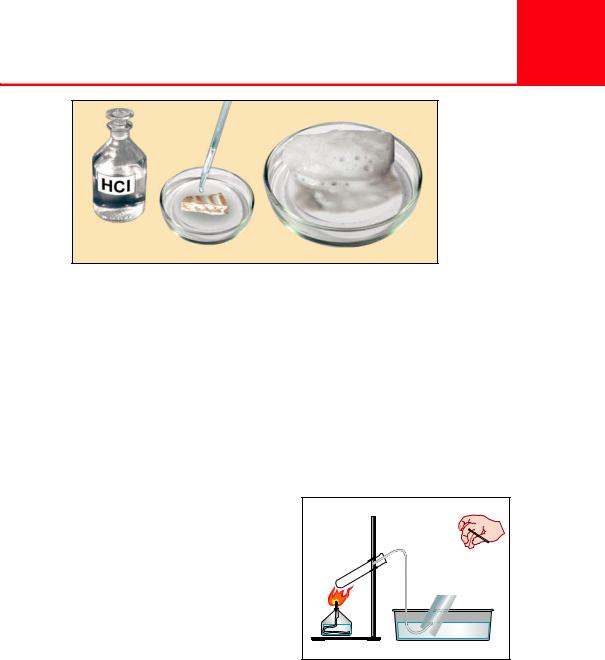
Рис. 67. Выделение газа при действии кислоты на мрамор |
|
||||||||
|
|
|
|
|
|
|
|
е |
|
|
ществ на твердые. Так, при действии уксу а на мрамор или мел выде- |
||||||||||
ляется углекислый газ (рис. 67). |
|
|
|
в |
|
|
||||
В промышленности используют зн чительно большие, чем в хими- |
||||||||||
|
|
|
|
|
|
с |
|
|
|
|
ческих лабораториях, количества различных г зов. Большие объемы |
||||||||||
кислорода и азота получают из воздуха. Позднее вы узнаете, как это |
||||||||||
делается. |
|
|
|
|
|
а |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В лабораторных условиях собр ть г з в сосуд можно двумя спо- |
||||||||||
|
|
|
|
я |
|
|
|
|
|
|
собами: вытеснением воды (рис. 68) и |
вытеснением воздуха. Пер- |
|||||||||
вый способ применяют для собира ия только нерастворимых в воде |
||||||||||
|
|
|
а |
|
|
|
|
|
|
|
газов (кислород, азот, во ород). Вто- |
|
|
|
|
|
|
||||
рой — для собирания как раствори- |
|
|
|
|
|
|
||||
|
|
|
н |
|
|
|
|
|
|
|
мых (аммиак, углекислый газ), так и |
|
|
|
|
|
|
||||
нерастворимых в в дедгаз в. |
|
|
|
|
|
|
|
|||
Для соби ания газов, которые лег- |
|
|
|
|
|
|
||||
|
|
о |
|
|
|
|
|
|
|
|
че воздуха, сосуд для сбо а газа следует |
|
|
|
|
|
|
||||
закрепить дном вверх, а для газов, ко- |
|
|
|
|
|
|
||||
|
р |
|
|
|
|
|
|
|
|
|
торые тяжелее воздуха, — дном вниз |
|
|
|
|
|
|
||||
(рис. 69). |
а |
|
|
|
|
|
|
|
|
|
Для хранения газов следует исполь- |
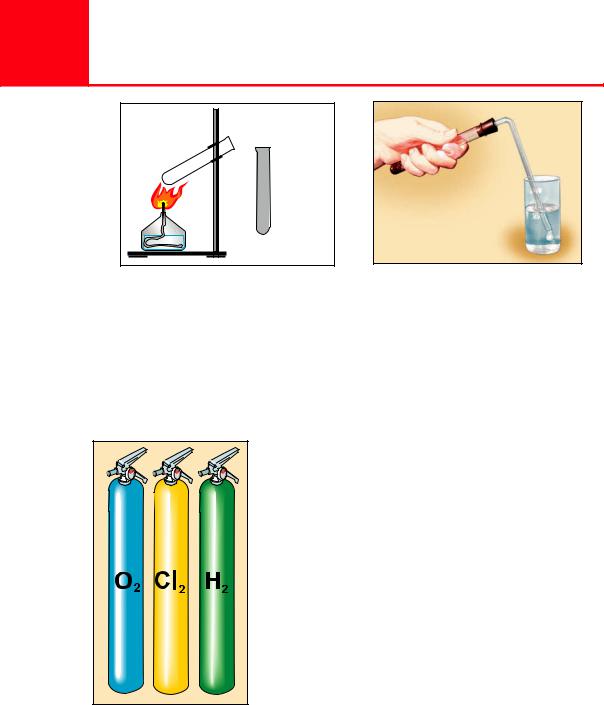
Рис. 68. Схема установки для |
|||||||||
зовать сосуды, не сообщающиеся с |
собирания газов методом вы- |
|||||||||
окружающейНсредой. Такие сосуды на- |
теснения воды: 1 — пробирка с |
|||||||||
зывают герметичными (т. е. не име- |
твердым веществом; 2 — газо- |
|||||||||
отводная трубка; 3 — стеклянная |
||||||||||
ющими отверстий для выхода газа из |
чашка; 4 — сосуд |
|
|
|||||||
|
Правообладатель Народная асвета |
|||||||||
98 |
|
|
|
|
|
|
|
|
|
|
Кислород |
|
|
|
|
|
|
|
|
|
|
|
а |
Рис. 69. Схема установки для соби- |
|
|
|
т |
|||||||
|
Рис. 70. Про ерка прибора для |
||||||||||
рания газов (более тяжелых, чем |
|
|
е |
на герметич- |
|||||||
|
|
|
|
|
|
|
|
получения газа |
|||
воздух) методом вытеснения воз- |
|
но ть |
в |
|
|
||||||
духа: 1 — кислород; 2 — воздух |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
сосуда наружу). В быту примером герметичногос |
сосуда является бу- |
||||||||||
тылка с плотной пробкой, зав занный воздушный шарик или накачан- |
|||||||||||
|
|
|
|
|
|
|
а |
|
|
|
|
ная камера от велосипедного колеса, в химической лаборатории — |
|||||||||||
пробирка, плотно закрыт |
|
пробкой, газометр (см. рис. 45). |
|||||||||
|
|
|
|
|
Из курса физики вы знаете, что при нагре- |
||||||
|
|
|
|
в |
|
я |
|
|
|
|
|
|
|
|
|
ии г зы расширяются. Это свойство можно |
|||||||
|
|
|
|
использоватьа |
для проверки прибора для полу- |
||||||
|
|
|
|
че ия газов на герметичность (рис. 70). Для |
|||||||
|
|
|
|
этого после сборки прибора следует погрузить |
|||||||
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
|
|
конец газоотводной трубки в воду, а пробирку |
|||||||
|
|
|
д |
|
|
|
|
|
|
|
|
|
|
о |
на несколько секунд зажать в ладони. Нагрева- |
||||||||
|
|
ясь от тепла руки, воздух в пробирке расширя- |
|||||||||
|
|
ется и выходит из газоотводной трубки в виде |
|||||||||
|
р |
|
|||||||||
|
|
пузырьков. Если пузырьки не наблюдаются, то |
|||||||||
|
|
это свидетельствует о том, что прибор собран |
|||||||||
а |
|
|
|||||||||
|
|
негерметично и для газа имеется другой выход, |
|||||||||
Н |
|
|
|
кроме газоотводной трубки. |
|
||||||
|
|
|
|
В промышленности для хранения газов |
|||||||
|
|
|
чаще всего используют более прочные сосу- |
||||||||
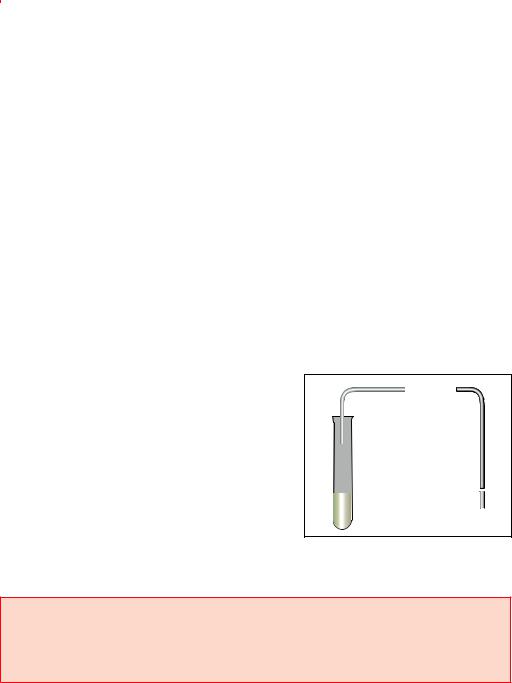
Рис. 71. Стальные бал- |
ды — баллоны (рис. 71), в которых сжатые |
||||||||||
лоны для хранения га- |
|||||||||||
зов |
|
|
|
газы находятся под большим давлением; для |
|||||||
|
Правообладатель Народная асвета |
||||||||||
Воздух как смесь газов |
99 |
|
предупреждения разрушения баллона сжатым газом его стенки делают из толстой стали. Узнать, какой газ содержится в баллоне, можно по окраске баллона, цвету надписи на нем и цвету полосы. Например, баллон с кислородом должен быть окрашен в голубой цвет и иметь черную надпись «Кислород», баллон с азотом должен быть окр шен в черный цвет, иметь желтую надпись «Азот» и коричневую полосу,
баллон с очень чистым аргоном должен быть окрашен в серый цвет, |
||||
иметь зеленую надпись «Аргон» и зеленую полосу. |
|
|
а |
|
|
т |
|||
Лабораторный опыт 4 |
|
|
||
|
е |
|
||
Сборка простейших приборов |
|
|||
|
|
|
||
для получения и собир ния г зов |
|
|
||
|
в |
|
|
|
1. Из имеющихся на вашем рабочем столе ч стей соберите один из |
||||
с |
|
|
|
|
приборов для получения газов в химической л бор тории, показанных |
|
на рисунке 72, а, б. |
а |
2. Укрепите прибор в шт тиве, проверьте его на герметичность. |
|
(Почему прибор следует проверять на герметичность перед началом |
||||||
|
|
|
|
|
|
я |
работы с газами? Как следует прове- |
||||||
рять прибор на герметич ость?) |
|
|||||
3. Соберите прибор |
|
|
а |
|||
|
ля собира ия |
|||||
газа методом вытеснения воз уха. (Как |
||||||
|
|
|
|
н |
|
|
следует расположить приемный сосуд |
||||||
длясобираниягаза, к т |
д |
|
|
|||
|
ыйлегчевозду- |
|||||
ха? Длягаза, кото ыйтяжелеевоздуха?) |
||||||
|
о |
|
|
|
||
4. Соберите п ибор для собирания |
||||||
газа методом вытеснения воды (ис- |
||||||
Н |
р |
|
|
|
|
|
пользуется для г зов, нерастворимых в |
Рис. 72. Простейшие приборы |
|
воде). |
а |
для получения газов |
Вещества могут находиться в газообразном, жидком или твердом агрегатном состоянии.
Воздух представляет собой смесь газов. Основными компонентами воздуха являются азот и кислород.
Правообладатель Народная асвета

100 Кислород
При нормальных условиях в воздухе объемом 100 дм3 содер- |
||||
жится азот объемом около 78 дм3 и кислород объемом около 21 дм3. |
||||
|
|
|
|
а |
Воздух можно условно рассматривать как газ, молярная масса |
||||
которого равна 29 г/моль. |
|
|
|
|
|
|
|
т |
|
Вопросы и задания |
|
е |
|
|
1. Назовите известные вам газы, которые входят в состав воз- |
||||
|
|
в |
|
|
духа. Какой из них имеет наибольшую массовую долю в воздухе? |
||||
2. Приведите примеры газов, входящих состав воздуха, ко- |
||||
торые легче его, тяжелее его. |
|
|
|
|
3. Может ли кислород быть жидким, а углекислый газ — твер- |
||||
дым? Поясните свой ответ. |
|
|
|
|
4. Почему газы в баллонах обычносхранят под большим дав- |
||||
лением? |
я |
|
|
|
а |
|
|
|
|
5. Две одинаковые по массе иапо объему колбы наполнили в
колб содержится кислород?
одинаковых условиях: одну — воздухом, а вторую — кислородом и герметично закрылинпробк ми. Как можно узнать, в какой из
атмосфере арг над. Рассчитайте объем (н. у.) воздуха, из которого можно выделитьр арг н массой 10 кг.
6. Относитель ая молекулярная масса углекислого газа рав-
на 44. Во сколько раз углекислый газ тяжелее воздуха?
7. Сваркуоалюминия и некоторых других металлов проводят в
доме. Р ссчитайте массу содержащегося в ней воздуха при нормальных условиях.
§ 20. Кислород и озон
8.аИзме ьте ширину, длину и высоту одной из комнат в вашем
Исторически так сложилось, что химический элемент и одно из
простыхвеществ, образованныхатомамиэтогоэлемента, имеютобщее |
|
названиеН |
— кислород. Поскольку между этими понятиями существует |
принципиальная разница, следует четко различать, о чем идет речь — о кислороде как о химическом элементе или о простом веществе.
Правообладатель Народная асвета
