
misc / 32846_e06b06cd6e9ad04f315d37bd4131ce33
.pdf
Составление уравнений химических реакций |
81 |
|
Вопросы и задания
1.Опишите опыт Ломоносова, который он проводил для исследования результатов прокаливания железа на воздухе. аКак был открыт закон сохранения массы веществ в химических ре кциях?
2.Почему массы веществ, вступивших в химическуютре кцию
иобразовавшихся в результате реакции, равны? е
3.В закрытой колбе нагрели немного жел зных опилок. Как изменилась их масса? Куда устремится воздухв, сли охладить колбу и открыть ее?
4.В результате прокаливания веществасHgO получается металлическая ртуть, масса которой меньшеама ы исходного вещества. Объясните почему.
5.Химическая реакция разложения вещества Cu(OH) протекает при нагревании по уравнениюя: Cu(OH)2 = CuO + H2O. 2Чего не хватает в данном уравнении?
6.На воздухе прокалили медьамассой 8 г. Какова будет масса продукта реакции: большенили меньше 8 г?
7.В химическую реакцию полностью вступили железо массой 5,6 г и сера массой 3,2дг. Какова масса продукта реакции?о
|
р |
а |
|
§ 16. Составление у авнений химических реакций |
|
Сост влять химические уравнения и производить расчеты по ним |
|
Н |
|
нужно, опир ясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород I соединение меди с кислородом.
Правообладатель Народная асвета

|
82 |
Химические реакции |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
т |
|
|
2 |
|
|
с |
е |
|
|
|||||||
Рис. 60. Схема реакции меди с кислородом |
|
|
|
|
|||||||||
|
|
|
|
|
|
а |
|
|
|
|
|||
Подобное выражение называют |
хемой химической реакции. За- |
||||||||||||
пишем эту схему при помощи химиче ких формулв |
: |
|
|
||||||||||
|
|
|
|
я |
|
|
|
|
|
|
|
|
|
|
|
|
|
Сu + О |
I СuО. |
|
|
|
|
||||
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают,
а происходит только их перегруппировка, то число атомов каждого |
|
|
н |
элемента до реакции и после реакции должно быть одинаковым. |
|
Чтобы уравнять число томов кислорода в левой и правой частях схе- |
|
мы, перед формулой CuOаставим коэффициент 2: |
|
о |
Сu + О2 I 2СuО. |
р |
|
Теперь число ат м в меди после реакции (в правой части схемы) |
|
равно двум, а до дреакции (в левой части схемы) — только одному, |
|
поэтому пе ед фо мулой меди Cu так же поставим коэффициент 2. В результ те п оизведенных действий число атомов каждого вида в левой и пр вой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
а |
2Сu + О2 =t 2СuО. |
НЭто уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой
Правообладатель Народная асвета

Составление уравнений химических реакций |
83 |
|
слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом
(углекислый газ): |
|
|
|
СН4 + O2 I СO2 + H2O. |
|
|
|
Обратите внимание, что в левой части схемы число |
томов угле- |
||
|
|
|
а |
|
|
т |
|
рода равно их числу в правой части. Поэтому уравнива ь нужно числа |
|||
атомов водорода и кислорода. Чтобы уравнять число а омов водорода, |
|||
поставим перед формулой воды коэффициент 2: |
е |
|
|
СН4 + O2 I СO2 + 2H2O. |
|
||
|
|
||
Теперь число атомов водорода справа тало 2 2 = |
4 и слева — |
||
также четыре. Далее посчитаем число атомов ки лорода в правой час- |
||||||
|
|
|
|
|
|
в |
ти схемы: два атома кислорода в молекуле углеки лого газа (1 2 = 2) |
||||||
|
|
|
я |
а |
|
|
и два атома кислорода в двух молекул х водыс(2 1 = 2), суммарно |
||||||
2 + 2 = 4. В левой части схемы кислорода только два атома в молекуле |
||||||
|
|
а |
|
|
|
|
кислорода. Для того чтобы уравн ть число атомов кислорода, поста- |
||||||
вим коэффициент 2 перед формулой кислорода: |
|
|||||
|
н |
|
|
|
|
|
СН4 |
|
t |
|
+ 2H2O. |
|
|
+ 2O2 = СO2 |
|
|||||
д |
|
|
|
|
|
|
В результате прове е |
ых ействий число атомов всех химических |
|||||
элементов до реакции равно их числу после реакции. Уравнение со-
ставлено. Читается |
|
но так: це-аш-четыре плюс два о-два равно |
|||||||||||
|
|
|
р |
|
|
|
|
|
|
|
|||
це-о-два плюс два аш-два-о (рис. 61). |
|||||||||||||
Данный спос б |
асстан вки коэффициентов называют методом |
||||||||||||
подбора. |
а |
о |
|||||||||||
|
|
|
|
||||||||||
|
Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 61. Схема реакции метана с кислородом
Правообладатель Народная асвета

84 Химические реакции
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Для составления уравнений химических ре кций необходимо соблюдать следующий порядок действий.
• Установить состав исходных веществ и продук ов ре кции. |
|||
• Записать формулы исходных веществ сл ва, продуктова |
реак- |
||
ции — справа. |
|
т |
|
|
|
|
|
• Между левой и правой частями ура н ния сначала поставить |
|||
стрелку. |
|
е |
|
• Расставить коэффициенты, т. е. ура нять числа атомов каж- |
|||
дого химического элемента до и по ле ревкции. |
|
||
• Связать левую и правую ч сти ур внения знаком «=» (равно). |
|||
|
с |
|
|
Вопросы и задания |
а |
|
|
|
|
|
|
1. Что обозначает схема химической реакции? Чем отличается |
|||
уравнение химической ре кции от ее схемы? |
|
||
2. Какие из приведенных з писей представляют собой схемы |
|||
я |
|
|
|
химических реакций, а какие — уравнения: |
|
|
|
а |
в) Ca(OH)2 + 2HCl = CaCl2 + 2H2O; |
||
a) CaCO3 = CaO + CO2[; |
|||
+ O2 I CO2[ + H2O; |
г) CS2 + O2 I CO2[ + SO2[? |
|
|
3. Перечислите сновные действия, которые необходимо со- |
|||
вершить, чт бы с ставить уравнение химической реакции. |
|
||
4. Составьте уравнения химических реакций, приняв во внима- |
|||
ние, что в об азующихся веществах азот проявляет валентность |
||
о |
|
|
р |
|
|
На2 |
2 |
2 |
б) KClO3 I KCl + O2; |
г) Al + O2 I Al2О3. |
|
6. Вставьте формулы исходных веществ или продуктов реак- |
||
ций и закончите уравнения химических реакций: |
||
a) HgO I Hg + ...; |
в) H2O I O2 + ...; |
|
б) Ca + O2 = ...; |
г) ... + Fe I FeCl3 . |
|
Правообладатель Народная асвета
Типы химических реакций |
85 |
|
7. Укажите верный ответ. Масса углекислого газа, образующегося при сгорании угля массой 10 г: а) больше 10 г; б) равна 10 г;
в) меньше 10 г. Обоснуйте свой выбор. |
а |
I |
8*. Расставьте коэффициенты в уравнении реакции: H2S + O2 |
||
|
т |
|
I SO2 + H2O. Определите химические количества исходных ве- |
||
ществ, если в результате реакции образовалась вода химическим количеством 8 моль.
§ 17. Типы химических реакций
Мир химических реакций весьма разнообразен. Самые различные |
||
|
|
е |
химические реакции постоянно происходят природе, осуществля- |
||
|
в |
|
с |
|
|
а |
|
|
ются человеком. Можно ли классифициров ть химические реакции?
Что положить в основу их классификации? Сущность всякой химичес-
кой реакции состоит в превращении веществ: р зрушаются исходные
вещества и образуются продукты реакций, меняется число и состав
исходных веществ и продуктов реакции. Характер этих изменений |
|||||||
и положен в основу классифик ции химических реакций. |
|||||||
Реакции соединения |
|
|
|
я |
|
||
|
|
|
|
|
|||
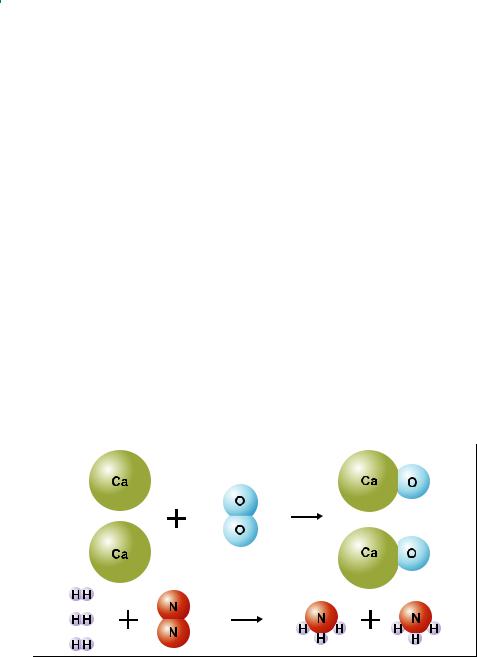
Рассмотрим уравнения следующих реакций (рис. 62): |
|||||||
|
|
|
|
|
а |
|
|
|
2Ca + O2 |
=t 2CaO; |
|
3H2 + N2 =t |
2NH3. |
||
|
|
|
|
н |
|
|
|
|
|
|
д |
|
|
|
|
|
|
о |
|
|
|
|
|
|
р |
|
|
|
|
|
|
а |
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
Рис. 62. Схемы реакций кальция с кислородом и азота с водородом
Правообладатель Народная асвета

86 Химические реакции
Чем сходны данные реакции между собой? Тем, что в результате взаимодействия двух веществ получается только одно вещество. Такие реакции получили название реакций соединения.
|
|
Реакции соединения — это реакции, в результ |
те которых из |
||||||||||||||||||
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
т |
||
|
|
двух или нескольких веществ образуется одно новое сложное |
|||||||||||||||||||
|
|
вещество. |
|
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
||||
В одних случаях из двух простых веществ получа сяаодно сложное, |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в |
|
|
|
|
в других — соединяются два и более простых или сложных веществ: |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2Ва + O2 = |
|
с |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
2ВаO; |
|
|
|
|
||||||
|
|
|
|
|
|
|
4NO2 + O2 |
+ 2H2O = 4HNO3; |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
||
|
|
|
|
|
|
|
SO3 + H2O = H2SO4 (рис. 63). |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
я |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
д |
|
|
|
|
|
|
|
|
|
|
|
||||
|
Рис. 63. Схема реакции соеди ения оксида серы(VI) с водой |
||||||||||||||||||||
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реакции разложения |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Рассм трим уравнения следующих реакций: |
|
|
|
||||||||||||||||||
|
|
|
р |
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
||
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ MnO2 + O2[; |
||
CaCO3 = CaO + CO2[; |
|
2KMnO4 = K2MnO4 |
|||||||||||||||||||
|
|
|
t |
|
|
+ O2[; |
|
|
|
|
|
|
t |
|
+ 3O2[. |
||||||
2HgO = 2Hg |
|
|
2KClO3 = 2KCl |
||||||||||||||||||
Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Можно з метить, что из одного сложного вещества получается
два или более новых веществ. Это реакции разложения. В них могут |
|
образовыватьсяа |
как простые, так и сложные вещества. |
Реакции разложения — это реакции, в результате которых из  одного сложного вещества образуется несколько новых веществ.
одного сложного вещества образуется несколько новых веществ.
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, негашеную известь CaO в промышлен-
Правообладатель Народная асвета

87
ности получают нагреванием известняка CaCO3, реакция разложения происходит при температуре около 1000 °С. К такому типу реакций относится и реакция разложения мета-
на CH4 (рис. 64) — составной части |
Рис. 64. Схема реакции р зложения |
|||
природного газа: |
метана |
|
|
а |
CH4 =t C + 2H2. |
|
|
||
|
т |
|||
|
|
|
||
|
|
е |
|
|
|
|
в |
|
|
купоросаопустимнебольшойкусочекжелеза—скнопку, гвоздь, канцелярскую скрепку с хорошо очищенной поверхностью. Через 2—3 мин
Реакции замещения
А могут ли взаимодействовать между обой д а ещества: одно
извлечем железо из раствора и увидим, чтоана его поверхности образовался темно-красный налет меди. В химическую реакцию вступили
простое и одно сложное? Проверим это на опыте. В раствор медного
простое(Fe) исложное(CuSO4) авеществая, иобразовалисьновоепростое (Cu) и новое сложное (FeSO4) вещества:
CuSO4 + Fe = FeSO4 + CuZ.
Из опыта и уравнения химической реакции хорошо видно, что ато-
мы железа заместили атомы ме и в сложном веществе (рис. 65). Такие |
||||||
|
|
|
|
|
н |
|
химические реакции тн сятся к реакциям замещения. |
||||||
|
|
|
|
д |
|
|
|
|
|
о |
|
|
|
|
|
р |
|
|
|
|
|
а |
|
|
|
|
|
|
Н |
|
|
|
|
|
Рис. 65. Реакция замещения железом меди в ее соли:
а — до реакции; б — во время реакции; в — после реакции
Правообладатель Народная асвета

88 Химические реакции
Реакции замещения — это реакции, в результате которых ато-  мы простого вещества замещают атомы одного из элементов в
мы простого вещества замещают атомы одного из элементов в
сложном веществе. |
а |
|
т |
Для протекания таких реакций необходимо соблюд ть некоторые особые условия. Не все простые вещества обяза ельно должны взаимодействовать со сложными веществами. В дальнейшем при изучении
химии вы познакомитесь с этими условиями, а также с другими типами |
||||||||||||||||||
химических реакций. |
|
|
|
|
|
в |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
с |
результатее |
которых из |
|||
Реакции соединения — это реакции, |
||||||||||||||||||
двух или нескольких веществ образует я одно новое сложное ве- |
||||||||||||||||||
щество. |
|
|
|
|
|
|
|
|
|
я |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реакции разложения — это ре кции, в результате которых из |
||||||||||||||||||
одного сложного вещества обр зуется несколько новых веществ. |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
|
|
Реакции замещения — это реакцииа, в которых атомы просто- |
||||||||||||||||||
го вещества замещают томы одного из элементов в сложном ве- |
||||||||||||||||||
ществе. |
|
|
|
|
|
|
н |
|
|
|
|
|
|
3 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
д |
|
|
|
|
|
|
|
|
|
|
|
Вопросы и зада ия |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
||
1. |
Перечислите извест ые вам типы химических реакций. |
|||||||||||||||||
2. |
Объясните, |
п чему масса известняка СаСО после прока- |
||||||||||||||||
|
|
р |
|
|
|
|
|
|
|
|
|
|
|
|
||||
ливания в |
|
ткрыт м сосуде уменьшается, а масса железа после |
||||||||||||||||
прокаливания на в здухе увеличивается. |
|
|
|
|
||||||||||||||
3. |
Расставьте коэффициенты в следующих схемах химических |
|||||||||||||||||
ре кций: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
) Al + O2 I Al2O3; |
|
|
г) SO3 |
I SO2 + O2; |
|
|
||||||||||||
б) Fe + Cl2 I FeCl3; |
|
|
д) HCl |
+ Mg I MgCl2 + H2; |
||||||||||||||
в) аC H |
|
O |
6 |
I C + H |
O; |
е) N |
2 |
+ H I NH |
. |
|
|
|||||||
|
6 |
12 |
|
|
|
2 |
|
|
|
|
2 |
3 |
|
|
|
|||
Выберите уравнения реакций соединения. |
|
|
|
|||||||||||||||
4. Укажите, к какому типу относятся реакции, схемы которых |
||||||||||||||||||
приведеныН |
, расставьте коэффициенты там, где это необходимо: |
|||||||||||||||||
а) Mg + O2 I MgO; |
|
|
в) H2O2 I H2O + O2; |
|
||||||||||||||
б) KNO3 I KNO2 + O2; |
г) HCl + Са I СаCl2 + H2. |
|||||||||||||||||
Правообладатель Народная асвета

Расчеты по уравнениям химических реакций |
|
|
|
|
|
89 |
|
|
5. Можно ли осуществить реакцию разложения железа на не- |
|
|||||||
сколько других веществ? Если нет, то почему? |
|
|
|
а |
|
|||
6. При нагревании газа иодоводорода HI образуется водород |
|
|||||||
H2 и газообразный иод I2. К какому типу принадлежит д нн я хи- |
|
|||||||
мическая реакция? Составьте ее уравнение. |
|
|
т |
|
||||
|
|
|
|
|
|
|||
7. При горении серы в кислороде образуется вещес во SO2. К |
|
|||||||
какому типу относится эта реакция? |
|
|
е |
|
|
|||
|
|
|
в |
|
|
|
|
|
8. Составьте уравнения химических реакций по сх мам, рас- |
|
|||||||
ставьте коэффициенты, укажите тип реакции: |
|
|
|
|
|
|
||
а) P + O2 I P2O5; |
|
с |
|
|
+ …; |
|
||
в) Al(OH)3 |
I Al2O3 |
|
||||||
б) Cu(OH)2 I CuO + H2O; |
г) CuO + Mg I MgO + … . |
|
||||||
§ 18. Расчеты по уравнениям химических ре кций |
|
|
|
|
||||
|
я |
|
|
|
|
|
|
|
Вещества вступают в химические ре кции в определенных мас- |
|
|||||||
|
а |
|
|
|
|
|
|
|
совых и количественных соотношени х. Следовательноа |
, при прове- |
|
||||||
дении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
Эти расчеты проводят по урав е иям реакций. Единицы величин,
которыми пользуются в химии, представлены в таблице 6. |
||||||||
|
|
|
|
|
н |
|
Таблица 6 |
|
|
|
|
Величина |
|
Обозначение |
|
Единица |
|
|
|
|
|
д |
|
|
|
|
Химическое количество вещества |
n |
|
моль |
|||||
|
|
|
о |
|
|
|
|
|
Относительн я молекуля ная (формульная) масса |
Mr |
|
1 |
|||||
|
|
р |
|
|
|
|
|
|
Молярн я м сса |
|
|
|
|
М |
|
г/моль |
|
|
а |
|
|
|
|
|
|
|
Масса |
|
|
|
|
m |
|
г |
|
|
|
|
|
|
|
|||
Число структурных единиц |
|
|
N |
|
1 |
|||
Н |
|
|
||||||
При проведении любого вычисления по |
уравнению реакции нужно |
|||||||
внимательно прочитать условие задачи. Особое внимание обратите на расстановку коэффициентов, так как соотношение числа структур-
Правообладатель Народная асвета

90 Химические реакции
ных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Химическое уравнение |
|
|
|
2H2 |
|
|
+ |
|
|
O2 |
= |
|
2H2O |
|
||||||||
Число молекул |
|
|
|
|
|
|
2 молекулы |
|
1 молекула |
|
2 молекулы |
|||||||||||
Химическое количество |
|
|
|
2 моль |
|
|
1 моль |
|
2 моль |
|
||||||||||||
Масса веществ |
|
|
|
|
|
|
|
|
4 г |
|
е |
|
|
36 г |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
32 г |
|
|
|
||||||||
Объемные соотношения |
|
|
2 22,4 дм3 |
|
|
22,4 дм3а |
|
— |
|
|||||||||||||
(для газообразных веществ) |
|
|
|
|
2 |
|
|
в |
1 |
|
|
|
— |
|
||||||||
|
|
|
|
|
|
: |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
12,04 |
|
с |
|
|
т23 |
|
12,04 10 |
23 |
|||||
Соотношение общего числа |
|
|
23 |
|
|
|
|
|||||||||||||||
|
|
10 |
|
6,02 |
10 |
|
|
|||||||||||||||
молекул (или ФЕ) |
|
|
|
|
|
|
|
|
2 |
|
|
: |
|
|
1 |
|
: |
|
2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
3 |
|
|
||
Для решения расчетной задачи необходим определенный порядок |
||||||||||||||||||||||
действий. Рассмотрим его на нескольких примерах. |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
я |
|
|
|
|
|
|
|
|
|
|
|
|
||
Пример 1. Железо массой 224 г полностью прореагировало |
||||||||||||||||||||||
с хлором. Рассчитайте массу образовавшегося вещества FeCl . |
|
|||||||||||||||||||||
Дано: |
|
|
|
|
|
|
а |
|
|
|
Решение |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
m(Fe) = 224 г |
|
|
|
|
1. Определяем химическое количество железа: |
|
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
m(FeCl3) — ? |
|
|
д |
|
|
|
|
A (Fe) = 56; |
|
|
|
|
|
|
||||||||
|
|
о |
|
|
|
|
|
|
|
r |
|
|
|
|
|
|
|
|
|
|||
|
|
|
М(Fe) = 56 г/моль; |
|
|
|
|
|
|
|
|
|||||||||||
|
n = |
m |
|
н m(Fe) |
|
|
|
224 г |
|
|
|
|
|
|
|
|
||||||
|
; |
n(Fe) = |
|
|
|
= |
|
|
|
|
= 4 моль. |
|
|
|
|
|||||||
|
р |
|
M |
|
|
M(Fe) |
|
|
|
56 г/моль |
|
|
|
|
|
|
||||||
а |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Записываем уравнение химической реакции. Подчеркиваем |
||||||||||||||||||||||
формулы инте есующих нас веществ: |
|
|
|
|
|
|
|
|
|
|||||||||||||
Н |
|
|
|
|
|
|
2Fe |
+ 3Cl2 = 2FeCl3. |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
3. Под их формулами записываем химические количества вступив- |
||||||||||||||||||||||
ших в реакцию и образовавшихся веществ: |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
2Fe + 3Cl2 = 2FeCl3. |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
2 моль |
|
|
|
2 моль |
|
|
|
|
|
|
|
|
|||
4. Над формулами веществ записываем известные и неизвестные величины по условию задачи:
Правообладатель Народная асвета
