
Базовий курс анестезіолога / Базовый курс анестезиолога
.pdf
Таблица 1. Дозировка, скорость наступления эффекта и продолжительность действия различных миорелаксантов
Препарат |
Доза (мг/кг) |
Начало действия (мин) |
Продолжительность (мин) |
|
Сукцинилхолин |
1,0–1,5 |
< 1 |
5–10 |
|
Тубокурарин |
0,5 |
3–5 |
30–50 |
|
Атракуриум |
0,5 |
2–3 |
20–30 |
|
Цисатракуриум |
0,1 |
2–3 |
30–40 |
|
Мивакуриум |
0,15–0,20 |
2–3 |
10–20 |
|
Панкурониум |
0,1 |
3–5 |
40–60 |
|
Векурониум |
0,1 |
2–3 |
20–30 |
|
Рокурониум |
0,6 |
1–2 |
30–40 |
|
|
|
|
|
•Адекватные условия для интубации трахеи достигаются через 60–90 секунд после введения рокурониума в индукционной дозе 0,6 мг/кг. Рокурониум характеризуется промежуточной продолжительностью действия, метаболизируется в печени и экскретируется с желчью.
•Препарат оказывает минимальное влияние на сер дечно-сосудистую систему и не вызывает гистамино либерации, однако при его использовании наблюдается более высокая частота анафилактических реакций, чем при использовании других аминостероидных МР.
ИНГИБИТОРЫ ХОЛИНЭСТЕРАЗЫ
Антихолинэстеразные препараты (также известны как ингибиторы ацетилхолинэстеразы, АХЭ) — препараты, подавляющие ферментативную активность АХЭ на уровне нейромышечного соединения. Ингибирование АХЭ ведет к снижению распада АХ и усиливает его действие.
Ингибиторы АХЭ используются в анестезиологии для прекращения действия недеполяризующих МР (реверсия блока, декураризация). Реверсия миорелаксации, как правило, проводится в конце вмешательства и не должна предприниматься до тех пор, пока не началось спонтанное разрешение блока. Преждевременное назначение ингибиторов АХЭ может оказаться неэффективным в связи с тем, что большое число рецепторов все еще заблокировано. Реверсия МР промежуточной длительности действия может проводиться по меньшей мере спустя 20 минут от последнего введения препарата. При использовании периферической нейростимуляции попытка декураризации может быть предпринята, если TOF-тест демонстрирует наличие по меньшей мере двух сокращений в серии (из четырех возможных). Наиболее надежным признаком того, что блок полностью устранен при помощи ингибиторов АХЭ, является устойчивый ответ на тетаническую стимуляцию (т. е. затухания ответа не наблюдается). Вместе с тем тетаническая стимуляция может быть болезненной при проведении у пациентов, находящихся в сознании. Клинические признаки адекватного устранения нейромышечного блока включают способность поднять голову от поверхности стола (кровати) и удерживать ее в поднятом состоянии в течение 5 секунд. Тем не менее клиническая оценка является менее надежной, чем указанные инструментальные тесты.
Ингибиторы АХЭ будут усиливать блок фазы I, вызванный деполяризующими МР, в связи с чем эти препараты не могут устранить блок, вызванный суксаметониумом.
Побочные эффекты антихолинэстеразных препаратов
Ингибиторы АХЭ вызывают накопление АХ, что ведет к усиленной стимуляции мускариновых рецепторов. Избыточная стимуляция может вызвать брадикардию, миоз, диспепсию, тошноту, бронхоспазм, усиление бронхиальной секреции, потливость и саливацию. В связи с этим для минимизации подобных нежелательных изменений вместе с ингибиторами АХЭ назначают блокаторы M-рецепторов, такие как гликопиррониум (гликопирролат) или атропин.
Антихолинэстеразные препараты
Неостигмин
•Этот представитель ингибиторов АХЭ наиболее ши- роко используется в анестезиологии. Неостигмин представляет собой водорастворимое четвертичное аммониевое соединение, которое способно обратимо связываться с эстеразной группой АХЭ, что делает фермент неактивным приблизительно на протяжении 30 минут.
•Неостигмин вводится внутривенно болюсно в дозе
0,05 мг/кг (максимально до 5 мг) вместе с гликопиррониумом (0,01 мг/кг) или атропином (0,02 мг/кг). Эффект неостигмина развивается приблизительно через 2 минуты с достижением максимума на 5–7-й минуте. Препарат экскретируется в неизмененном виде почками; период полувыведения составляет около 45 минут.
Эдрофониум
•Этот препарат образует ионную связь с анионной
группой АХЭ. Связь носит обратимый характер, она весьма кратковременна и распадается всего за несколько минут.
•Эдрофониум используется для проведения диа- гностического теста при подозрении на миастению (myasthenia gravis). При этом аутоиммунном заболевании увеличение количества АХ, вызванное препаратом, вызывает транзиторное усиление мышечной силы.
•Эдрофониум редко применяется для реверсии эф- фекта недеполяризующих МР, поскольку его эффект носит кратковременный характер, при этом после начальной декураризации блок может вновь уси литься (рекураризация).
130 |
World Federation of Societies of Anaesthesiologists | WFSA |
Пиридостигмин
•Этот препарат отличается от неостигмина более
поздним началом действия, однако продолжительность его действия составляет несколько часов. Препарат часто используется для лечения миастении.
Физостигмин
•Также,какнеостигминипиридостигмин,физостиг- мин обратимо действует на эстеразный центр АХЭ.
•Физостигмин лучше растворим в жирах, чем дру- гие представители этой группы. Он всасывается из ЖКТ и пересекает гематоэнцефалический барьер.
Фосфорорганические соединения
•Представители этой группы могут встречаться сре- ди пестицидов и боевых отравляющих средств.
•Фосфорорганические соединения образуют необра- тимую связь с АХЭ, при этом восстановление может произойти только после образования новых молекул фермента, что занимает длительное время — до
нескольких недель. Отравление сопровождается саливацией, обильным потоотделением, брадикардией, бронхоспазмом и мышечной слабостью.
•Терапия включает введение атропина и поддержи- вающие мероприятия.
ПРОЧИЕ «РЕВЕРСИВНЫЕ» ПРЕПАРАТЫ
Сугаммадекс (торговое название BridionTM. — Прим. редактора) — новый препарат, разработанный для селективного устранения эффектов аминостероидных МР, в частности рокурониума (ЭсмеронTM). Являясь высокомолекулярным циклодекстриновым соединением, сугаммадекс быстро связывает рокурониум и прекращает его эффект.
ДЛЯ ДАЛЬНЕЙШЕГО ЧТЕНИЯ
1.Pete Ricketts. Malignant hyperthermia. Update in Anaesthesia 2008; 24: 13–17.
2.Ackroyd C, Gwinnutt C. Physiology of the neuromuscular junction. Update in Anaesthesia (2008); 24: 38–40.
Базовый курс анестезиолога | Basic Sciences |
131 |

8
Фармакология
Содержание
Парацетамол широко применяется при лечении острой и хронической боли. Пероральная и ректальная формы парацетамола в клинике используются уже давно, и вот относительно недавно стала доступной и внутривенная его форма. В этой статье представлены основные пути назначения этого анальгетика и обсуждаются преимущества каждого из них в периоперационном периоде.
Chris Oscier
Specialist Trainee
Nicki Bosley
Specialist Trainee
Quentin Milner
Consultant,
Department of
Anaesthesia
Royal Devon and Exeter
NHS Foundation Trust
Exeter EX2 5DW,
UK
Парацетамол:
три способа введения
Крис Осье*, Ники Босли и Квентин Мильнер
* E-mail: chrisocier@hotmail.com
ВВЕДЕНИЕ
Сравнительно высокая стоимость, медленное наступление эффекта и вариабельная биодоступность делают ректальные формы парацетамола менее привлекательными на фоне внутривенных препаратов.
Принимая в расчет схожую стоимость, внутривенный парацетамол должен рассматриваться как более эффективная форма по сравнению с суппозиториями в тех ситуациях, когда пероральное назначение невозможно. Также внутривенное введение может быть выгодным в тех случаях, когда необходимо быстрое наступление анальгезии, поскольку в этом случае таблетированная форма может не дать нужного эффекта. Пероральные формы парацетамола являются простым и хорошо переносимым анальгетиком, однако для создания необходимой ранней концентрации препарата в плазме могут потребоваться более высокие, чем обычно, дозы. Внутривенное введение позволяет быстро достигнуть терапевтической концентрации. В дальнейшем концентрация может поддерживаться при помощи абсорбции пероральных форм препарата из ЖКТ.
МЕХАНИЗМ ДЕЙСТВИЯ
Несмотря на то, что о великолепных анальгетических свойствах парацетамола известно уже более ста лет, механизм его действия остается по-прежнему неясным и остается предметом активного изучения. В отличие от нестероидных противовоспалительных препаратов (НСПВП), чьи анальгетический и противовоспалительный эффекты, как полагают, реализуются через блокаду ферментов циклоокси- геназы-1 и циклооксигеназы-2 (ЦОГ-1, ЦОГ-2), парацетамол относится к слабым противовоспалительным препаратам с полным отсутствием побочных эффектов, обусловленных блокадой ЦОГ. Экспериментальные исследования показали, что при наличии в окружающих тканях невысоких концентраций арахидоновой кислоты и перекисей парацетамол способен блокировать и ЦОГ-1, и ЦОГ-2. При повышении же внеклеточных концентраций этих соединений на фоне воспаления, например
при ревматоидном артрите, наблюдается резкое снижение противовоспалительной и ан-
тиагрегационной активности парацетамола in vivo.1
Показано, что парацетамол проявляет свой анальгетический эффект за счет молекулярных механизмов, не имеющих отношения к циклооксигеназному пути. В головном и спинном мозге парацетамол связывается с арахидоновой кислотой с образованием N-арохидонофеноламина (AM404).2 AM404 является известным активатором систем капсаициновых (TRPV1) и канабиноидных (CB1) рецепторов, отвечающих в центральной нервной системе как раз за анальгетический ответ. Этот механизм действия также может объяснять и жаропонижающий эффект парацетамола, реализуемый, как известно, за счет блокады синтеза простагландинов в мозговых структурах.3 В эксперименте на крысах было обнаружено, что при лихорадке уровень простагландинов в ликворе повышается. После назначения парацетамола наряду со снижением температурной реакции снижается и концентрация простагландинов в ликворе.4 Однако и на сегодняшний день данная связь остается пока лишь гипотезой.
АНАЛЬГЕТИЧЕСКАЯ ЭФФЕКТИВНОСТЬ
Ни для кого не секрет, что парацетамол обладает великолепными анальгетическими свойствами и характеризуется наилучшим из всех анальгетиков профилем безопасности. В одном из недавних кохрэйновских систематических обзоров проведен анализ 47 исследований, посвященных терапии послеоперационной боли парацетамолом. Суммарно результаты применения пероральной формы препарата были проанализированы у 4186 пациентов. Авторы установили, что показатель NNT (number needed to treat — число пациентов, которое необходимо пролечить препаратом для достижения одного желаемого результата) у парацетамола для достижения 50% снижения интенсивности болевого синдрома более чем на 4–6 часов составлял 3,8 (95%
132 |
World Federation of Societies of Anaesthesiologists | WFSA |

NNT (number needed to treat) — показатель, отражающий возмож- |
незначительно подвергается эффекту первичного про- |
||||
ные результаты терапии, использованной в клиническом исследо- |
хождения через печень (см. сноску). Биодоступность па- |
||||
вании. Он показывает то число пациентов, которое необходимо |
рацетамола при пероральном применении составляет |
||||
оценить для получения одного желаемого результата. |
63–89%. В двух недавних исследованиях сравнивалось |
||||
95%-й доверительный интервал свидетельствует о надежности |
|||||
пероральное и внутривенное введение препарата. Так, |
|||||
результатов исследования. Если повторить данное исследование |
например, в исследовании, включавшем 35 пациентов, |
||||
100 раз, то в 95 случаях будет получен результат в пределах дан- |
|||||
оперированных в стационаре одного дня, продемон- |
|||||
ного доверительного интервала. Большие исследования дают бо- |
|||||
лее узкие доверительные интервалы, которые будут более точно |
стрировано, что внутривенный пропарацетамол (вну- |
||||
отражать действительность. Общепринятым уровнем достоверно- |
тривенное пролекарство парацетамола) обеспечивает |
||||
сти, свидетельствующим о том, что результаты исследования отра- |
более быстрое и предсказуемое достижение необходи- |
||||
жают истинный лечебный эффект, является именно 95% (не больше |
|||||
мой плазменной концентрации парацетамола, чем пе- |
|||||
и не меньше). |
|
|
|
||
Плацебо — фармакологически инертное вещество, которое может |
роральная форма препарата.11 |
||||
В течение первых 80 минут у всех пациентов оцени- |
|||||
оказать лечебные действие, основанное исключительно на силе |
|||||
внушения. Данный феномен известен как «эффект плацебо». В ис- |
вали плазменную концентрацию парацетамола после |
||||
следованиях фармакологические эффекты препаратов оценивают- |
внутривенного введения 2 г и после перорального при- |
||||
ся при сравнении их с плацебо. |
|
|
|
||
|
|
|
ема 1 или 2 г. Было установлено, что при внутривенном |
||
|
|
|
|
||
доверительный интервал 3,4–4,4). |
5 |
Также не было вы- |
введении концентрация препарата в крови достигает |
||
|
средних значений терапевтического диапазона уже че- |
||||
явлено разницы в частоте развития побочных эффектов |
|||||
рез 20 минут. При пероральном приеме препарата выяв- |
|||||
между парацетамолом и плацебо. |
|
|
|
||
|
|
|
лена значительная вариабельность и непредсказуемость |
||
Побочные эффекты при использовании парацетамо- |
|||||
начального этапа фармакокинетики парацетамола. У |
|||||
ла возникают крайне редко, они обычно незначительны |
|||||
пациентов, получавших 1 г препарата перорально, за 80 |
|||||
и имеют преходящий характер. К примеру, при примене- |
|||||
минут не удавалось достичь необходимого плазменно- |
|||||
нии его в обычных терапевтических дозах частота раз- |
|||||
го уровня, а средняя плазменная концентрация пара- |
|||||
вития печеночной дисфункции составляет менее 1 слу- |
|||||
цетамола при этой дозе была субтерапевтической. При |
|||||
чая на 500 000.6 Известно лишь два противопоказания |
|||||
пероральном приеме 2 г парацетамола средняя терапев- |
|||||
для назначения парацетамола: гиперчувствительность |
|||||
тическая концентрация достигается через 40 минут, что |
|||||
к препарату и тяжелая печеночная недостаточность. |
|||||
подтверждает, что при таком режиме применения пре- |
|||||
Препарат отличает низкая частота лекарственных вза- |
|||||
парата начальная доза уменьшает время достижения не- |
|||||
имодействий. Безопасно его применение и у кормящих |
|||||
обходимой терапевтической концентрации.12 |
|||||
грудью женщин. Как было показано, парацетамол имеет |
Клинически эти различия показывают, что при вну- |
||||
сходную с ибупрофеном и диклофенаком анальгетиче- |
|||||
тривенном введении парацетамола анальгетический |
|||||
скую активность при полостных операциях и в ортопе- |
|||||
дии7 и обладает опиоидсберегающим эффектом, т. е. |
эффект развивается наиболее быстро. Внутривенный |
||||
способен значительно уменьшить послеоперационный |
парацетамол значительно быстрее купировал болевой |
||||
синдром по сравнению с пероральным.13 Среднее время |
|||||
расход наркотических анальгетиков. |
8 |
||||
|
наступления обезболивания при инфузии пропацетамо- |
||||
|
|
|
|
||
ПУТЬ ВВЕДЕНИЯ |
|
|
|
ла составляло 8 минут, в то время как при пероральном |
|
Известно, что при плазменной концентрации 10–20 |
применении оно равнялось 37 минутам. Максимальный |
||||
мкг/мл парацетамол вызывает жаропонижающий эф- |
же анальгетический эффект при внутривенном введе- |
||||
фект. Вместе с тем концентрация препарата, необходи- |
нии препарата развивался через 15 минут, а при перо- |
||||
мая для обеспечения анальгетического эффекта, точно |
ральном — только через час. |
||||
не определена.9 В одном исследовании, в котором 120 |
Ректальное введение |
||||
детям после тонзилэктомии назначали парацетамол пе- |
|||||
Абсорбция парацетамола при его ректальном приме- |
|||||
рорально или в свечах, было показано, что необходимая |
|||||
нении более непредсказуема. При использовании свечей |
|||||
для снижения и поддержания боли на уровне менее 4 |
|||||
биодоступность парацетамола составляет от 24 до 98%. |
|||||
баллов из 10 концентрация препарата должна быть рав- |
|||||
|
|||||
ной 10 мкг/мл.10 Вместе с тем есть сообщения как о более |
Эффект первичного прохождения заключается в том, что лекар- |
||||
высоких, так и более низких концентрациях, требую- |
ственный препарат, принятый перорально, абсорбируясь в кишеч- |
||||
щихся для адекватного обезболивания.11, 12 Существует |
нике, поступает в портальную систему и затем в печень, где мо- |
||||
определенная разница в скорости абсорбции и време- |
жет частично метаболизироваться еще до достижения им цели. |
||||
Первичному прохождению не подвергаются препараты, назначае- |
|||||
ни достижения пиковой концентрации парацетамола в |
|||||
мые сублингвально, внутримышечно или внутривенно. |
|||||
плазме при его пероральном, ректальном и внутривен- |
Пероральная биодоступность отражает то количество от общей, |
||||
ном назначении. Адекватной плазменной концентрации |
принятой перорально дозы препарата, которое достигает систем- |
||||
препарата можно добиться при любом пути введения, |
ного кровотока, при сравнении с той же дозой, введенной внутри- |
||||
но все же внутривенная инфузия позволяет достичь не- |
венно. Биодоступность внутривенно вводимых препаратов равна |
||||
обходимого уровня за более короткое время. |
100%. |
||||
Пропрепарат — неактивная форма препарата, которая перево- |
|||||
Пероральный прием |
|
|
|
||
|
|
|
дится в организме пациента в активную форму. Обеспечивает воз- |
||
После приема внутрь парацетамол быстро абсор- |
можность введения препаратов, которые при системном введении |
||||
бируется из желудочно-кишечного тракта. Препарат |
в активной форме могут проявлять токсичность. |
||||
|
|||||
Базовый курс анестезиолога | Basic Sciences |
133 |
Вариабельность скорости и степени абсорбции параце- |
парацетамола у 24 женщин после малых лапароскопиче- |
|
тамола в свечах, как полагают, зависит от ряда факто- |
ских гинекологических операций было установлено, что |
|
ров, и прежде всего — от вида и свойств используемых |
при ректальном использовании 2 грамм препарата сред- |
|
свечей. Липофильная основа свечей обеспечивает луч- |
няя плазменная концентрация через 4 часа была ниже |
|
шую биодоступность парацетамола, чем гидрофильная. |
минимального анальгетического уровня и составляла |
|
Скорость абсорбции парацетамола также зависит от раз- |
8,4 мкг/мл при диапазоне 4,2–16,3 мкг/мл.18 |
|
мера, количества использованных свечей и количества |
Медленное достижение терапевтического уровня |
|
самого препарата в свече.14 Уровень pH в прямой кишке |
плазменной концентрации при ректальном назначении |
|
также оказывает влияние на абсорбцию парацетамола за |
парацетамола исключает применение данного способа |
|
счет изменения степени диссоциации и соответственно |
в качестве метода выбора для раннего послеоперацион- |
|
способности препарата к трансмембранному проникно- |
ного периода. Hein et al. провели двойное слепое рандо- |
|
вению. У детей pH прямой кишки может варьировать от |
мизированное исследование, включившее 140 женщин, |
|
7,8 до 11,4. Степень же диссоциации парацетамола при |
подвергающихся прерыванию беременности.19 После |
|
таком диапазоне рН равна 2–99%.15 |
вмешательства пациентки были рандомизированы на |
|
В большом числе исследований показано, что время |
две группы. У одних ректально использовали парацета- |
|
достижения терапевтической концентрации парацета- |
мол в дозе 1 г, в другой группе пациентки получали све- |
|
мола в плазме при ректальном его назначении значи- |
чи с плацебо. Между группами не было выявлено досто- |
|
тельно больше, чем при пероральном или внутривенном |
верной разницы ни в выраженности болевого синдрома |
|
применении. При применении препарата у здоровых до- |
после операции, ни в потребности в дополнительном |
|
бровольцев в дозах 15 мг/кг, 25 мг/кг, 35 мг/кг и 45 мг/кг |
обезболивании, ни во времени выписки из стационара. |
|
было установлено, что только дозы 35 мг/кг и 45 мг/кг |
Внутривенное введение |
|
обеспечивают поддержание плазменной концентрации |
||
Парацетамол для внутривенного введения прежде |
||
препарата выше минимального терапевтического уров- |
||
был доступен в виде своего пропрепарата пропацетамо- |
||
ня (10 мкг/мл) на протяжении длительного промежут- |
||
ла. Пропацетамол используется во Франции с 1985 года. |
||
ка времени (5,5 и 6 часов в среднем соответственно).16 |
||
Он представляет собой водорастворимый порошок, чей |
||
Данное значение концентрации достигалось не ранее, |
||
раствор при внутривенном введении немедленно под- |
||
чем через 1–2 часа. При дозе 15 мг/кг средние значения |
||
вергается гидролизу плазменными эстеразами с обра- |
||
концентрации парацетамола в плазме на протяжении |
||
зованием парацетамола и диэтилглицина. Из одного |
||
всего периода наблюдения не превышали 10 мкг/мл, тог- |
грамма пропацетамола образуется 0,5 г парацетамола. |
|
да как при использовании 25 мг/кг средние концентра- |
Анальгетические свойства пропацетамола хорошо |
|
ции парацетамола в плазме поддерживались в пределах |
||
известны. В двойном слепом исследовании, 200 жен- |
||
нижних границ терапевтического диапазона. Риска раз- |
||
щин, перенесших гинекологические операции, были |
||
вития передозировки при применении максимальной |
||
рандомизированы на две группы. В одной группе ис- |
||
нагрузочной дозы (45 мг/кг) не было, поскольку наибо- |
||
пользовали двукратное введение пропацетамола в дозе |
||
лее высокая концентрация препарата в плазме, отме- |
||
2 г, а во второй группе применяли 30 мг кеторолака.20 |
||
ченная в ходе исследования, составляла 25 мкг/мл, что |
Дополнительно в каждой из групп использовали вну- |
|
существенно меньше 120 мкг/мл, общепринятой токси- |
||
тривенную анальгезию морфином (контролируемую |
||
ческой границы. |
||
пациентом). Оценка велась на протяжении первых 12 |
||
В исследовании, проведенном на 23 детях, опериро- |
||
часов после операции. Было выявлено, что эффект про- |
||
ванных в клинике общей хирургии, свечи с парацетамо- |
пацетамола сопоставим с кеторолаком и в отношении |
|
лом вводились каждые 6 часов (доза 25 мг/кг). Результаты |
анальгетической активности, и по снижению потребле- |
|
исследования показали значительную вариабельность |
ния морфина. В исследовании на пациентах, подверг- |
|
как скорости абсорбции, так и плазменной концентра- |
шихся стоматологическим операциям, пропацетамол |
|
ции препарата.15 Среднее время, необходимое для до- |
был достоверно лучше плацебо по всем оцениваемым |
|
стижения 90% уровня устойчивой концентрации, со- |
параметрам: снижение интенсивности боли, длитель- |
|
ставило 11,4 часа. |
ность анальгетического эффекта и общая оценка паци- |
|
В одном рандомизированном исследовании, вклю- |
ентом.13 При сравнении пропацетамола и диклофенака |
|
чавшем 48 пациентов, оперированных на сердце17, по- |
установлено, что при эндопротезировании тазобедрен- |
|
ловина больных получала парацетамол внутривенно, а |
ного сустава оба препарата обладают одинаковой эф- |
|
другой половине он назначался в свечах. При внутри- |
фективностью, и при этом значительно большей, чем |
|
венном введении 1 г парацетамола плазменная концен- |
плацебо.21 И хотя пропацетамол является эффективным |
|
трация достигала своего пикового значения в 14,4 мкг/ |
анальгетиком, при его использовании существует риск |
|
мл в течение 20 минут, в то время как после применения |
развития ряда побочных эффектов. К примеру, почти |
|
1 г парацетамола в свечах средняя плазменная концен- |
49% пациентов испытывали болевые ощущения в зоне |
|
трация через 80 минут была всего лишь 1,2 мкг/мл. Даже |
его внутривенного введения.22 Кроме того, есть сообще- |
|
после третьей дозы парацетамола в свечах не было до- |
ния о случаях развития контактного дерматита на про- |
|
стигнуто стабильной плазменной концентрации в пре- |
пацетамол у медперсонала. |
|
делах терапевтического диапазона. Аналогичным об- |
Парацетамол, предназначенный для внутривенно- |
|
разом при сравнении пероральной и ректальной форм |
го введения (PerfalganTM), представляет собой готовый |
134 |
World Federation of Societies of Anaesthesiologists | WFSA |

Таблица 1. Стоимость различных форм парацетамола24 |
|
где пероральное назначение препарата невозможно или |
|||
Способ введения |
Стоимость за 1 грамм* |
будет неадекватным, например, в раннем послеопера- |
|||
|
|
|
ционном периоде. Внутривенный парацетамол игра- |
||
Пероральный |
£0,02 |
|
|||
|
|
|
ет важную роль и в ситуациях, где требуется создание |
||
Внутривенный |
£1,50 |
|
|||
|
|
|
быстрого анальгетического эффекта. Назначение па- |
||
Ректальный |
£1,98 |
|
|||
|
|
рацетамола перорально в этих условиях также не даст |
|||
* На март 2010 г. 1 фунт стерлингов (£) ≈ 49 рублей (прим. редактора). |
|||||
|
|
|
необходимого результата. Пероральный парацетамол |
||
к применению водорастворимый препарат (10 мг/мл) |
является простым и безопасным анальгетиком, но для |
||||
более быстрого достижения терапевтической плазмен- |
|||||
во флаконах по 50 или 100 мл, рассчитанный на введе- |
|||||
ной концентрации при его применении требуется очень |
|||||
ние в течение 15 минут. Проблема растворимости па- |
|||||
высокая начальная доза препарата. При внутривенном |
|||||
рацетамола в воде была решена за счет использования |
|||||
же введении парацетамола очень быстро достигается |
|||||
специальных гидрофильных ингредиентов — манни- |
|||||
его необходимая плазменная концентрация в крови, ко- |
|||||
тола и фосфата динатрия, а также особого метода при- |
|||||
торую впоследствии можно поддерживать перорально. |
|||||
готовления раствора. Для предотвращения быстрого |
|||||
|
|
||||
гидролиза раствора с образованием весьма токсичного |
ЛИТЕРАТУРА |
||||
азотистого соединения 4-аминофенола рН препарата |
|||||
доведен до нейтрального значения 5,5. Хранение препа- |
1. |
Graham G, Scott K. Mechanism of action of paracetamol. American |
|||
|
Journal of Therapeutics 2005; 12: 46–55. |
||||
рата в стеклянных флаконах предотвращает его окисле- |
|
||||
2. |
Bertolini A, Ferrari A. Paracetamol: New vistas of an old drug. CNS Drug |
||||
ние. Преимущества внутривенного парацетамола перед |
|||||
|
Rev 2006; 12: 250–275. |
||||
пропацетамолом заключаются в отсутствии раздража- |
3. |
Flower RJ, Vane JR. Inhibition of prostaglandin synthetase in brain ex- |
|||
ющего действия на сосудистую стенку и отсутствии ри- |
|
plains the antipyretic activity of paracetamol (4-acetaminophenol). |
|||
ска развития контактного дерматита. Парацетамол био- |
|
Nature 1972; 240: 410–411. |
|||
эквивалентен пропацетамолу.23 |
4. Aronoff D, Neilson E. Antipyretics: mechanism of action & clinical use in |
||||
Немало исследований продемонстрировало сходную |
|
fever suppression. American Journal of Medicine 2001; 111: 304–315. |
|||
5. |
Barden J, Edwards J. Single dose oral paracetamol (acetaminophen) for |
||||
эффективность парацетамола и пропацетамола. Два не- |
|||||
|
postoperative pain. Cochrane Database of Systematic Reviews 2006; Issue 1. |
||||
давних рандомизированных, двойных слепых, плацебо- |
|
||||
6. |
Sinatra R, Jahr J et al. Efficacy and safety of single and repeated admin- |
||||
контролированных исследования не выявили никакой |
|||||
|
istration of 1 gram intravenous acetaminophen injection (paracetamol) |
||||
разницы между внутривенным парацетамолом и про- |
|
for pain management after major orthopaedic surgery. Anaesthesiology |
|||
пацетамолом при применении их в ортопедии и стома- |
|
2005; 102: 822–831. |
|||
тологии.6, 22 Оба препарата значительно превосходили |
7. Hyllested M, Jones S et al. Comparative effect of paracetamol, NSAIDs or |
||||
плацебо по анальгетическому действию, времени перво- |
|
their combination in postoperative pain management: a qualitative re- |
|||
|
view. Br J Anaesth 2002; 88: 199–214. |
||||
го назначения морфина и общему опиоид-сберегающему |
|
||||
8. |
Remy C, Marret E et al. Effects of acetaminophen on morphine side-ef- |
||||
эффекту. В обоих исследованиях было показано, что по |
|||||
|
fects and consumption after major surgery: Meta-analysis of randomized |
||||
частоте развития побочных эффектов внутривенный |
|
||||
|
controlled trials. Br J Anaesth 2005; 94: 505–513. |
||||
парацетамол практически сходен с плацебо, а местного |
9. Rumack B. Aspirin versus acetaminophen: A comparative view. Paediatrics |
||||
раздражающего действия при его введении не было от- |
|
1978; 62: 943–946. |
|||
мечено ни в одном случае. |
|
|
10. |
Anderson B, Holford N et al. Perioperative pharmacodynamics of aceta- |
|
РЕЗЮМЕ |
|
|
|
minophen analgesia in children. Anaesthesiology 1999; 90: 411–421. |
|
|
|
11. |
Holmer-Pettersson P, Owall A et al. Early bioavailability of paracetamol |
||
Несоразмерная стоимость, медленное начало дей- |
|
after oral or intravenous administration. Acta Anaesthesiol Scand 2004; |
|||
ствия и значительная вариабельность биодоступности |
|
48: 867–870. |
|||
отодвигают ректальную форму парацетамола при нали- |
12. |
Anderson B, Holford N. Rectal paracetamol dosing regimens: Determina |
|||
чии внутривенной на второй план. Внутривенное вве- |
|
tion by computer simulation. Paediatr Anaesth 1997; 7: 451–455. |
|||
13. |
Moller P, Sindet-Pedersen S et al. Onset of acetaminophen analgesia: |
||||
дение парацетамола необходимо рассматривать в каче- |
|||||
|
Comparison of oral and intravenous routes after third molar surgery. Br J |
||||
стве метода выбора перед ректальным в тех ситуациях, |
|
||||
|
Anaesth 2004; 94: 642–648. |
||||
|
|
|
14. Ward B, Alexander-Williams JM. Paracetamol revisited: A review of the |
||
Анальгезия, контролируемая |
пациентом (АКП), — методика |
|
pharmacokinetics and pharmacodynamics. Acute Pain 1999; 2: 140–149. |
||
15. |
Hahn T, Henneberg S. Pharmacokinetics of rectal paracetamol after re- |
||||
обезболивания, при которой для внутривенного введения опиоид |
|||||
|
peated dosing in children. Br J Anaesth 2000; 85: 512–519. |
||||
ного анальгетика используется специальный программируемый |
|
||||
16. |
Stocker M, Montgomery J. Serum paracetamol concentrations in adult |
||||
перфузор. При нажатии пациентом кнопки требования на дистан- |
|||||
ционном устройстве ему посылается «болюсная доза» анальгетика, |
|
volunteers following rectal administration. Br J Anaesth 2001; 87: 638– |
|||
например 1 мг морфина, которая предварительно определяется |
|
640. |
|||
и устанавливается врачом. Для безопасности пациента и предот- |
17. Holmer-Pettersson P, Jakobsson J et al. Plasma concentrations following |
||||
вращения непреднамеренной передозировки в данном аппарате |
|
repeated rectal or intravenous administration of paracetamol after heart |
|||
также предусмотрена возможность программирования «времени |
|
surgery. Acta Anaesthesiol Scand 2006; 50: 673. |
|||
закрытия», или локаут-интервала, во время которого ни одно нажа- |
18. |
Hahn T, Mogensen T et al. High-dose rectal and oral acetaminophen |
|||
тие пациентом на кнопку не приведет к введению очередной дозы |
|||||
|
in postoperative patientsserum and saliva concentrations. Acta |
||||
препарата. При АКП морфином обычно устанавливают 5-минутный |
|
||||
|
Anaesthesiol Scand 2000; 44: 302–306. |
||||
локаут-интервал. |
|
|
|
||
|
|
19. |
Hein A, Jakobsson J et al. Paracetamol 1 g given rectally at the end of mi- |
||
Биоэквивалентность лекарственных веществ подразумевает их |
|||||
|
nor gynaecological surgery is not efficacious in reducing postoperative |
||||
схожесть между собой по биодоступности и эффективности. |
|
pain. Acta Anaesthesiol Scand 1999; 43: 248–251. |
|||
Базовый курс анестезиолога | Basic Sciences |
135 |
20.Varrassi G, Marinangeli F et al. A double-blinded evaluation of propacetamol versus ketorolac in combination with patient controlled analgesia morphine: Analgesic efficacy and tolerability after gynaecological surgery. Anaesth Analg 1999; 89: 611–616.
21.Hynes D, Mc Carroll M et al. Analgesic efficacy of parenteral paracetamol (propacetamol) and diclofenac in post-operative orthopaedic pain. Acta Anaesthesiol Scand 2006; 50: 374.
22.Moller P, Gitte I et al. Intravenous Acetaminophen (Paracetamol):
Comparable Analgesic Efficacy, but Better Local Safety than Its Prodrug, Propacetamol, for Postoperative Pain After Third Molar Surgery. Anesth Analg 2005; 101: 90–96.
23.Flouvat B, Leneveu A et al. Bioequivalence study comparing a new paracetamol solution for injection and propacetamol after single intravenous infusion in healthy subjects. International Journal of Clinical Pharmacology and Therapeutics 2004; 42: 50–57.
24.BNF 50. www.bnf.org.uk.
136 |
World Federation of Societies of Anaesthesiologists | WFSA |

Фармакология нестероидных противовоспалительных препаратов
Бен Гупта
E-mail: drbengupta@gmail.com
9
Фармакология
Введение |
|
|
|
|
|
Нестероидные противовоспалительные |
специфичностью. Выработка так называемой |
|
|
||
препараты (НПВП / NSAIDS) — группа ле- |
«конституциональной» ЦОГ-1 происходит по- |
|
|
||
карственных средств, не относящихся к глю- |
стоянно во многих органах и тканях, напри- |
|
|
||
кокортикоидам, но обладающих такой общей |
мер, почках, желудке, легких и печени, а также |
|
|
||
характеристикой, как противовоспалительное |
в тромбоцитах. Ее активность обеспечивает |
|
|
||
действие.Этипрепаратыклассифицируютсяпо |
прежде всего стабильность гомеостатических |
|
|
||
химической структуре и в своем большинстве |
процессов и реализует защитные механиз- |
|
|
||
являются органическими кислотами (таблица |
мы, например, поддержание адекватного по- |
|
|
||
1). Кроме противовоспалительного, они оказы- |
чечного кровотока, целостность слизистой |
|
|
||
вают жаропонижающее и болеутоляющее дей- |
оболочки желудка и агрегацию тромбоцитов. |
|
|
||
ствие. Анальгезия, вызываемая стандартными |
Напротив, ЦОГ-2 является «индуцибельным» |
|
|
||
дозами НПВП, не сопровождается развитием |
ферментом. При обычных условиях ЦОГ-2 в |
|
|
||
седации и риском депрессии дыхания, что мо- |
тканях отсутствует, при этом ее биосинтез за- |
|
|
||
жет наблюдаться при использовании опиои- |
пускается лишь в условиях воспаления или |
|
|
||
дов. Большинство НПВП могут назначаться |
повреждения тканей цитокинами (например, |
|
|
||
перорально или ректально, некоторые из них |
интерлeйкином-1) или фактором некроза опу- |
|
|
||
выпускаются также во внутривенной форме. |
холей альфа (TNF-α). Классические, или несе- |
|
|
||
Большинство НПВП имеют схожие побочные |
лективные, НПВП блокируют как ЦОГ-1, так |
|
|
||
эффекты. |
и ЦОГ-2. Вместе с тем большинство побочных |
|
|||
Содержание |
|||||
|
эффектов НПВП связано именно с блокадой |
Нестероидные про- |
|||
МЕХАНИЗМ ДЕЙСТВИЯ |
ЦОГ-1 (см. ниже), тогда как терапевтическое |
тивовоспалительные |
|||
Обычные НПВП действуют как неспеци- |
действие главным образом обусловлено бло- |
препараты (НПВП) — |
|||
фические ингибиторы циклооксигеназы (ЦОГ, |
кадой ЦОГ-2. Теоретически идеальный НПВП |
эффективные и универ- |
|||
сальные анальгетики, |
|||||
COX) — фермента, играющего важную роль в |
должен блокировать только ЦОГ-2, не влияя |
||||
использующиеся для |
|||||
метаболизме арахидоновой кислоты и обра- |
на ЦОГ-1 и, соответственно, не должен нару- |
терапии как послеопе- |
|||
зовании эйкозаноидов. Наряду со снижением |
шать течение естественных физиологических |
рационной, так и хрони- |
|||
синтеза простагландинов (PGH2, PGE2, PGF2) |
процессов. С недавним внедрением в практи- |
ческой боли, особенно в |
|||
НПВП уменьшают образование лейкотрие- |
ку селективных ингибиторов ЦОГ-2 в этом на- |
тех случаях, когда боле- |
|||
вой синдром сочетается |
|||||
нов, простациклинов и тромбоксанов (рису- |
правлении удалось достигнуть определенных |
||||
с воспалением. Вместе |
|||||
нок 1). Простагландины (PG) синтезируются |
результатов. Среди препаратов этого класса |
с тем при использова- |
|||
практически во всех тканях и органах. Их ло- |
можно назвать целекоксиб, эторикоксиб и па- |
нии этих препаратов ча- |
|||
кальные эффекты опосредованы G-протеин- |
рекоксиб. Один из них — рофекоксиб (Vioxx) |
сто развиваются побоч- |
|||
связанными рецепторами. |
был отозван изготовителем в связи с подтвер- |
ные эффекты, имеющие |
|||
большее клиническое |
|||||
Циклооксигеназа имеет две основные изо- |
дившимся риском осложнений со стороны |
||||
значение, чем мы мо- |
|||||
формы: ЦОГ-1 (COX-1) и ЦОГ-2 (COX-2), при |
сердечно-сосудистой системы (см. ниже). |
жем себе представить. |
|||
этом каждая из них кодируется собственным |
Представленное выше описание физио- |
Не исключено, что в бу- |
|||
дущем взгляды на этот |
|||||
геном. Изоформы ЦОГ отличаются тканевой |
логической роли различных изоформ ЦОГ |
||||
класс препаратов бу- |
|||||
|
|
|
|||
Таблица 1. Классификация неселективных нестероидных противовоспалительных препаратов с примерами |
дут пересмотрены, по- |
||||
сле чего показания к их |
|||||
|
|
|
|||
Группа |
Примеры |
применению станут бо- |
|||
|
|
|
лее узкими. |
||
Производные салициловой кислоты |
Аспирин |
||||
|
|
|
|
|
|
Производные уксусной кислоты |
Диклофенак, индометацин |
|
Ben Gupta |
||
Производные пропионовой кислоты |
Ибупрофен, напроксен, кетопрофен |
|
|||
Anaesthetic Registrar, |
|||||
Производные эноловой кислоты |
Пироксикам, фенилбутазон |
|
|||
Sir Charles Gairdner |
|||||
Производные фенамовой кислоты |
Мефенамовая кислота |
|
|||
Hospital, |
|||||
Некислотные производные |
Набуметон |
Perth, Western Australia |
|||
|
|
|
|
|
|
Базовый курс анестезиолога | Basic Sciences |
|
|
137 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(неселективный ингибитор) и парекоксибу (селектив- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ный ингибитор ЦОГ-2). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Как уже было отмечено, НПВП обладают жаропони- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
жающим эффектом. Температура тела поддерживается |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гипоталамусом вблизи значения «контрольной точки» — |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
установочного уровня терморегуляции. Выброс проста- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гландинов повышает значение установочной точки, тог- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
да как НПВП частично блокируют данный механизм. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПОБОЧНЫЕ ЭФФЕКТЫ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Желудочно-кишечный тракт |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Влияние НПВП на слизистую желудка хорошо изу- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
чено. Простагландины обладают гастропротективными |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
свойствами. Они снижают кислотность желудочного |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сока, стимулируют образование защитного слоя слизи- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
стой и улучшают ее кровоснабжение. Снижение синтеза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
простагландинов приводит к повреждению слизистой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
оболочки желудка. Кроме того, НПВП могут вызывать |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
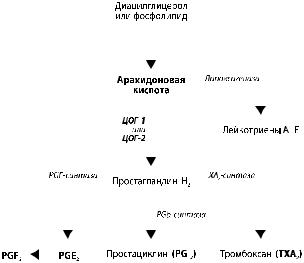
Рисунок 1. Каскад образования простагландинов |
физико-химическое повреждение слизистой при непо- |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
средственном контакте. Сочетание этих двух механиз- |
|
несколько упрощено. Не исключено, что ЦОГ-2 играет |
мов может привести к гастропатии различной степени |
|||||||||||||||||
более значимую физиологическую роль, нежели предпо- |
выраженности, начиная от незначительного дискомфор- |
|||||||||||||||||
лагалось. В частности, конституциональная активность |
та в эпигастрии до образования эрозий и желудочно- |
|||||||||||||||||
ЦОГ-2 может играть важную роль в женской репродук- |
кишечного кровотечения. Риск развития гастропатии |
|||||||||||||||||
тивной системе. |
вследствие приема НПВП индивидуален, при этом наи- |
|||||||||||||||||
|
Как показано на рисунке, обе формы ЦОГ участвуют |
более опасным в отношении этого осложнения считает- |
||||||||||||||||
|
ся пожилой возраст. При использовании селективных |
|||||||||||||||||
в выработке PGH2 — предшественника прочих проста- |
||||||||||||||||||
ингибиторов ЦОГ-2 риск развития побочных эффектов |
||||||||||||||||||
гландинов, играющих важную роль в воспалительном |
||||||||||||||||||
со стороны ЖКТ ниже.4 |
||||||||||||||||||
процессе. Сами простагландины не являются прямыми |
|
|||||||||||||||||
альгетиками. Они вызывают локальное усиление крово- |
Тромбоциты и сердечно-сосудистая система |
|||||||||||||||||
тока и сосудистой проницаемости, что сопровождает- |
Все неселективные НПВП снижают агрегацию |
|||||||||||||||||
ся отеком и эритемой в зоне воспаления. В то же время |
тромбоцитов, что обусловлено уменьшением продук- |
|||||||||||||||||
PGE2 и PGF2α сенситизируют периферические нервные |
ции тромбоксана А2 (TXA2), который содержится в этих |
|||||||||||||||||
волокна к механическим, химическим и тепловым сти- |
клетках в больших количествах. Действуя как локаль- |
|||||||||||||||||
мулам, а также к локально высвобождающимся альге- |
ный хемоаттрактант, TXA2 участвует в формировании |
|||||||||||||||||
тикам, таким, как брадикинин, гистамин и серотонин. |
тромбоцитарного сгустка и индуцирует развитие ло- |
|||||||||||||||||
Образование простагландинов также происходит и в |
кальной вазоконстрикции. Большинство НПВП кон- |
|||||||||||||||||
ЦНС, где, как полагают, они участвуют в процессе вы- |
курентно блокируют ЦОГ-1, при этом степень блокады |
|||||||||||||||||
свобождения субстанции P. Этот медиатор облегчает |
зависит от концентрации препарата в плазме. Вместе |
|||||||||||||||||
синаптическую передачу в задних рогах спинного моз- |
с тем аспирин действует неконкурентно и необратимо |
|||||||||||||||||
га, что проявляется гиперальгезией и сопутствующим |
ингибирует ЦОГ, а тромбоциты не в состоянии синте- |
|||||||||||||||||
воспалением. Принято считать, что НПВП уменьшают |
зировать белки de novo и не могут ресинтезировать этот |
|||||||||||||||||
боль благодаря периферическому действию, однако на |
фермент. В результате этого на протяжении всего остав- |
|||||||||||||||||
сегодняшний день очевидно, что определенный вклад в |
шегося срока циркуляции, то есть в течение десяти дней, |
|||||||||||||||||
их активность вносит и центральный механизм — сни- |
агрегация тромбоцитов будет нарушена. Именно поэто- |
|||||||||||||||||
жение простагландинового пула ЦНС. |
му прием аспирина необходимо прекратить за неделю |
|||||||||||||||||
|
Неудивительно, что НПВП оказались прекрасными |
до операции. |
||||||||||||||||
анальгетиками при многих костно-суставных наруше- |
Побочные эффекты НПВП со стороны сердечно- |
|||||||||||||||||
ниях (артриты, переломы), а также обладают морфин- |
сосудистой системы обусловлены снижением уровня |
|||||||||||||||||
сберегающим эффектом в абдоминальной, торакальной |
эйкозаноидов. Вырабатываемый эндотелием PGI2 (про- |
|||||||||||||||||
и ортопедической хирургии.1–3 Благодаря их примене- |
стациклин) является мощным ингибитором агрегации |
|||||||||||||||||
нию снижается степень седации, улучшается дыхатель- |
тромбоцитов и играет важную роль в поддержании |
|||||||||||||||||
ная функция, уменьшается риск развития задержки |
антитромботических свойств интактных кровеносных |
|||||||||||||||||
мочи и ускоряется восстановление энтерального пита- |
сосудов. Кроме того, в отличие от тромбоксана A2, про- |
|||||||||||||||||
ния. Все это способствует более ранней реабилитации |
стагландины вызывают вазодилатацию и увеличение |
|||||||||||||||||
пациента и снижению экономических затрат на лечение. |
органного кровотока (исключение составляют легоч- |
|||||||||||||||||
Благодаря этому НПВП все активнее используются в пе- |
ные сосуды, которые под воздействием простагланди- |
|||||||||||||||||
риоперационном периоде, когда предпочтение отдается |
нов сужаются). Образование PGI2 зависит от активно- |
|||||||||||||||||
их парентеральным формам, в частности, кеторолаку |
сти ЦОГ-2, что объясняет более высокий риск побочных |
|||||||||||||||||
138 |
World Federation of Societies of Anaesthesiologists | WFSA |
эффектов со стороны сердечно-сосудистой системы при |
шока. Как полагают, у пациентов без астматического |
|
использовании селективных НПВП. |
анамнеза в их основе лежат иммунные механизмы. В то |
|
Недавно опубликованные данные свидетельствуют о |
же время бронхоспазм, иногда возникающий при при- |
|
повышении риска развития острого инфаркта миокарда |
менении НПВП у астматиков, с иммунными реакциями |
|
(ОИМ) при использовании НПВП в общей популяции |
не связан. |
|
больных.5 Показано, что это осложнение могут вызы- |
Если после приема аспирина возникает ухудшение |
|
вать большинство НПВП, хотя степень риска варьиру- |
течения ХОЗЛ, говорят об аспирининдуцированной |
|
ет. Например, длительное применение диклофенака |
астме (AERD, AIA). Возможный механизм заключается |
|
характеризуется незначительным увеличением риска |
в блокаде циклооксигеназного пути метаболизма ара- |
|
ОИМ, ибупрофен не увеличивает риск, а при использо- |
хидоновой кислоты и активации липооксигеназного |
|
вании напроксена риск ОИМ даже несколько снижает- |
синтеза лейкотриенов, вызывающих бронхоконстрик- |
|
ся.6 Вместе с тем наибольшую опасность в отношении |
цию. Четкая предрасположенность к аспириновой аст- |
|
развития ОИМ и инсульта представляет длительное |
ме прослеживается у пациентов с полипозом носа. Это |
|
применение селективных ингибиторов ЦОГ-2. После |
осложнение может быть вызвано не только аспирином, |
|
получения этих данных рофекоксиб был отозван с рын- |
но и прочими НПВП, тогда как селективные ингибито- |
|
ка компанией-производителем. На сегодняшний день |
ры ЦОГ-2 в этом отношении считаются безопасными.9 |
|
большинство работ свидетельствует об отсутствии яв- |
Распространенность первичной аспириновой астмы в |
|
ных преимуществ ингибиторов ЦОГ-2 перед неселектив- |
популяции составляет порядка 3%, тогда как при целе- |
|
ными НПВП, поэтому они должны назначаться лишь по |
направленной провокации она выявляется у 20% аст- |
|
специальным показаниям и только после полной оцен- |
матиков. В детской практике распространенность этого |
|
ки возможного риска со стороны сердечно-сосудистой |
состояния варьирует от 2 до 5%. |
|
системы.7 В странах, где парекоксиб и кеторолак лицен- |
Взаимодействие с препаратами |
|
зированы, их используют только для непродолжитель- |
||
Механизмы взаимодействия НПВП с другими пре- |
||
ной терапии боли в послеоперационном периоде. |
||
паратами могут быть разными. Во-первых, за счет влия- |
||
|
||
Почки |
ния НПВП на почечную функцию концентрация ряда |
|
У пациентов с хронической сердечной недостаточ- |
лекарственных препаратов в плазме может увеличи- |
|
ностью, хронической почечной недостаточностью и/ |
ваться (например, соли лития и метотрексат). Во-вторых, |
|
или гиповолемией почечный кровоток находится в пря- |
НПВП могут потенцировать действие других препа- |
|
мой зависимости от степени вазодилатации, опосредо- |
ратов. Например, у пациентов, принимающих НПВП |
|
ванной простагландинами. В условиях, когда почечный |
и варфарин, повышается риск развития кровотечения, |
|
кровоток скомпрометирован, снижение синтеза проста- |
поскольку оба препарата обладают антикоагулянтными |
|
гландинов может спровоцировать развитие острой по- |
свойствами. В-третьих, НПВП могут фармакологически |
|
чечной недостаточности. Кроме того, уменьшение про- |
взаимодействовать с другим препаратом и изменять его |
|
стагландинового пула ведет к избыточной продукции |
эффект. Примером этого является увеличение междуна- |
|
антидиуретического гормона, задержке натрия и воды, |
родного нормализованного отношения (МНО) у паци- |
|
развитию отеков и/или гипертензии. Следовательно, на- |
ентов, принимающих варфарин на фоне НПВП. |
|
значение любых НПВП пациентам с сердечной недоста- |
Прочее |
|
точностью будет противопоказано. |
||
Синдром Рейо (Reye) обычно возникает на фоне |
||
|
||
Акушерство |
острых респираторных вирусных заболеваний и про- |
|
Простагландины играют важную роль в индукции |
является энцефалопатией и жировой дегенерацией пе- |
|
родовой деятельности, поэтому назначение НПВП в |
чени. Наиболее часто встречается у детей. Как правило, |
|
родах всегда их пролонгирует. На этом эффекте осно- |
развитие этого осложнения провоцирует прием аспири- |
|
вано применение индометацина в качестве токолитика |
на с жаропонижающей целью на начальной стадии ви- |
|
при преждевременных родах (обычно в свечах). Однако |
русного заболевания (ОРВИ). В связи с этим во многих |
|
НПВП создают риск фетальной олигурии и прежде |
странах использование аспирина не рекомендуется для |
|
временного закрытия артериального протока, проходи- |
лечения гипертермии до 16 лет (в США — до 19 лет. — |
|
мость которого поддерживается PGE2. Индуцированное |
Прим. редактора). |
|
НПВП закрытие артериального протока может приве- |
|
|
сти к развитию легочной гипертензии и инфаркту мио- |
ДЛЯ ДОПОЛНИТЕЛЬНОГО ЧТЕНИЯ |
|
карда у плода. Использование НПВП у беременных так- |
• Goodman and Gilmans’s The Pharmacological Basis of Therapeutics, 11th |
|
же может приводить к прерыванию беременности. Риск |
Edition, McGraw Hill. Available at: http://www.jr2.ox.ac.uk/ bandolier/ |
|
выкидыша наиболее высок, если НПВП используются |
booth/painpag/. |
|
более недели, а также в период зачатия.8 |
ЛИТЕРАТУРА |
|
Реакции гиперчувствительности |
||
1. Burns JW et al. Double-blind comparison of the morphine sparing ef- |
||
Реакции гиперчувствительности на НПВП мо- |
fect of continuous and intermittent i.m. administration of ketorolac. Br J |
|
гут проявляться широким спектром клинических со- |
Anaesth 1991; 67: 235–238. |
|
2. Rhodes M et al. Nonsteroidal anti-inflammatory drugs for postthoracoto- |
||
стояний — от крапивницы и ринита до бронхоспазма, |
||
my pain. A prospective controlled trial after lateral thoracotomy. J Thorac |
||
ангионевротического отека и даже анафилактического |
||
Cardiovasc Surg 1992; 103: 17–20. |
Базовый курс анестезиолога | Basic Sciences |
139 |
