
- •Лекция 15. Основы термодинамики
- •14. 1. Условия термодинамического равновесия системы.
- •14. 2. Квазистатические процессы. Обратимые и необратимые процессы.
- •14. 3. Макроскопическая работа.
- •14. 4. Количество теплоты.
- •14. 5. Первое начало термодинамики.
- •14. 6.Внутренняя энергия идеального газа. Закон Джоуля.
- •14. 7. Теплоемкость.
- •14. 7.1. Уравнение Майера.
- •14. 7. 2. Теплоемкость и степени свободы.
- •14. 7. 3. Теплоемкость идеального газа.
- •14. 7. 4. Зависимость теплоемкости от температуры.
- •14. 8. Адиабатический процесс. Уравнение Пуассона.
- •14. 9. Калорическое уравнение идеального газа.
- •14. 10. Политропические процессы.
14. 7. 2. Теплоемкость и степени свободы.
Равнораспределение энергии по степеням свободы. Из уравнения состояния и основного уравнения молекулярно-кинетической теории
|
|
(14.22) |
следует, что среднее значение кинетической энергии поступательного движения молекул
|
|
(14.23) |
Заметим, что при построении модели
идеальный газ представляли как систему,
состоящую из абсолютно твердых
молекул-шариков, взаимодействием между
которыми мы пренебрегали. В этой модели
молекула-шарик может двигаться в любом
из трех пространственных направлений
в однородном изотропном пространстве.
Здравый смысл подсказывает, что ни одно
из этих направлений не имеет преимущества
перед двумя другими. Поэтому нетрудно
сообразить, что в среднемдвижению
в каждом из этих направлений соответствует
энергия, пропорциональная![]() ,
что в сумме дает
,
что в сумме дает![]() .
.
Рассмотрим теперь молекулу, обладающую более сложной структурой.
Предположим, что молекула состоит из
двух жестко связанных между собой атомов
(рис. 14.5). Центр масс такой молекулы,
совершающей поступательное движение,
может перемещаться в пространстве в
3-х независимых направлениях, задаваемых
осями
![]() (рис.
14.5а).
(рис.
14.5а).
|
а) |
б) |
|
Рисунок 14. 5.
| |
В системе отсчета, начало которой связано
с центром масс молекулы, пространственное
положение оси молекулы полностью
определяется двумя углами:
![]() и
и![]() (рис. 14.5б).
(рис. 14.5б).
Молекула может произвольно вращаться вокруг своего центра масс. При этом она приобретает дополнительную кинетическую энергию, связанную с вращательным движением, величина которой определяется совокупностью двух членов:
|
|
(14.24) |
где
![]() и
и![]() - составляющие угловой скорости вращения
молекулы.
- составляющие угловой скорости вращения
молекулы.
В теоретической физике доказывается, что в среднем составляющие кинетической энергии
|
|
(14.25) |
Полная энергия такой молекулы
|
|
(14.26) |
Назовем числом степеней свободы число независимых координат, которые следует задать для определения положения молекулы в пространстве.
Для одноатомной и многоатомных молекул
всегда
![]() ;
для рассматриваемой молекулы добавляются
еще вращательные степени свободы:
;
для рассматриваемой молекулы добавляются
еще вращательные степени свободы:![]() .
.
Т.о.,
![]() и средняя кинетическая энергия молекулы
газа
и средняя кинетическая энергия молекулы
газа
|
|
(14.27) |
Рассмотрим двухатомную молекулу (рис. 14.6), связь между атомами которой упругая (в предыдущем случае связь меду молекулами предпола-
|
|
галась жесткой). Тогда наряду с 5-тью степенями свободы, определяющими кинетическую энергию двухатомной молекулы с жесткой недеформируемой связью, при наличии упругой связи следует задать ещё одну. |
|
Рисунок 14. 6. |
Однако колебательное движение характеризуется наряду с кинетической еще и потенциальной энергией. Это означает, что при подсчете степеней свободы двухатомной молекулы с упругой связью между атомами мы должны записать
|
|
(14.28) |
Из теории колебаний известно, что для
гармонического осциллятора средние
значения кинетической и потенциальной
энергии одинаковы. Поэтому, по-прежнему,
считая, что на каждую степень свободы
молекулы приходится энергия, равная
![]() ,
получаем
,
получаем
|
|
(14.29) |
И, наконец, если молекула является
многоатомной и имеет сложную
пространственную конфигурацию, то для
её описания следует ввести еще одну
вращательную степень свободы, т.е. число
вращательных степеней свободы становится
равным трем:
![]() .
.
В общем случае число степеней свободы молекулы определяется выражением ():
![]() ,
,
где
![]() ,
,![]() и
и![]() ,
а среднее значение энергии молекулы в
соответствии с принципом равнораспределения
по степеням свободы равно
,
а среднее значение энергии молекулы в
соответствии с принципом равнораспределения
по степеням свободы равно
|
|
(14.30) |
Это уравнение (14.30) выражает закон
классической статистической физики,
утверждающий, что на каждую степень
свободы системы, находящейся в состоянии
термодинамического равновесия, приходится
в среднем энергия, равная
![]() (закон равнораспределения
энергии по степеням свободы).
(закон равнораспределения
энергии по степеням свободы).

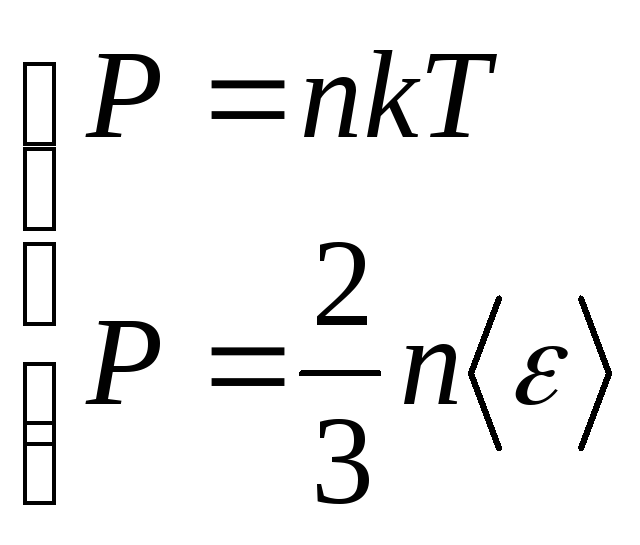 ,
,

