
- •Лекция 15. Основы термодинамики
- •14. 1. Условия термодинамического равновесия системы.
- •14. 2. Квазистатические процессы. Обратимые и необратимые процессы.
- •14. 3. Макроскопическая работа.
- •14. 4. Количество теплоты.
- •14. 5. Первое начало термодинамики.
- •14. 6.Внутренняя энергия идеального газа. Закон Джоуля.
- •14. 7. Теплоемкость.
- •14. 7.1. Уравнение Майера.
- •14. 7. 2. Теплоемкость и степени свободы.
- •14. 7. 3. Теплоемкость идеального газа.
- •14. 7. 4. Зависимость теплоемкости от температуры.
- •14. 8. Адиабатический процесс. Уравнение Пуассона.
- •14. 9. Калорическое уравнение идеального газа.
- •14. 10. Политропические процессы.
14. 7. 3. Теплоемкость идеального газа.
Рассмотрим
идеальный газ. Один моль газа содержит
![]() молекул, поэтому его внутренняя энергия
может быть найдена как
молекул, поэтому его внутренняя энергия
может быть найдена как
|
|
(14.31) |
где
![]() средняя
энергия, приходящаяся на одну степень
свободы.
средняя
энергия, приходящаяся на одну степень
свободы.
Определим
теплоемкости
![]() идеального газа в зависимости от строения
его молекул.
идеального газа в зависимости от строения
его молекул.
Одноатомные молекулы - три поступательных степени свободы:
 .
.(14.32)
Двухатомные молекулы с жесткой связью - 3 поступательных степени свободы + 2 вращательных степени = 5 степеней свободы. Тогда
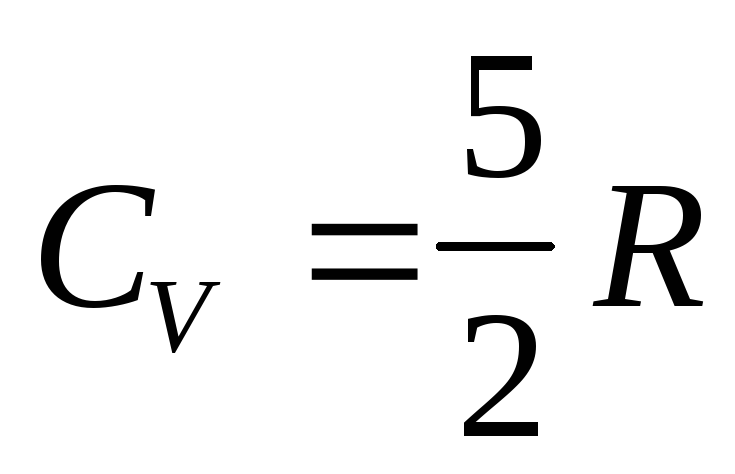 .
.
(14.33)
Двухатомные молекулы с упругой связью - 3 поступательных степени свободы + 2 вращательных степени + 1 колебательная степень свободы. На колебательную степень свободы приходится две половинки
 ,
т.е.
,
т.е.
 .
Тогда
.
Тогда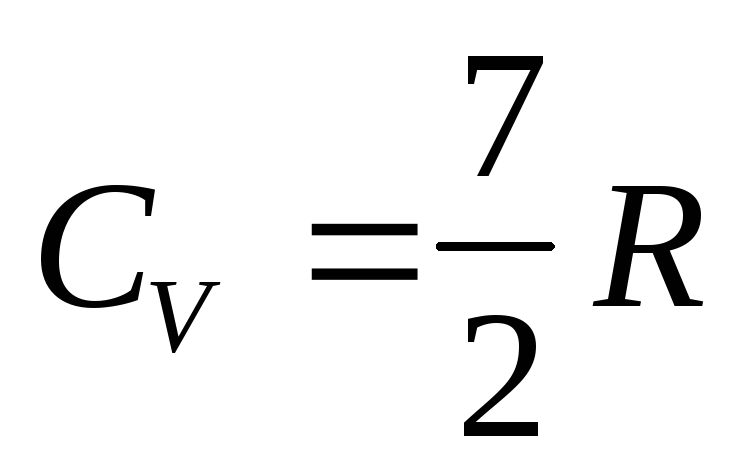 .
.(14.34)
Многоатомная молекула - тогда введем
 и теплоемкость:
и теплоемкость:
|
|
(14.35) |
Эти простые формулы хорошо описывают теплоемкости многих реальных газов (одноатомных и многих двухатомных) вблизи комнатной температуры. Для газов, образованных 3-х атомными молекулами чаще наблюдаются отклонения от полученных значений.
14. 7. 4. Зависимость теплоемкости от температуры.
Опыт
показал, что в широком температурном
диапазоне
![]() существенно зависит от температуры.
существенно зависит от температуры.
Экспериментальная зависимость теплоемкости газа 2-х атомных молекул (типа H2) от температуры, построенная в полулогарифмическом масштабе, приведена на рисунке 14.7.
Опыт показывает, что классический закон равнораспределения энергии по степеням свободы выполняется не при всех температурах. Понимание такой температурной зависимости теплоемкости было достигнуто в квантовой физике, где учитывается, что энергия молекул принимает дискретные значения.
Пусть расстояние между двумя уровнями энергии равно
|
|
(14.36) |
Тогда
если внутренняя энергия теплового
движения такая, что
![]() ,
то этой энергии не хватает, чтобы
возбудить уровень энергии
,
то этой энергии не хватает, чтобы
возбудить уровень энергии![]() и соответствующую степень свободы.
Тогда при расчете теплоемкости системы
надо учитывать степени свободы, связанные
только с уровнем энергии
и соответствующую степень свободы.
Тогда при расчете теплоемкости системы
надо учитывать степени свободы, связанные
только с уровнем энергии![]() .
Степени свободы, связанные с уровнем
.
Степени свободы, связанные с уровнем![]() не будут давать вклад в теплоемкость.
не будут давать вклад в теплоемкость.
Для типичной двухатомной молекулы получаются следующие температуры для полного включения различных степеней свободы:
|
|
Для поступательного движения
Для
вращательного движения
Для
колебательного движения
С
ростом температуры происходит
включение соответствующих
степеней свободы. И только при
|
|
Рисунок 14. 7. |
14. 8. Адиабатический процесс. Уравнение Пуассона.
Процесс, происходящий в системе без теплообмена с окружающей средой, называется адиабатическим.
Установим связь между параметрами
идеального газа, совершающего
квазистатический адиабатический
процесс. Положив в уравнении ()
![]() и
и![]() ,
получаем
,
получаем
|
|
(14.37) |
Дифференцируя уравнение Менделеева-Клапейрона, получим
|
|
(14.38) |
откуда
|
|
(14.39) |
Выражая
![]() из (), находим
из (), находим
|
|
(14.40) |
Введем обозначение
|
|
(14.41) |
Тогда
|
|
(14.42) |
Мы получили дифференциальное уравнение, описывающее квазистатический адиабатический процесс, проводимый с идеальным газом.
Теплоемкости
![]() и
и![]() идеального газа, вообще говоря, зависят
от температуры, однако во многих случаях
они остаются практически постоянными
в широком интервале температур. Понятно,
что постоянным будет и их отношение
идеального газа, вообще говоря, зависят
от температуры, однако во многих случаях
они остаются практически постоянными
в широком интервале температур. Понятно,
что постоянным будет и их отношение![]() .
.
При этом условии уравнение (14.42) легко интегрируется
|
|
(14.43) |
Полученное соотношение называется уравнением Пуассона(1781 – 1840). Оно является уравнениемадиабаты– кривой, изображающей квазистатический адиабатический процесс.
Величина
![]() называетсяпоказателем
адиабаты, или
адиабатической
постоянной.
называетсяпоказателем
адиабаты, или
адиабатической
постоянной.
Поскольку переменные
![]() ,
,![]() и
и![]() для идеального газа связаны уравнением
для идеального газа связаны уравнением![]() ,
то уравнение адиабаты можно записать
как
,
то уравнение адиабаты можно записать
как
|
|
(14.44) |
Так как
![]() ,
то из уравнения () следует, что при
адиабатическом сжатии газ будет
нагреваться (механизм
воспламенения горючей смеси в дизелях),
а при адиабатическом расширении –
охлаждаться. Нагревание газа при
адиабатическом сжатии объясняется тем,
что производимая внешними силами работа
идет на увеличение внутренней энергии
газа. Если газ идеальный, то, как следует
из (), увеличение его внутренней энергии
будет проявляться в повышении его
температуры. Аналогично объясняется
охлаждение газа при адиабатическом
расширении.
,
то из уравнения () следует, что при
адиабатическом сжатии газ будет
нагреваться (механизм
воспламенения горючей смеси в дизелях),
а при адиабатическом расширении –
охлаждаться. Нагревание газа при
адиабатическом сжатии объясняется тем,
что производимая внешними силами работа
идет на увеличение внутренней энергии
газа. Если газ идеальный, то, как следует
из (), увеличение его внутренней энергии
будет проявляться в повышении его
температуры. Аналогично объясняется
охлаждение газа при адиабатическом
расширении.

