
- •Конспект лекций по курсу
- •Введение
- •1 Молекулярно-кинетическая теория жидкого состояния
- •2 Свойства металлических расплавов
- •2.1 Плотность
- •2.2 Вязкость
- •2.4 Электрическая проводимость
- •2.5 Теплопроводность
- •2.6 Магнитная восприимчивость
- •3 Теория кристаллизации расплавов
- •3.1 Механизм кристаллизации
- •3.2 Кинетика кристаллизации
- •3.3 Кристаллизация промышленных слитков
- •4 Аморфные материалы
- •4.1. Теория процесса стеклования
- •4.2 Методы получения аморфных металлических материалов
- •4.3 Структура аморфных сплавов
- •Механические свойства аморфных материалов
- •5.1 Прочность и твердость
- •5.2 Пластичность. Виды деформации аморфных материалов
- •5.3 Хрупкость
- •5.4 Упругие свойства
- •5.5 Неупругие свойства
- •5.6 Магнитные свойства
- •6 Области применения аморфных сплавов
- •7 Кристаллическое строение материалов
- •8 Типы связей в твердых телах
- •Литература
3 Теория кристаллизации расплавов
3.1 Механизм кристаллизации
Чистые металлы переходят из жидкого состояния в твердое при постоянной температуре, которая является характерной для данного метала при определенном давлении. При затвердевании ближний порядок сменяется дальним, характерным для твердого металла.
Температура кристаллизации соответствует такой, при которой энергия Гиббса (или изобарно-изотермический потенциал G) твердой или жидкой фаз становится одинаковым.
Изобарный потенциал как твердой, так и жидкой фазы с ростом температуры уменьшается.
Тпл или крист– температура при которой система из двух фаз оказывается термодинамически устойчивой и в ней в состоянии равновесия могут находиться обе фазы -Gжид=Gтв
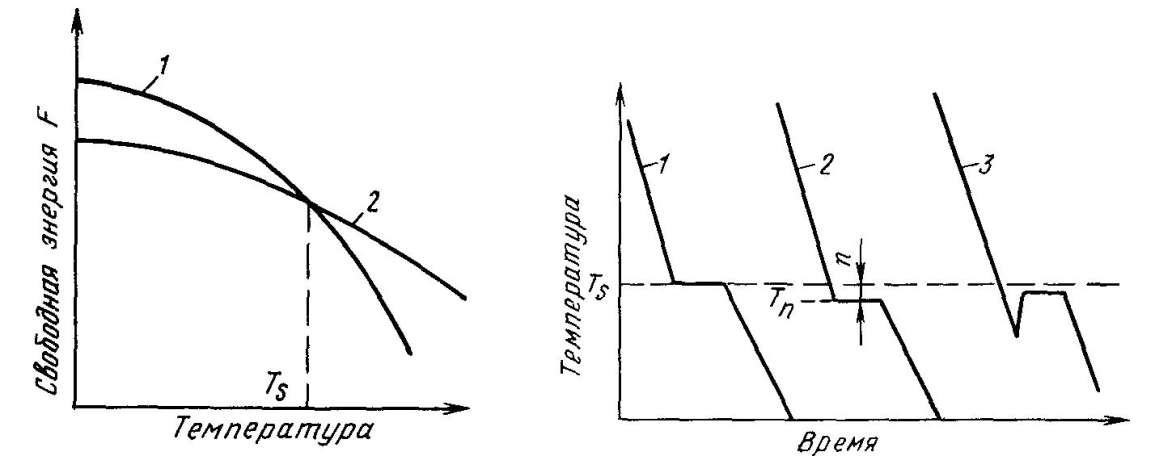
Для развития процесса кристаллизации необходимо создать такие условия, при которых изобарный потенциал твердой фазы был бы меньше, чем изобарный потенциал жидкой фазы. Это возможно при некотором понижении температуры ниже равновесной температуры плавления. Разность между фактической температурой расплавленного металла и равновесной температурой кристаллизации называется переохлаждением:
ΔТ = Тпл– Т
В некоторых случаях величина переохлаждения может составлять 200-300К.
Процесс затвердевания можно разделить на две стадии:
Образование центров кристаллизации из жидкого расплава. Количественной характеристикой первого этапа является число центров кристаллизации, образуемых в единице объема за единицу времени N.
Рост кристаллов из образовавшихся центров кристаллизации. Этот процесс характеризуется скоростью кристаллизации или линейной скоростью роста кристаллов С.
В жидком металле существуют микрообласти, в которых расстояние между атомами и расположение атомов в пространстве близко к расположению в кристалле. При понижении температур из таких кластеров могут образовываться субцентры кристаллизации (или «некристаллизуемые кластеры»), которые слишком малы для того, чтобы сохранить свою устойчивость. Это связано с тем, что рост такого субцентра происходит с увеличением энергии Гиббса.
Если центр кристаллизации возникает гомогенно, т.е. за счет образования уплотнений в объеме расплава из собственных частиц кристаллизуемого вещества, то изменение энергии Гиббса системы за счет такого процесса будет включать два слагаемых. Одно – изменение объемной свободной энергии за счет понижения температуры, а другое – увеличение свободной энергии за счет образования поверхности раздела между твердым металлом и расплавом. Общее изменение энергии Гиббса при образовании зародыша будет равно:
ΔG=ΔGобъемн+ΔGпов
Промышленные металлические расплавы содержат достаточное количество различных нерастворимых примесей. Поэтому зарождение кристаллов в таких расплавах происходит при незначительных переохлаждениях порядка 1-10 град.
В ряде случаев в металлический расплав специально вводят катализаторы зарождения для стимулирования процессов образования зародышей. В качестве таких катализаторов могут быть соединения, нерастворимые в расплаве или химические элементы, которые, реагируя с жидкими расплавами, образуют твердые соединения.
Этот технологический прием получил название – модифицирование металлов. Все вещества – модификаторы, влияющие на структуру затвердевшего металла, делят на две группы: модификаторы первого и второго рода.
Модификаторы первого рода (алюминий) образуют в расплаве высокодисперсную смесь. Частицы этой смеси служат зародышами, на которых образуются и растут кристаллы.
Ко второй группе относятся элементы или химические соединения, которые адсорбируются на гранях зарождающихся кристаллов и тормозят их рост. Замедление скорости роста кристаллов сопровождается увеличением числа центров кристаллизации, что и как в первом случае способствует измельчению зерна (это щелочные и щелочноземельные металлы).
В результате модифицирования жидких металлов и сплавов после затвердевания изделий образуется мелкозернистая структура с высокими механическими свойствами металла.
В качестве катализаторов зарождения могут быть использованы металлические порошки. Поскольку при частичном плавлении порошков поглощается теплота перегрева расплава, их называют микрохолодильниками.
Было исследовано влияние добавок в металл металлических порошков, имеющих различный тип кристаллической решетки.
Если добавляемый порошок имел такой же тип кристаллической решетки что и основной затвердевший металл, то он действовал как «затравка», и на частицах этого порошка легко образовывались зародыши твердой фазы. Это приводило к измельчению зерна в литой структуре слитка. Если добавляемый порошок имел другой тип кристаллической решетки, он не оказывал измельчающего и модифицирующего действия на литую структуру слитка.
