
- •Навчальний посібник з фізики
- •Розділ і. Механіка
- •1.1. Основи кінематики
- •1.2. Основи динаміки
- •1.3. Закони збереження в механіці.
- •Розділ іі. Молекулярна фізика
- •2.2. Основи термодинаміки.
- •Загальні рекомендації до розв’язання задач
- •Основні формули з розділу «Механіка»
- •Кінематичне рівняння рівномірного руху матеріальної точки вздовж осі х:
- •Задачі для самостійного розв’язування з розділу «Механіка»
- •Основні формули з розділу «Молекулярна фізика та термодинаміка»
- •Приклади розв’язування задач
- •Література
Основні формули з розділу «Молекулярна фізика та термодинаміка»
Кількість речовини:
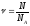 ;
;
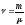 ,
,
де
N=NA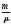 –
число структурних елементів (молекул,
атомів, іонів тощо) системи; NA
–
стала Авогадро.
–
число структурних елементів (молекул,
атомів, іонів тощо) системи; NA
–
стала Авогадро.
Рівняння стану ідеального газу (рівняння Клапейрона-Менделєєва)
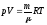 ,
,
де m – маса газу; м – молярна маса газу; R – універсальна газова стала;
T – термодинамічна температура; р – тиск.
Основні газові закони, що є окремими випадками рівняння Клапейрона-Менделєєва:
а) закон Бойля-Маріотта (ізотермічний процес: T=const, m=const), PV=const
або для двох станів газу P1V1=P2V2;
б)
закон Гей-Люссака (ізобарний процес:
P=const;
m=const)
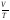 =const,
=const,
або
для двох станів
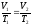 ;
;
в)
закон Шарля (ізохорний процес: V=const,
m=const)
 =const,
=const,
або
для двох станів
 .
.
Концентрація молекул
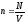 ,
,
де N – число молекул, що містяться в даному об'ємі.
Формула справедлива не тільки для газів, але і для будь-якого агрегатного стану речовини.
Основне рівняння молекулярно-кінетичної теорії ідеальних газів:
р
=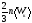 ;
;
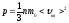 ;
p=nkT,
;
p=nkT,
де
n
–
концентрація молекул; k
–
стала Больцмана (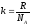 );m0
–
маса однієї молекули;
);m0
–
маса однієї молекули;
< кв>
кв>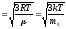 –
середня квадратична швидкість молекули;
<Wк>
–
середня кінетична енергія поступального
руху молекули газу.
–
середня квадратична швидкість молекули;
<Wк>
–
середня кінетична енергія поступального
руху молекули газу.
Перший закон термодинаміки:
Q = U + A,
де Q – кількість теплоти, що одержує, або віддає система;
U – зміна внутрішньої енергії системи; A – робота, здійснена системою проти зовнішніх сил.
Застосуваня першого закону термодинаміки до ізопроцесів:
а) ізобарний: Q = U + A, де А=рV;
б) ізохорний: Q = U ;
в) ізотермічний: Q = A;
г)адіабатний: A = -U.
Зміна внутрішньої енергії ідеального газу:
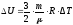 .
.
Кількість теплоти (Q) — міра внутрішньої енергії, переданої в процесі теплообміну від одного макроскопічного тіла до іншого без виконання роботи.
Рівняння
теплового балансу
описує теплообмін у замкненій системі:
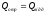 ,
,
де
 -
сумарна кількість теплоти, одержана
тілом при теплообміні;
-
сумарна кількість теплоти, одержана
тілом при теплообміні;
 -
сумарна кількість теплоти, віддана
тілом при теплообміні.
-
сумарна кількість теплоти, віддана
тілом при теплообміні.
Кількість теплоти, яка необхідна для нагрівання тіла і яка виділяється при охолодженні тіла, розраховується за формулою:
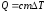 ,
,
де с – питома теплоємність речовини; m – маса тіла; ∆T – зміна температури тіла.
Питома теплоємність (с) – фізична величина, яка показує, яку кількість теплоти отримує або віддає 1 кг речовини при зміні її температури на 1 К (або 1 оС).
Кількість
теплоти,
яка поглинається під час плавлення,
або виділяється під час кристалізації
твердого тіла, визначається за формулою:
 ,
,
де L – питома теплота плавлення
Кількість теплоти, необхідна для випаровування або виділяється при конденсації, визначається за формулою:
 ,
,
де r – питома теплота пароутворення.
Кількість теплоти, яка виділяється під час згорання палива, визначається за формулою:
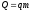 ,
,
де q – питома теплота згорання палива.
Термічний ККД для кругового процесу (циклу)
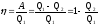 ,
,
де Q1 – кількість теплоти, отримана системою від нагрівача;
Q2 – кількість теплоти, віддана системою холодильнику;
A – робота, що здійснюється за цикл.
Термічний ККД циклу Карно
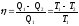 ,
,
де T1 – температура нагрівача;
T2 – температура холодильника.
