
Химия_1 / prakticheskie
.pdfчастинок ( S 0). Для ізобарно-ізотермічних умов (Р і Т – const), що найчастіше зустрічаються, критерієм можливості самодовільного перебігу процесу є знак зміни термодинамічної функції G, що називається енергією Гіббса :
G = Н - Т S, |
G = Н - Т S. |
При G 0 пряма реакція термодинамічно можлива; приG 0 – пряма реакція неможлива, але може протікати
зворотна реакція; рівність G = 0 є умовою термодинамічної рівноваги.
Зверніть увагу на те, що термодинамічна неможливість
( G 0) перебігу реакції у даному напрямку носить характер абсолютної заборони: ніякі технічні хитрування не в змозі змусити таку реакцію протікати самодовільно. З іншого боку,
термодинамічна можливість ( G 0) не означає автоматично, що реакція відбувається з реальною швидкістю, внаслідок кінетичних затруднень швидкість такої реакції може виявитися нескінченно малою. У цьому випадку підвищити швидкість реакції можна збільшенням температури, застосуванням каталізатора і т.д.
Помітьте, що з виду формули для G випливає, що роль
ентропійного фактора Т S (прагнення до хаотичності) зростає з ростом температури. При низьких температурах переважає ентальпійний фактор, і більш ймовірним стає протікання
екзотермічних ( Н 0) реакцій. У загальному випадку температурний інтервал, у якому реакція термодинамічно
можлива, залежить від співвідношення знаків і величин Н і
S (табл.1).
Для ізольованих систем, що не обмінюються з навколишнім середовищем ні речовиною, ні енергією, умовою самодовільного протікання процесів є збільшення ентропії:
S 0 .
Стандартну зміну енергії Гіббса G 0298 хімічної реакції при стандартній температурі (Т = 298 К) можна обчислити по
71
довідковим даним, користуючись рівнянням (1) при Ф = G.
Таблиця 1 Спрямованість протікання реакцій при різних знаках Н і S
|
Знак зміни функції |
Можливість самодовільного |
|
|||
|
Н |
S |
G |
протікання реакції |
|
|
|
|
+ |
|
Можлива при будь-яких |
|
|
|
температурах |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Можлива при досить низьких |
|
|
|
температурах (Т < H/ S) |
|
||||
|
|
|
|
|
||
|
+ |
+ |
|
Можлива при досить високих |
|
|
|
температурах (Т > H/ S) |
|
||||
|
|
|
|
|
||
|
+ |
|
+ |
Неможлива при будь-яких |
|
|
|
температурах |
|
|
|||
|
|
|
|
|
|
|
|
При |
температурах, |
відмінних від |
стандартної, |
||
G T0 приблизно розраховують по рівнянню: |
|
|
||||
|
|
|
G T0 Н0298 Т S 0298 . |
(2) |
||
При цьому зневажають залежностями від температури як
Н, так і S, які для реакції звичайно дуже слабі. Для S це справедливо в тому випадку, коли в заданому температурному інтервалі не відбувається зміни агрегатного стану речовини.
Приклад 4. Установіть, чи можлива реакція взаємодії водяної пари з коксом (вуглецем) з утворенням водяного газу (CO і Н2) за стандартних умов і стандартної температури. У випадку негативної відповіді, визначте температурний інтервал, у якому ця взаємодія можлива.
Розв’язання. Записуємо рівняння реакції і стандартні значення енергії Гіббса, ентальпії й ентропії речовин, що беруть участь у ній (додаток 6).
G 0298 , кДж/моль |
С(к) + Н2О(г) = СО(г) + Н2(г) |
|||
0 |
-228,6 |
-137,1 |
0 |
|
Н0298 , кДж/моль |
0 |
-241,8 |
-110,5 |
0 |
|
|
72 |
|
|
S 0298 , кДж/(моль К) 5,7 188,7 |
197,5 130,5 |
Розраховуємо зміну енергії Гіббса при стандартній температурі:
Gх.р. = [ G 0298 (CO) + G 0298 (Н2)] - [ G 0298 (C) + G 0298 (Н2О)] = = (-137,1 + 0) – (0 – 228,6) = 91,5 (кДж) 0.
Оскільки Gх.р. 0, при стандартній температрі реакція термодинамічно неможлива.
Для визначення температурного інтервалу, в якому реакція можлива, обчислюємо зміни ентальпії й ентропії процесу :
Нх.р. = |
[ Н0298 (CO) + [ Н0298 (Н2)] - [ Н0298 (C) + |
Н0298 (Н2О)] = |
= (-110,5 + 0) – (0 – 241,8) = 131,3 (кДж); |
|
|
Sх.р = |
[ S 0298 (CO) + S 0298 (Н2) ] - [ S 0298 (C) + |
S 0298 (Н2О) ] = |
= (197,5 +130,5) – (5,7 +188,7) = 133,6 (Дж/К) = 0,1336 (кДж/К).
Підставляємо розраховані значення в рівняння (2) (зверніть увагу на необхідність переведення розрахованої зміни ентропії у реакції із Дж/К у кДж/К):
G 0 = 131,3 – 0,1336 Т ( кДж). T
Звідси видно, що при низьких температурах G 0T 0, і пряма реакція неможлива. Однак з ростом Т величина G 0T знижується, обертається в нуль при температурі Тгр :
0 = Н0298 - Тгр S 0298 ,
Тгр = Н0298 / S 0298 = 131,3/0,1336 983 К.
При Т Тгр величина G 0T стає від ємною. Таким чином, реакція у прямому напрямку стає термодинамічно можливою
при Т 983К. |
|
|
|
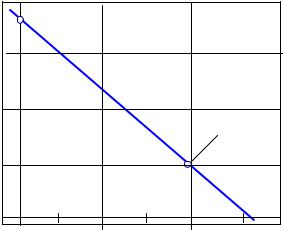
Для наочності і більш |
детального аналізу розв’язку |
||
рекомендується побудувати |
графік залежності G |
0 |
від Т |
T |
|||
(рис.1). Оскільки згідно з рівнянням (2) така залежність апроксимується прямою, для її побудови зручно нанести на
графік дві точки: а) при Т = 0 К: G
0 T
= Н0298 і б) при Т= Тгр :
73
0 |
|
|
|
G T = 0, після чого провести пряму лінію через ці дві точки. |
|||
Із побудованого графіка видно, що пряма, яка відображає |
|||
температурну залежність енергії Гібса реакції переходить в |
|||
область від’ємних значень при Т > Тгр = 983 К. Це означає, що |
|||
саме в цій області температур реакція стає термодинамічно |
|||
можливою. |
|
|
|
Go, |
|
|
|
100 |
|
|
|
50 |
|
|
|
|
|
|
Тгр |
0 |
|
|
|
- 50 |
|
|
c |
0 |
500 |
1000 |
103/T, K-1 |
Рис.1. |
Температурна залежність Go |
||
|
(приклад 4) |
|
|
У промисловості водяний газ одержують при температурах близьких до 1000К.
Для вивчення ізохорно-ізотермічних процесів користуються енергією Гельмгольця F = U - T S, для якої міркування такі ж, як і для G.
Зв язки між основними термодинамічними функціями можна зобразити нижченаведеною діаграмою.
Величині Т S відповідає зв'язана енергія – та частина повного запасу енергії, що не може бути перетворена у роботу.
Звідси величина G = H - Т S характеризує ту частину повної енергії, що може бути перетворена у корисну роботу, тому
74

енергію Гіббса раніше називали також вільною енергією.
 H
H
|
|
U |
P |
V |
T |
S |
F |
P |
V |
T |
S |
|
G |
|
Приходимо до висновку, що усі процеси в природі самочинно відбуваються у такому напрямку, що відповідає зменшенню можливості системи виробляти корисну роботу.
ДОМАШНЄ ЗАВДАННЯ
1. Визначте теплоту згоряння одного кубометра (н.у.) метану СН4 і пропану C3Н8. Який з цих двох газів вигідніше застосовувати в якості балонного газоподібного палива?
Відповідь:-35813; -91241 кДж.
2. Розрахуйте теплові ефекти реакцій згоряння одного моля етану C2Н6, етилену C2Н4 і ацетилену С2Н2. Який з цих трьох газів вигідніше застосовувати для зварювання металів?
Відповідь: -1423; -1218; -802 кДж.
3. Обчисліть теплові ефекти реакцій металотермічного утворення 1 кг заліза в реакціях:
Fe2O3 + 2 Al = Al2O3 + 2 Fe
Fe2O3 + 2 Cr = Cr2O3 + 2Fe
Чи можна ці реакції використовувати для зварювання сплавів на основі заліза? Відповідь: - 7623; -5521 кДж.
4. Обчисліть тепловий ефект реакції відновлення оксиду заліза (II) воднем, виходячи з наступних термохімічних рівнянь:
I. FeO(к)
II. CO(г)
III.Н2(г)
+ CO(г) = Fe(к) +CO2(г) , НI = - 13,18 |
кДж |
|
+ ½O2(г) = CO2(г) , |
НII = -283,0 |
кДж |
+ ½O2(г) = Н2О(г) , |
НIII =-241,83 кДж |
|
75
Відповідь: + 28,0 кДж.
5. Порівняйте теплові ефекти за стандартних умов реакцій відновлення оксиду заліза (III) різними відновниками:
а) Fe2O3(к) + 3Н2(г) = 2 Fe(к) + 3Н2О(г)
б) Fe2O3(к) + 3С(графіт) = 2 Fe(к) +3 CO(г)
в) Fe2O3(к) + 3 CO(г) = 2 Fe(к) + 3 CO2(г) Відповідь: 97,4; 490,7; -26,8 кДж.
6. Обчисліть стандартні зміни енергії Гіббса і визначте, які з наступних реакцій можна використувати для одержання металів з їх оксидів:
а) Fe2O3(к) + 2 Al(к) = 2 Fe(к) +Al2O3(к)
б) 3СаО(к) + 2 Al(к) = 3Са(к) + Al2O3(к)
в)Cr2O3(к) + 2 Al(к) = 2Cr(к) + Al2O3(к)
г) Fe2O3(к) + 2Cr(к) = 2 Fe(к) +Cr2O3(к) . Відповідь: -842; 231; -532;-310 кДж.
7. Чи можна знайти каталізатор, здатний викликати розкладання води на водень і кисень при кімнатній температурі? Відповідь мотивуйте розрахунком зміни енергії Гіббса для зазначеної реакції за стандартних умов.
Відповідь: +237,3 кДж/моль Н2О. 8. Пряма чи зворотна реакція може протікати за
стандартних |
умов |
у системі: 2NO(г) |
+ О2(г) |
2NO2(г). |
Відповідь мотивуйте обчисленням G 0298 |
прямої реакції. |
|||
|
|
Відповідь: - 70,2 кДж |
||
9. Обчисліть |
Н0298, |
S0298 , G0298 реакції |
відновлення |
|
оксиду заліза (III) воднем: Fe2O3(к) + 3Н2(г) = 2 Fe(к) +3Н2O(г). За яких температур можлива ця реакція?
Відповідь: Н0298 = +96,8 кДж, S0298 =141,8 Дж/К,G0298 = 54,5кДж, Т=683К
10. Відновлення магнетиту Fe3O4 оксидом вуглецю(II) йде за рівнянням: Fe3O4(к) + СО(г) = 3FeО(к) + СО2(г). Обчисліть Н0298 ,
76
S 0298 і визначте, за яких температур можливе самодовільне протікання цієї реакції.
Відповідь: H 0298 = +39,7 кДж,
S 0298 = +52,4 Дж/К, Т= 758К.
8. ШВИДКІСТЬ РЕАКЦІЙ І ХІМІЧНА РІВНОВАГА
Мета вивчення теми:
-оволодіти основними законами, правилами і рівняннями хімічної кінетики;
-складати кінетичні рівняння для гомогенних і гетерогенних реакцій;
-розраховувати зміну швидкості реакцій при зміні концентрацій реагуючих речовин і температури;
-складати вирази для констант рівноваги оборотних гомогенних і гетерогенних реакцій;
-визначати напрямки зміщення рівноваги при зміні умов існування систем за принципом Ле Шательє;
-розраховувати константи рівноваги реакцій за умовами різноманітних задач.
Середня швидкість гомогенних хімічних реакцій – це зміна концентрації речовини за одиницю часу:
v |
c2 |
c1 |
|
c |
, |
|
1 |
|
|||
2 |
|
|
|
||
де с зміна концентрації речовини, що бере участь у реакції,
яка відбувається за час (знак " " береться для реагенту, а знак "+" для продукту реакції; ці знаки завжди вибираються так, щоб швидкість була позитивною величиною). Миттєва (дійсна) швидкість дорівнює похідній концентрації за часом:
v lim |
c |
dc |
0 |
|
d |
Результати експериментального дослідження кінетики реакції графічно часто виражають у вигляді кінетичної кривої, що відбиває зміну концентрації речовини за час перебігу
77

реакції. Кінетична крива дозволяє, зокрема, визначати швидкість реакції в кожний момент часу.
Приклад 1. Результати експериментальних вимірів концентрації пентаоксиду діазоту по ходу його дисоціації за рівнянням
2 N2O5(г) 4 NO2(г) + O2(г)
при 308 К представлені в наступній таблиці
Вимір |
1 |
2 |
3 |
4 |
5 |
|
|
|
|
|
|
Час, 103 с |
0 |
4 |
8 |
12 |
16 |
[N2O5], ммоль/л |
2,57 |
1,50 |
0,87 |
0,51 |
0,30 |
|
|
|
|
|
|
Визначте швидкість дисоціації через 1,5 години після початку реакції.
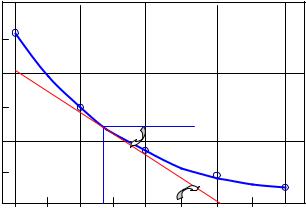
Розв’язання. Побудуємо кінетичну криву графік залежності концентрації вихідної речовини від часу реакції (рис.1). Дійсна швидкість у заданий момент часу є (зі знаком
мінус) похідна функції [N2O5] = f( ) при значенні аргументу:
= 1,5 год = 1,5 3600 = 5,4 103 с. На графіку це тангенс кута нахилу дотичної до кривої при зазначеному
значенні аргументу. Для обчислення tg у даному випадку зручно використовувати відрізки, що відтинаються дотичною на відрізках прямих, що паралельні осям координат:
v = tg = ab/bc = 2,1 10-3/12,2 103 = 1,7 10-7 моль/(л с).
Розрахована швидкість не занадто велика – реакція протікає при невисокій температурі.
Швидкість гомогенної реакції залежить від природи реагуючих речовин, їх концентрацій (або тиску для газів), температури, наявності каталізатора.
Залежність швидкості реакції від концентрацій реагуючих речовин встановлює закон діючих мас:
Для одностадійної (елементарної) реакції швидкість реакції пропорційна добутку концентрацій реагуючих речовин у
78
[N2O5] 103, моль/л 3,0
2,0 |
a |
|
|
|
|
|
|
|
|
|
|
||
1,0 |
|
|
|
|
|
|
0,0 |
b |
|
|
c |
|
|
0 |
4 |
8 |
12 |
16 |
||
|
||||||
|
|
|
|
|
10-3, |
Рис.1. Кінетична крива дисоціації N2O5
ступенях їх стехіометричних коефіцієнтів в рівнянні реакції.
Математичний вираз закону діючих мас називається кінетичним рівнянням. Для одностадійної гомогенної реакції, записаної у загальному виді:
аА + bВ сС + dD |
(1) |
кінетичне рівняння має вигляд:
v k ca (A) cb (B),
де k – константа швидкості реакції. Вона залежить від природи реагуючих речовин, температури, наявності каталізатора, але не залежить від концентрацій реагуючих речовин і часу перебігу реакції.
Для хімічних реакцій у розчинах в кінетичне рівняння не включають концентрацію розчинника, тому що вона практично не змінюється в ході реакції. З тієї ж причини для гетерогенних реакцій у це рівняння не включають концентрації твердих і однокомпонентних (чистих, не
79
утворюючих розчинів) рідких фаз, тому що вони залишаються постійними при перебігу реакції.
Приклад 2. Напишіть кінетичні рівняння наступних реакцій, вважаючи їх одностадійними:
а) 2Н2(г) + О2(г) 2Н2О(г) б) С(гр.) + О2(г) СО2(г)
Розв’язання. а) Взаємодія між газами – це гомогенна реакція. Її кінетичне рівняння:
v k c2 (H2 ) c(O2 )
б) Реакція між графітом і киснем – це гетерогенна реакція, вона перебігає на поверхні графіту. Оскільки концентрації твердих речовин (у даній реакції – графіту) величини постійні, то вони включаються в вираз константи швидкості реакції, а в саме кінетичне рівняння не записуються:
v k c(O2 )
Зміна тиску в системі, яка містить гази, приводить до відповідної зміни їх концентрацій. Вплив цих факторів на швидкість реакції однотипний.
Приклад 3. Розрахуйте, у скільки разів зросте швидкість реакції
2NO(г) + О2(г) 2NO(г)
при збільшенні тиску в системі в три рази.
Розв’язання. Позначимо концентрації вихідних речовин NO і О2 до зміни тиску відповідно с(NO) і с(О2). Залежність швидкості реакції від концентрацій реагуючих речовин до зміни тиску буде виражатися рівнянням:
v1 k c 2 (NO) c(O 2 )
При збільшенні тиску в системі у три рази концентрації усіх газів в системі теж зростуть в три рази і будуть дорівнювати 3с(NO) і 3с(О2). Залежність швидкості реакції від концентрацій реагуючих речовин після збільшення тиску в системі у три рази буде визначатися рівнянням:
v2 k (3c(NO))2 3c(O2 ) 27k c2 (NO) c(O2 )
80
