
Химия_1 / prakticheskie
.pdf
(промотується) на вільну орбіталь вищого підрівня. У результаті ковалентність зростає на дві одиниці:
S* |
S** |
КВ=4 |
КВ=6 |
У залежності |
від співвідношення відносних |
електронегативностей (ЕН) атомів, що утворюють зв'язок,
розрізняють полярний і неполярний ковалентні зв'язки. Якщо зв'язок утворений атомами з однаковою ЕН, загальні електронні пари будуть належати обом атомам в однаковій мірі, і утворений зв'язок буде неполярним. Наприклад, у гомоядерних (що утворені однаковими атомами) молекулах
H2, О2, N2:
H : H O :: O N ::: N
Коли зв'язок утворюється атомами з різними ЕН, спільна електронна пара зміщується у бік атома більш електронегативного елемента, й утворений зв'язок стає полярним. На більш електронегативному атомі виникає деякий надлишок негативного заряду (δ-), а на менш електронегативному – його недостача (δ+), і двохатомна
молекула являє собою диполь: + |
- . |
Відстань між центрами ваги |
позитивного і негативного |
зарядів називається довжиною диполя l. Кількісною мірою
полярності зв'язку служить дипольний момент , що дорівнює добуткові довжини диполя l на його електричний заряд q,
тобто = l · q. Одиниця виміру дипольного моменту зв'язків та молекул – дебай, позначається D (1D = 3,33·10-30 Кл·м). Кількісно про полярність зв'язку можна судити також по
різниці електронегативностей атомів ( ЕН). Чим вона більша, тим полярність зв'язку вища.
51
Приклад 3. Як змінюється полярність зв'язку в ряду: HF, HCl, HBr, HI?
Розв’язання. Оцінимо полярність зв'язку в кожній молекулі, обчисливши різницю електронегативностей атомів,
що утворюють зв'язок: |
|
|
|
|
|
|
||
|
H - |
F, |
H - Cl, |
H - Br, |
H - I |
|||
ЕН 2,1 |
4,0 |
2,1 |
3,0 |
2,1 |
2,9 |
2,1 |
2,6 |
|
ЕН |
1,9 |
0,9 |
0,8 |
0,5 |
||||
Різниця ЕН у ряду зменшується, отже, полярність зв'язку в |
||||||||
ряду HF, HCl, HBr, HI також зменшується. |
|
|
||||||
Повний перехід загальної електронної |
пари до більш |
|||||||
електронегативного елемента приводить до утворення іонного зв'язку. Іонний зв'язок утворюється тоді, коли атоми, що приймають участь в утворенні хімічного зв'язку, сильно відрізняються електронегативністю. Наприклад, Na і F
утворюють NaF – сполуку з іонним зв язком.
Хімічні зв'язки формуються електронами не тільки на незмінних АО, а і на "змішаних", так званих гібридних орбіталях. Це відбувається тоді, коли в утворенні зв'язку приймають участь електрони різних, але близьких по енергії орбіталей, наприклад, s- і p-електрони одного рівня. При гібридизації первісна форма й енергія атомних орбіталей змінюються і утворюються гібридні орбіталі, нової, вже однакової форми й енергії. Запам'ятайте, що число гібридних орбіталей завжди дорівнює сумарному числу вихідних орбіталей. Крім того, гібридна електронна хмара асиметрична: має більшу витягнутість по одну сторону від ядра. Тому хімічні зв'язки, утворені за участю гібридних орбіталей, мають більшу міцність. В той же час, гібридні орбіталі через взаємне відштовхування розташовуються в просторі найбільш симетрично (під максимальним кутом одна до одної).
Приклад 4. Визначте тип гібридизації і геометрію молекул
BeCl2 , AlCl3, і SiН4.
Розв’язання. а) Розглянемо електронну структуру атомів
52
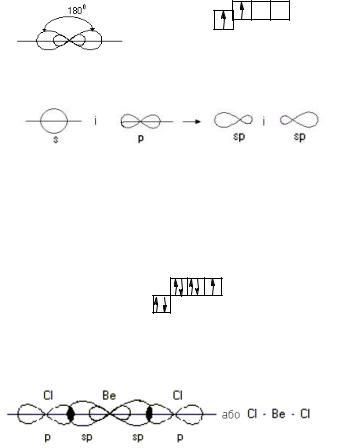
Вe і Cl. У стаціонарному стані атом берилію не має неспарених валентних електронів і не може утворити зв'язки шляхом їх спарювання з електронами інших атомів. У збудженому стані один з електронів промотується на вільну р-орбіталь і тепер атом берилію спроможен надавати для
утворення зв язків одну s- і одну p-орбіталі.:
Be 2s2 |
Be* 2s12p1 |
Різні за формою й енергією s- і p-орбіталі гібридизуються й утворюють дві sp-гібридні орбіталі, розташовані одна відносно одної під кутом 1800 :
або якщо розглядати їх разом:
Такий тип гібридизації називається sp-гібридизацією. Валентною орбіталлю атома хлору є p-орбіталь (Cl 3s2 3p5):
3p |
3s |
Отже, ковалентні зв'язки в молекулі BeCl2 утворюються перекриванням sp-гібридних орбіталей атома берилія з двома p-орбіталями двох атомів хлору:
Зв'язки спрямовані під кутом 1800, молекула BeCl2 має лінійну форму.
б) Електронна структура валентної оболонки атома алюмінію має вигляд: 3s23p1 :
53

3p |
3s |
У стаціонарному стані атом алюмінію має один неспарений електрон і може утворити за обмінним механізмом лише один хімічний зв'язок. Ковалентність атома алюмінію, що дорівнює трьом, можлива у збудженому стані атома: Al* 3s13p2
3p |
3s |
Одна s- і дві р-орбіталі атома алюмінію в момент утворення зв'язку перетворюються в три sp2-гібридні орбіталі, розташовані в одній площині під кутом 1200.
120o
Такий тип гібридизації називається sp2–гібридизацією. Ковалентні зв'язки у молекулі AlCl3 утворюються перекриванням трьох sp2–гібридних орбіталей атома алюмінію з трьома p-орбіталями трьох атомів хлору. Гібридні зв'язки спрямовані під кутом 1200. Ядра всіх взаємодіючих атомів лежать в одній площині. Молекула має форму плоского трикутника.
54

в) Ковалентність кремнію Si, що дорівнює 4, можлива при
збудженні його атома: |
|
Si 3s23p2 |
Si* 3s13p3 |
3p |
3s |
3p |
3s |
При гібридизації однієї s- і трьох p-орбіталей атома кремнію утворюються чотири sp3 - гібридні орбіталі, спрямовані від центра тетраедра до його вершин під кутом
109028 . Такий тип гібридизації називається sp3-гібридизацією. Ковалентні зв'язки в молекулі SiН4 утворюються шляхом перекривання чотирьох sp3-гібридних орбіталей атома кремнію з чотирма s-орбіталями чотирьох атомів водню (H 1s1). Молекула SiН4, що утворюється, має тетраедричну форму.
Крім розглянутих вище, існують і інші типи гібридизації. У елементів третього і наступних періодів в утворенні гібридних орбіталей і відповідних їм просторових конфігурацій молекул можуть брати участь d- і f-орбіталі, наприклад, sp2d-, sp3d-, sp3d2- гібридизації. Найбільш розповсюджені типи гібридизацій і просторові структури молекул приведені в таблиці.
Можливий і інший механізм утворення ковалентного зв'язку, а саме при взаємодії частинок, одна з яких має неподілену пару електронів (A:), інша – вільну орбіталь ( B):
B):
A: +  B
B  A : B
A : B
55
Частинка, що надає для зв'язку електронну хмару, називається донором. Частинка з вільною орбіталлю, що приймає цю електронну пару, називається акцептором. Механізм утворення ковалентного зв'язку у такий спосіб називається донорно-акцепторним.
|
|
|
Таблиця |
Гібридизація і просторові структури молекул |
|||
|
|
|
|
Тип |
Розміщення |
Структура і склад |
Приклади |
гібридизації |
електронних пар |
сполук |
сполук |
sp |
Лінійне |
Лінійна АХ2 |
BeH2 , BeCl2 , |
|
|
|
CO2 |
sp2 |
Трикутне |
плоска |
SO3, BF3, |
|
|
тригональна АХ3, |
NO3-, CO32- |
|
|
кутова зігнута |
SO2 , O3 , |
|
|
АХ2 |
SnCl2 |
sp3 |
Тетраедричне |
тетраедр AX4 |
CH4 , CF4 , |
|
|
тригональна |
NH4+ , SO42- |
|
|
NH3 , PF3 , |
|
|
|
піраміда AX3 |
SO32- |
|
|
кутова зігнута |
H2O, H2S, |
|
|
AX2 |
OF2 |
|
|
|
|
sp3d |
Тригональне- |
тригональна |
PCl5 , PF5 , |
|
біпірамідальне |
біпіраміда AX5 |
AsF5 |
|
|
неправильний |
SF4 , TeCl4 |
|
|
тетраедр AX4 |
ClF3 |
|
|
Т-подібна AX3 |
|
|
|
Лінійна AX2 |
XeF2, ICl2- |
sp3d2 |
Октаедричне |
октаедр AX6 |
SF6 , PF6- , |
|
|
|
SiF62- |
|
|
квадратна |
IF5 , SbF52- |
|
|
піраміда AX5 |
XeF4, ICl4- |
|
|
плоский квадрат |
|
|
|
AX4 |
|
sp3d3 |
Пентагонально- |
пентагональна |
IF7 |
|
біпірамідальне |
біпіраміда AX7 |
|
|
|
неправильний |
XeF6 |
|
|
октаедр AX6 |
|
56
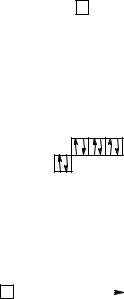
Приклад 5. Описати з позиції методу ВЗ утворення іона тетрафтороборату BF4 .
Розв’язання. Утворення іона BF4 можна представити так:
BF3 + F- BF4
Молекула BF3 утворюється аналогічно молекулі AlCl3, розглянутої в прикладі 4(б).
В утворенні молекули BF3 беруть участь 3 електрони атома бора і три електрони трьох атомів фтору за схемою:
..
:F:
.. ..
:F:B
.. ..
:F:
..
Зі схеми видно, що у атома бора є вакантна (вільна) орбіталь. Отже, в утворенні ковалентного зв'язку по донорноакцепторному механізму атом бору може виступати у ролі
акцептора. Електронна структура валентної оболонки іона F- має вигляд: F- 2s2 2p6.
2p |
2s |
Іон фтору, що має чотири неподілені пари електронів, є донором електронів. Надаючи одну з чотирьох неподілених електронних пар атому бору, іон F- утворить з ним ковалентний зв'язок по типу донорно-акцепторного.
F |
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
F |
|||
|
|
|
|
|
|
|
||||
.. |
|
.. |
- |
|
|
|
|
|
||
|
+ |
|
.. |
|
|
|||||
F:B |
:F : |
|
|
|
F :B : F |
|
||||
|
|
|||||||||
.. |
|
.. |
|
|
.. |
|
|
|||
F |
|
|
|
|
|
|
|
F |
|
|
ДОМАШНЄ ЗАВДАННЯ
Визначте тип хімічного зв'язку, ковалентність і ступінь окиснення елементів у наступних сполуках:
1.H2S, Cl2, KI, NH4Cl, NH3;
2.HF, CCl4, O2, N2, KF.
Визначте валентність і ступінь окиснення азоту і вуглецю
57
в молекулах:
3.N2, NH3, N2H4, NH2OH, NF3;
4.CH4, CCl4, C2H4, C2H6 , C2H2..
5.Чому дорівнює ковалентність фосфору у стаціонарному та збудженому станах? Які атомні орбіталі беруть участь в утворенні сполук PCl3 і PCl5?
6.У стаціонарному чи збудженому стані знаходяться атоми фосфору, сірки і миш'яку при утворенні молекул: PCl3 та PCl5;
H2S та SO3; AsH3 та H3AsO4?
7.Зобразіть електронну схему утворення молекул Cl2, H2, N2. Поясніть, чому молекула азоту має високу міцність?
8.Як повинні змінюватися значення дипольних моментів
молекул у ряду: NH3, PH3, AsH3? Покажіть також малюнком, чому векторна сума диполів зв'язків виявляється різною для двох трьохатомних молекул CO2 і H2O?
9.Чому вода і фтороводень, маючи меншу молекулярну масу, киплять при більш високих температурах, чим водневі сполуки їхніх аналогів по підгрупі?
10.Простежте утворення іона [Zn(NH3)4]2+ по методу ВЗ. Яка геометрія цього іона?
11.Вкажіть, як змінюється полярність зв'язків у ряду: H2O, H2S, H2Se, H2Te.
Визначте тип гібридизації атомних орбіталей і геометрію молекул у сполуках:
12.SiF4, BeF2, AlF3.
13.BeH2, SiH4, BBr3.
14.AlCl3, CH4, CS2.
15.BCl3, BeCl2, SiH4.
16.C2H2, C2H4, C2H6.
17.Поясніть, чому максимальна ковалентність фосфору може бути рівною п'яти, а в азоті такий валентний стан відсутній?
58
18.Електричний момент диполя молекули PH3 дорівнює 0,18 10-29 Кл м. Обчисліть довжину диполя молекули PH3.
19.Визначте, у якому з оксидів елементів третього періоду періодичної системи Д.І.Менделєєва зв'язок Э – О найбільше наближається до іонного.
20.Які типи хімічного зв'язку між атомами є в іоні NH4+? Покажіть схему утворення цього іона з молекули NH3 і іона
H+.
6. КОМПЛЕКСНІ СПОЛУКИ
Мета вивчення теми:
-аналізувати склад та будову комплексної сполуки; визначати комплексоутворювач (М), ліганди (L),
-визначати заряд комплексної частинки, координаційне число (КЧ) і ступінь окиснення комплексоутворювача;
-розрізняти катіонні, аніонні і нейтральні комплексні сполуки;
-визначати природу хімічного зв’язку в комплексних сполуках;
-складати рівняння дисоціації комплексних сполук у водних
розчинах і вираз для константи нестійкості Кн комплексного іона;
-розрізняти подвійні та комплексні солі;
-складати рівняння реакцій утворення комплексних сполук, рівняння реакцій обміну за участю комплексних сполук у молекулярному та іонному виглядах.
Комплексні сполуки (КС) – це складні сполуки, які містять стійкі у розчинах комплексні частинки, що мають центральний атом. Згідно з координаційною теорією А.Вернера, центральне місце в молекулі КС займає комплексоутворювач (М), навколо якого координуються ліганди (L). Комплексоутворювач та ліганди утворюють внутрішню сферу (або комплексний іон). У ролі М найчастіше виступають катіони d-елементів , а у ролі лігандів – аніони або
59
нейтральні молекули (NH3, H2O,OH-, F-, Cl-, Br-, CN-, CNS-, NO2- та ін.). Алгебраїчна сума зарядів комплексоутворювача і лігандів визначає заряд комплексного іона. У залежності від заряду комплексного іона розрізняють катіонні, аніонні і нейтральні КС. Координаційне число (КЧ) комплексоутворювача визначається числом місць наданих комплексоутворювачем лігандам і, частіше за все, в два рази більше за ступінь окиснення комплексоутворювача.
Зовнішня сфера КС складається з позитивних або негативних іонів, які не ввійшли до внутрішньої сфери комплексної сполуки. Якщо ми маємо нейтральну комплексну частинку, зовнішня сфера взагалі відсутня.
Приклад 1. Визначте комплексоутворювач, ліганди, заряд комплексного іона і координаційне число комплексоутворювача у сполуках: [Ni(NH3)3Cl]Cl; [Cr(NH3)6](OH)3.
Розв’язання: [Ni2+(NH3)30Cl-]+Cl. В даній КС в зовнішній сфері знаходиться один хлорид-іон (Cl-), значить, комплексний іон має заряд 1+ (катіонний комплекс). В комплексному іоні комплексоутворювачем є Ni2+, а лігандами
– три молекули NH3 і один хлорид-іон. Ступінь окиснення М визначаємо за різницею між зарядом комплексного іона та
сумарним зарядом лігандів: (1+) – [3 0+1 (-1)] = +2. Число
лігандів дорівнює чотирьом, тому КЧ = 4. [Cr+3(NH3)60]3+(OH)3¨
В даній КС у зовнішній сфері знаходиться три ОН- групи, тобто заряд комплексного іона 3+. Комплексоутворювачем є Cr+3, а лігандами – шість нейтральних молекул аміаку NH3.
КЧ= 6.
Приклад 2. Дано ряд частинок: Cu2+, NH30, CN-, K+, NO3-. Складіть з них формули аміачного і ціанідного комплексів.
Розв’язання: З усіх частинок комплексоутворювачем може бути тільки Cu2+ (d-елемент), його КЧ дорівнює 4.
60
