
Химия_1 / prakticheskie
.pdfТоді:
v |
2 |
|
27k c2 (NO) c(O |
2 |
) |
27 |
|
v |
k c2 (NO) c(O |
2 |
) |
|
|||
|
|
|
|||||
|
1 |
|
|
|
|
|
|
При збільшенні тиску в системі, де проходить ця реакція, в три рази швидкість реакції зростає в 27 разів.
Приклад 4. У реакційній посудині відбувається реакція:
А(г) + 2В(г) С(г)
Константа її швидкості при даній температурі дорівнює
0,4 л2/(моль2 с), а початкові концентрації складали 0,3 моль/л і 0,5 моль/л для речовин А і В відповідно. Обчисліть швидкість цієї реакції в початковий момент часу, а також після того, як прореагує 0,1 моль/л речовини А.
Розв’язання. Запишемо під формулами речовин у рівнянні реакції їх молярні співвідношення, дані з умов задачі і невідомі величини, що необхідно обчислити:
А(г) + 2В(г) С(г)
1 моль |
2 моль |
1 моль |
с0, моль/л 0,3 |
0,5 |
0 |
с, моль/л 0,1 |
x |
|
с , моль/л у |
z |
|
Розрахуємо, яка кількість речовини В прореагує з 0,1 моль речовини А:
x 0,1моль 2 моль 0,2моль 1моль
Використовуючи співвідношення с = с - с0 , розрахуємо с для речовин А і В:
с (А) = у = с0 - с = 0,3 - 0,1= 0,2 моль/л,
с (В) = z = 0,5 – 0,2 = 0,3 моль/л.
Обчислимо початкову швидкість реакції:
v0 = k c0(A) c02(В) = 0,4 л2/(моль2 с) 0,3 моль/л (0,5 моль/л)2= =3 10-2 моль/л с
і швидкість реакції в момент часу :
81
v = k c (A) c 2(В) = 0,4 л2/(моль2 с) 0,2 моль/л (0,3 моль/л)2 = = 7,2 10 2 моль/л с
швидкість реакції зменшилася приблизно у чотири рази за період часу .
Показник ступеня, з яким концентрація речовини входить у кінетичне рівняння, називається порядком реакції по даній речовині. Порядком реакції в цілому називають суму порядків реакції по всім реагуючим речовинам. Таким чином, кінетичне рівняння (1) відноситься до реакції порядку а по речовині А і порядку b по речовині В. Порядок реакції в цілому дорівнює (а+b).
Лише як випадок експериментально встановлений порядок реакції збігається зі стехиометричним коефіцієнтом в рівнянні хімічної реакції. У більшості випадків реакція перебігає не шляхом одностадійного прямого переходу частинок реагентів у частинки продуктів, а складається з багатьох простих (елементарних) стадій. Загальна швидкість і порядок реакції
визначаються найбільш повільною елементарною стадією
лімітуючою стадією процесу.
Порядок реакції по даній речовині А зручно визначати за результатами серії дослідів, у якій змінюється концентрація саме цієї речовини при постійних концентраціях інших реагентів. Тоді кінетичне рівняння реакції (1) набуває вигляд:
v = k ca(А) cb(В) = k ca(А) |
(2) |
де k = k cb(В) = const.
Після логарифмування рівняння (2) отримуємо залежність
lg v = lg k + а lg c(А) |
(3) |
що у координатах lg v lg cА відображається прямою лінією з
кутовим коефіцієнтом тангенсом кута нахилу прямої чисельно рівним порядку реакції a по речовині А.
Приклад 5. Визначте порядок реакції по кожному з реагуючих речовин і в цілому реакції окиснення хлориду заліза (II) пероксидом водню у водному розчині:
82

2FeCl2 + H2O2 = 2Fe(OH)Cl2
по наступних експериментальних даних (20оС):
Дослід |
1 |
2 |
3 |
4 |
5 |
сFeCl2, моль/л |
0,02 |
0,05 |
0,10 |
0,10 |
0,10 |
сH2O2, моль/л |
0,20 |
0,20 |
0,20 |
0,10 |
0,05 |
v, моль/(л с) |
0,32 |
0,81 |
1,58 |
0,80 |
0,40 |
Розв’язання. Для визначення порядку даної реакції по FeCl2 варто взяти результати серії дослідів 1, 2 і 3, у яких постійна концентрація H2O2 (0,20 моль/л), а для визначення порядку реакції по H2O2 – результати дослідів 3, 4 і 5 з
постійною концентрацією FeCl2 0,10 моль/л. Обробка результатів вимірів має на меті підготувати дані для побудови
графіка в координатах lg v lg cА. Для цього обчислюємо і записуємо в таблицю логарифми концентрацій і швидкостей
реакції в зазначених дослідах: |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Серія 1 |
|
4 |
|
|
Дослід |
1 |
2 |
3 |
5 |
|
|
|
|
|
|
Серія 2 |
|
|
lg сFeCl2 |
-1,70 |
-1,30 |
-1,00 |
-1,00 |
-1,00 |
|
lg сH2O2 |
-0,70 |
-0,70 |
-0,70 |
-1,00 |
-1,30 |
|
lgv |
-0,49 |
-0,09 |
0,20 |
-0,10 |
-0,40 |
Наносимо розраховані точки на графік (рис.2).
Для кожної з двох серій проводимо через нанесені точки прямі лінії так, щоб можливі (через експериментальні помилки) відхилення точок від них були мінімальні.
Для знаходження порядків розраховуємо тангенси кутів нахилу побудованих прямих. Зручно використовувати для цього відрізки, що відтинаються прямолінійними графіками на лініях, що паралельні осям координат. Щоб уникнути втрати точності, ці відрізки варто вибирати досить великими.
На рис.2 для визначення tg узяті відрізки cd і ed, а tg fg і
83
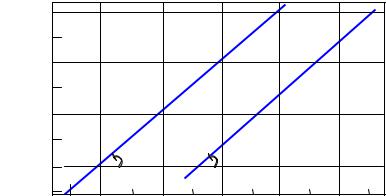
hg. По координатах точок c, d, е, f, g, h визначаємо довжини відрізків, наприклад: cd = 0,21 – (-0,40) = 0,61; ed = (-1,00) – (-1,62) = 0,62.
lg v
0,20 |
|
|
|
c |
|
|
0,00 |
|
|
FeCl2 |
c H2O2 f |
|
|
|
|
|
|
|
|
|
-0,20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,40 |
|
|
|
d |
g |
|
|
-1e,60 |
|
|
|||
|
-1,40 h -1,20 |
-1,00 |
-0,80 lg c |
|||
Рис.2. Результати двох серій дослідів: залежності |
||||||
швидкості реакції від концентрацій FeCl2 і H2O2 в |
||||||
логарифмічних координатах |
|
|
|
|
||
Обчислюємо порядки реакції:
порядок реакції по FeCl2: а = tg = cd/ed = 0,61/0,62 = 0,984; порядок реакції по H2O2: b = tg = fg/hg = 0,50/0,50 = 1,00.
Відхилення знайденого значення порядку по хлориду заліза від одиниці обумовлено, мабуть, помилками вимірів.
Висновок. Досліджена реакція має перші порядки по обох реагентах: FeCl2 і H2O2. Порядок реакції в цілому дорівнює двом. Кінетичне рівняння дослідженої реакції має вигляд
v = k с(FeCl2) с(Н2O2).
Зверніть увагу, що експериментально знайдений порядок по FeCl2 не відповідає стехіометричному коефіцієнту в рівнянні реакції. Збіг порядку і стехіометричного коефіцієнта найчастіше виявляється випадковим.
84
По встановленому кінетичному рівнянню можна розрахувати константу швидкості, використовуючи дані кожного з дослідів. Наприклад, підставляючи в кінетичне рівняння результати досліду 5,
0,40 = k 0,10 0,05
знаходимо константу швидкості дослідженої реакції при температурі дослідів
k = 0,40/(0,10 0,05) = 80 л моль–1 с–1.
Температура є одним із найсильніших чинників, що впливають на швидкість хімічної реакції. Майже завжди (а
для елементарних реакцій беззастережно завжди) швидкість реакції зростає зі збільшенням температури.
Для реакцій, що перебігають при температурах, близких до звичайних, для приблизної оцінки впливу температури на швидкість можна користуватись правилом Вант-Гоффа:
З підвищенням температури на кожні 10 градусів швидкість реакції зростає в 2 - 4 рази.
За цим правилом швидкість є степінною функцією температури:
v2 |
t2 t1 |
|
γ 10 , |
||
v |
||
1 |
|
де v1 і v2 – швидкості реакцій при температурах t1 і t2, γ - температурний коефіцієнт, який показує, у скільки разів зростає швидкість у разі підвищення температури на 10 градусів.
Приклад 6. При підвищенні температури на 200С швидкість реакції збільшилась у 9 разів. Знайдіть температурний коефіцієнт реакції. Як зміниться швидкість
цієї реакції при зміні температури від 40 до 700С і від 800С до
500С.
Розв’язання. Згідно з умовою задачі v2/v1 = 9, тоді за правилом Вант-Гоффа:
85
20
9 γ10 або 9 = 2, звідки = 3.
При підвищенні температури від 40 до 100 0С швидкість реакції збільшується в 81 раз.
70 40
v2/v1 = 3 10 = 33 = 81
Правило Вант-Гоффа є наближеним і дає розумні оцінки лише у неширокому інтервалі температур. Точну залежність,
яка зв язує константу швидкості реакції з температурою, дає
рівняння Арреніуса:
k k 0 exp( |
|
E A |
) |
(4) |
|
||||
|
|
RT |
|
|
де k0 – предекспонційний множник (частотний фактор),
ЕА – енергія активації, кДж/моль, R = 8,31 Дж/(К моль) – універсальна газова стала, Т – абсолютна температура, К. Символ ехр (експонент) вживається для більш зручного запису показової (експонентної) функції: exp z = ez.
Частотний фактор характеризує частоту коливань частинок реагуючих речовин уздовж ліній зв’язків, що розриваються, а також імовірність їх сприятливої для взаємодії орієнтації при зіткненні. Елементарний акт хімічної взаємодії протікає аж ніяк не при всякому зіткненні частинок. Необхідно, щоб вони мали деяку мінімальну надлишкову енергію, яку називають енергією активації ЕА. Вона необхідна для того, щоб частинки, що зіштовхуються, були здатні утворити активований комплекс (угруповання частинок у перехідному стані, коли розриваються старі й утворюються нові хімічні зв'язки). Множник ехр(-ЕА/RT), який називають фактором Больцмана, як раз і показує частку частинок, які мають необхідну додаткову енергію ЕА порівняно з середньою енергією теплового руху, що має порядок RT.
Лінеаризовану форму рівняння Арреніуса можна отримати логарифмуванням рівняння (4):
86
lg k = lg k0 – EA/(2,303RT) |
(5) |
де 1/lgе = 2,303 модуль переходу від натуральних до
десяткових логарифмів. У координатах lgk 1/T (ці координати називають арреніусівськими) залежність константи швидкості від температури зображується графічно прямою лінією. Відрізок, що відтинається цією прямою на вертикальній осі при (1/T) = 0, дорівнює lg k0, а нахил прямої пропорційний енергії активації:
tg = ЕА/(2,303RT) |
(6) |
Приклад 7. Визначте енергію активації реакції, якщо при зростанні температури від 500 до 1000 К константа швидкості реакції збільшилась у 100 разів.
Розв’язання. Запишемо рівняння Арреніуса в логарифмічній формі (5) для першої і другої температури:
lg k1 = lg k0 – EA/(2,303RT1) lg k2 = lg k0 – EA/(2,303RT2)
З метою отримання логарифму відношення k2/k1 віднімемо перше рівняння від другого:
lg k2 – lg k1 = (ЕА/2,303R)(1/T2 – 1/T1)
або
lg (k2/k1) = (ЕА/2,303R)(T1 – T2)/T1T2
Знаходимо величину ЕА із цього виразу:
ЕА = lg (k2/k1) 2,303 R T1T2/(T2 – T1)
ЕА = lg (100) 2,303 8,31 500 1000/(100 – 500) = 38200 Дж/моль.
За експериментальними даними енергію активації зручніше і наглядніше обчислювати графічним методом.
Приклад 8. Реакція між етилбромідом і лугом у водному розчині
C2H5Br + KOH C2H5OH + KBr
протікає по другому порядку. Визначіть енергію активації і предекспонційний множник по наступних експериментальних даних:
87
Дослід |
1 |
2 |
3 |
4 |
5 |
|
|
|
|
|
|
Т-ра, С |
25 |
30 |
35 |
40 |
45 |
|
|
|
|
|
|
k, л/(моль с) |
8,8 10-5 |
1,6 10-4 |
2,8 10-4 |
5,0 10-4 |
9,0 10-4 |
Розв’язання. Для побудови арреніусівського графіка обчислюємо значення lgk, абсолютної Т і зворотної температури 103/Т (для зручності, щоб не мати справи з малими величинами з декількома нулями після коми, множимо 1/Т на 103).
Дослід |
1 |
2 |
3 |
4 |
5 |
|
|
|
|
|
|
Т, К |
298 |
303 |
308 |
313 |
318 |
|
|
|
|
|
|
103/Т, К-1 |
3,36 |
3,30 |
3,25 |
3,19 |
3,14 |
lg k |
-4,056 |
-3,796 |
-3,553 |
-3,301 |
-3,046 |
|
|
|
|
|
|
Наносимо на графік lg k 103/Т експериментальні точки (рис.3). Вони лежать на прямій лінії без значних відхилень – температурна залежність швидкості досліджуваної реакції добре описується рівнянням Арреніуса.
Визначаємо нахил прямої:
tg = (ab/bc) = 0,89/(0,195 10-3K-1) = 4,56 103 K
Енергію активації ЕА розраховуємо з формули (6) по знайденій величині нахилу:
EA = 2,303 R tg = 2,303 8,31 (-4560) 87300 Дж/моль = =87,3 кДж/моль
Визначення предекспонційного множника k0 графічно екстраполяцією прямої до перетинання з віссю при (1/T) = 0 у даному випадку незручно через значну далекість такої осі від поля графіка. Виконаємо чисельний розрахунок, використовуючи рівняння (5) і знайдене значення енергії активації. Так як всі експериментальні точки досить добре "лягли на пряму", можна скористатися даними кожного з
88
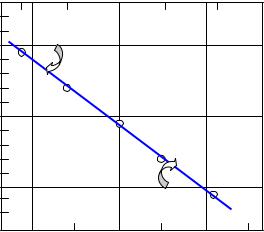
lg k |
45 |
35 |
|
25 C |
|
|
|||
-3,00 |
a |
|
|
|
|
|
|
||
|
|
|
|
|
-3,50 |
|
|
|
|
-4,00 |
b |
|
|
c |
|
|
|||
|
3,15 |
3,25 |
|
3,35 103/T, K-1 |
Рис.3. Арреніусівський графік для температурної |
||||
залежності константи швидкості |
||||
дослідів, наприклад, п'ятого.
lg k0 = lg k + EA/(2,303RT)
lg k0 = 3,046 + 87300/(2,303 8,31 318) = 3,046 + 14,348 = =11,302
звідки
k0 = 1011,302 = 2,00 1011 (л моль-1 с-1)
Хімічні реакції бувають оборотні й необоротні. Необоротні реакції відбуваються доти, поки не витратиться повністю один із реагентів. Оборотні реакції можуть перебігати як у прямому, так і зворотному напрямках. Усі гомогенні реакції належать до оборотних. Такі реакції, як і усі процеси у природі, перебігають самодовільно доти реакційна система не досягне стану рівноваги. Хімічна рівновага має
89

динамічний характер: у стані рівноваги швидкості прямої і зворотної реакцій однакові.
За умови рівноваги концентрації всіх речовин зв’язані між собою через вираз, що називають константою рівноваги. В разі зміни концентрації будь-якої з реагуючих речовин змінюються концентрації всіх інших. У результаті система переходить до нового стану рівноваги (кажуть, що рівновага зміщується), але співвідношення між рівноважними концентраціями, що виражається константою рівноваги, залишається незмінним.
Для оборотної реакції загального виду
аА + bВ сС + dD константа рівноваги К записується так:
K C c D d
A a B b
Рівноважні концентрації учасників реакції позначають формулою речовини у квадратних дужках: [А]. Це співвідношення називають законом діючих мас для хімічної рівноваги. На відміну від кінетичного рівняння, вираз для К залишається однаково вірним як для одностадійних, так і складних реакцій.
Константа рівноваги не залежить від концентрації, наявності або кількості каталізатора, а визначається природою учасників й температурою реакції.
Константа рівноваги є кількісною мірою стану рівноваги.
При К 1 концентрації речовин у рівноважній реакційній суміші одного порядку величини (приблизно однакові), при К >> 1 в такій суміші переважають продукти (рівновага зміщена вправо), а при К << 1 переважають вихідні речовини (рівновага зміщена вліво). Якщо величина константи рівноваги дуже велика, К >>> 1, у рівноважній суміші концентрації вихідних реагентів можуть бути настільки малі, що їх не можна визначити за допомогою самих чутливих приладів. У такому випадку кажуть, що реакція перебігає як
90
