
metod_uk_4sem / Волновая оптика (41-48) PDF / Мет. 42
.pdfФедеральное агентство по образованию РФ Ухтинский государственный технический университет
42
ИЗУЧЕНИЕ СЕРИАЛЬНЫХ ЗАКОНОМЕРНОСТЕЙ В СПЕКТРЕ ВОДОРОДА
Методические указания к лабораторной работе для студентов всех специальностей дневной и заочной формой обучения
Ухта
2009
УДК 53(075) Л 24 ББК 22.3 Я7
Лапина Л.Н. Изучение сериальных закономерностей в спектре водорода. [Текст]: метод. указания/ Л.Н. Лапина. – Ухта: УГТУ, 2009. – 10 с.: ил.
Методические указания предназначены для выполнения лабораторной работы по теме «Квантовая оптика. Атомная и ядерная физика. » для студентов специальностей 290700, 290300 и направлению 550100.
Содержание методических указаний соответствует рабочей учебной програ мме.
Методические указания рассмотрены и одобрены кафедрой физики от 1 1.12.08., пр. № 4 .
Рецензент: Богданов Н.П., доцент кафедры физики Ухтинского государственного технического университета.
Редактор: Северова Н.А., доцент кафедры физики Ухтинского государственного технического университета.
В методических указаниях учтены предложение рецензента и редактора.
План 2009 г., позиция |
. |
Подписано в печать . |
|
Компьютерный набор. |
|
Обьем 10 с. Тираж 60 экз. |
Заказ № |
© Ухтинский государственный технический университет, 20 169300, г. Ухта, ул. Первомайская, 13 .
Отдел оперативной полиграфии УГТУ 169300, г. Ухта, ул. Октябрьская, 13.
ИЗУЧЕНИЕ СЕРИАЛЬНЫХ ЗАКОНОМЕРНОСТЕЙ В СПЕКТРЕ ВОДОРОДА
Краткая теория
Источником, испускающим электромагнитные волны оптического диапазона, является атом. Поэтому можно изучать структуру атома по закономерностям, кот о- рым подчиняется его излучение, в частности по его спектрам излучения.
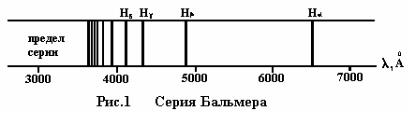
Наиболее простым атомом является атом водорода, спектр которого изобр а- жен на рис.1. Рассматривая спектр водорода, можно в расположении спектральных линий наблюдать некоторую закономерность.
В1885г. преподаватель математики швейцарской школы И. Бальмор вывел формулу, которая позволяла очень точно рассчитывать длины волн серии спе к- тральных линий расположенных в видимой области спектра водорода.
При дальнейшем исследовании спектра водорода были найдены еще нескол ь- ко серий линий водорода, лежащих в ультрафиолетовой и инфракрасной областях спектра.
Врезультате обобщения огромного экспер иментального материала была выведена эмпирическая формула, описывающая все линии спектра водорода и наз ы- ваемая формулой Бальмера - Ридберга:
1 |
|
1 |
|
1 |
|
(1) |
|
R |
|
|
|
|
|
|
|
n2 |
||||
m2 |
|
|
|
|||
где - длина волны, R – постоянная Ридберга, равная 1,097 107м-1, m и n – целые числа, имеющие для каждой серии и каждой спектральной линии вполне опред е- ленные величины, которые приведены в таблице №1:
Таблица №1 |
|
|
|
|
|
|
|
|
Значения m |
Наименование серии |
|
|
|
Значения n |
Область спектра |
||
1 |
серия Лаймана |
|
|
|
|
2,3,4 … |
ультрафиолетовая |
|
2 |
серия Бальмера |
|
|
|
|
3,4,5 … |
видимая |
|
3 |
серия Пашена |
|
|
|
|
4,5,6 … |
инфракрасная |
|
4 |
серия Броккота |
|
|
|
|
5,6,7 … |
инфракрасная |
|
5 |
серия Пфунда |
|
|
|
|
6,7,8 … |
инфракрасная |
|
Например, для серии Бальмера уравнение (1) будет иметь вид: |
||||||||
|
1 |
|
1 |
|
1 |
|
(2) |
|
|
|
|
R |
|
|
|
|
|
|
|
|
22 |
n2 |
||||
|
|
|
|
|
|
|||
где n = 3, 4, 5, …
Величина 1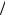 называется волновым числом, выражающим число длин волн,
называется волновым числом, выражающим число длин волн,
укладывающихся на одной единице длины.
Формула Бальмера – Ридберга (1) с большой точностью дает все известные линии спектра водорода, но она является эмпирической формулой. Теоретическ и ее удалось вывести в 1913г. датскому физику Нильсу Бору.
Чтобы объяснить устойчивость атома водорода, а также его линейчатый спектр, Н.Бор постулировал основные положения теории водородоподобного атома.
Первый постулат. Электроны в атоме движутся по некоторым стационарным орбитам без излучения.
Второй постулат. Стационарными орбитами будут те, для которых момент количества движения (импульса) электрона mVn rn равен целому кратному величины
h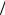 2
2
mVn rn nh
2
где n – целое число, называемое главным квантовым числом ( n = 1,2,3 …)
h – постоянная Планка, равная 6,6210-34Дж с m – масса электрона
Vn – скорость электрона на n-й орбите
rn – радиус n-й орбиты
Третий постулат. При переходе электрона с любой дальней на любую ближнюю стационарную орбиты атом испускает фотон – один квант энергии равный
h E2 E1
При этом, очевидно, атом теряет энергию
E E2 E1
Величина кванта энергии равна E и зависит от того, с какой орбиты и на какую п е- реместился электрон.
При поглощении атомом фотона происходит обратный процесс – перемещение электрона с ближней к ядру стационарной орбиты на дальнюю, и атом перех о- дит в возбужденное состояние. Так, например, переход электрона с первой стационарной орбиты на вторую совершается при поглощении атомом кванта, равного 10,17 эВ, а переход электрона со второй орбиты на третью – поглощением кванта, равного 1,88 эВ. Таким образом, атом может излучать и поглощать волны только вполне определенных частот (длин), чем обусловлен линейчатый характер водоро д- ного спектра.
Нормальным состоянием атома является такое, при котором электрон движе т- ся по самой близкой к ядру орбите ( n=1). В этом случае атом не может излучать, п о- скольку электрон не имеет возможности перейти с этой орбиты еще ближе к ядру. Энергетический уровень E=-13,55 Эв., соответствующий нормальному состоянию атома, называется нормальным уровнем: все остальные уровни называются возбу ж- денными.
Спектральные линии серии Лаймана соответствуют излучению атома водор о- да при переходе электрона со второй, трет ьей, четвертой и т.д. орбит на первую.
Линии серии Бальмора соответствуют излучению при переходе электрона с третьей, четвертой, пятой и т.д. орбит на вторую.
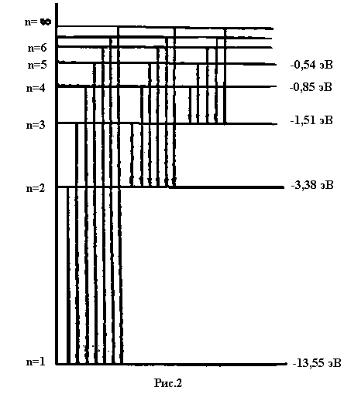
Линии серии Пашена соответствуют излучению при переходе электрона с че т- вертой, пятой, шестой и т.д. орбит на третью.
Так как газ состоит из множества различно возбужденных атомов, то в нем одновременно совершаются все возможные типы переводов электрона. Поэтому в спектре излучения водорода одновременно представлены линии всех серий (при том, конечно, условии, что атомы все время возбуждаются посредством какого - либо внешнего источника энергии). На рис.2 схематически изображены уровни энергии водородного атома и соответствующие им значения энергии.
Для водородоподобных атомов (ионизированные атомы гелия, лития и др.) сериальная формула имеет вид:
1 |
|
2 |
|
1 |
|
1 |
|
(3) |
|
Z |
|
R |
|
|
|
|
|
|
|
|
n2 |
|||||
|
|
m2 |
|
|
|
|||
где Z – порядковый номер элемента.
Целью данной лабораторной работы является измерение длин волн четырех
линий в спектре водорода H , H , H , Н (рис.1) и вычисление значения постоянной Ридберга с помощью каждого найденного значения длины волны и соответствующего ему значения числа n.
Описание прибора
Спектральными приборами называются оптические приборы, предназначе н- ные для разложения электромагнитного излучения оптического диапазона в спектр по длинам волн.
Спектральный прибор состоит из трех основных частей:
1.Коллиматора, создающего параллельный пучо к излучения.
2.Призмы или дифракционной решетки, разлагающий падающий на нее пара л- лельный пучок излучения в спектр.
3.Экрана, на котором наблюдается разложенный спектр, или фотопластинки, на которую он фотографируется.
Приборы, в которых спектр регистрируется на фотопленку или фотопластинку в широкой области спектра, называется спектрографами.
Для спектрографа ИСП-22, применяемого в работе, рабочая область спектра пр о- стирается от 2000 до 7000А.
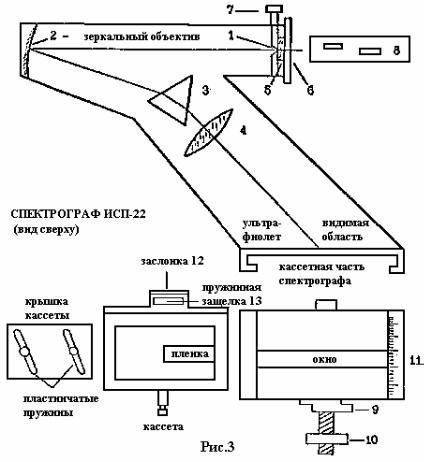
Спектрограф ИСП-22 (рис.3) состоит из массивной литой станины и ли того корпуса. На корпусе и внутри его располагаются: патрубок с входной щелью 1, о п- рава с зеркальным объективом коллиматора 2, призма 3, объектив в оправе 4.
Щель спектрографа снаружи имеет кварцевое окошко 5, закрываемое кры ш- кой 6. Барабан 7 служит для установки ширины щели (на установке снят, устано в- лена постоянная ширина щели 0,15мм). Высота спектра и его положение на пленке устанавливается с помощью диафрагмы 8, находящейся перед щелью.
На расширяющемся конце корпуса смонтирована кассетная часть спектр ографа. В кассетном держателе кассета фиксируется защелкой 9. перемещение кассеты по в ы- соте осуществляется винтом 10 и ее положение отсчитывается по шкале 11.
Заслонка кассеты 12 имеет пружинную защелку 13.
Источниками излучения являются ртутная лампа и во дородная трубка.
Выполнение работы
а) знакомство с устройством спектрографа ИСП -22
1.Освободить пружину, удерживающую водородную трубку перед щелью спектр о- графа, и отклонить водородную трубку право.
2.Поднять крышку 6 в верхнее положение вращением ее проти в часовой стрелки.
3.Через прямоугольные окна пластинки 8 пронаблюдать щель спектрографа 1 при двух положениях пластинки. Барабан 7 не вращать, чтобы не изменить устано в- ленную ширину щели (0,05мм).
4.Открыть защелку кассеты 9. Поднятием вверх и на себя за ручк и 14 снять кассету с прибора. Сдвинуть в стороны пластинчатые пружины и снять крышку. Припо д- нять внутреннюю шарнирную крышку, необходимую для прижатия пленки к кадровому окну.
5.Потренироваться на свету в зарядке кассеты, используя для этого отрезок засв е- ченной пленки. Пленка заряжается эмульсионной стороной внутрь прибора (в ы- пуклостью вверх). При этом пленка должна вплотную прилегать к правому краю окна, т.к. именно туда проектируется исследуемая в работе видимая область спектра.
6.Нажимая на пружину 13 выдвинуть вверх до упора заслонку кассеты и убедиться в правильности зарядки пленки. Опустить заслонку.
7.Поместить кассету в специальную темную кабину, находящуюся в лаборатории, и зарядить кассету свежей пленкой. Отрезки пленки длиной 9 -10см находятся в
кабине.
б) визуальное наблюдение и зарисовка спектра ртути
1.Зажечь ртутную лампу согласно инструкции, находящейся на установке. Поднять крышку 6 в верхнее положение. Пластинку с диафрагмами 8 сдвинуть в правое положение (свет лампы падает на щель 1 через верхнее окно пластинки 8).
2.Вставить в кассетный держатель стеклянную пластинку матовой стороной к себе и пронаблюдать видимые линии спектра ртути. Наложить на стеклянную пл а- стинку кальку или бумагу и зарисовать наблюдаемые линии. Записать под л и- ниями их цвет. (Водородный спектр визуально не наблюдается, т.к. его инте н- сивность очень мала).
в) фотографирование спектров ртути и водорода
Фотографирование спектров производится через нижнее окно пластинки 8, поэтому она должна быть сдвинута влево.
Спектр ртути фотографируют дважды – с короткой выдержкой и длинной при двух положениях кассеты (30 и 20мм) относительной кассетной части спектрографа. при короткой выдержке получается четкое изображение интенсивных линий спектра (желтых, зеленой, синей, фиолетовой), слабые линии (оранжевая и голубая) при этом отсутствуют. При длинной выдержке интенсивные линии получаются разм ы- тыми, но появляются слабые линии, необходимые для точного построения диспе р- сионной кривой.
Спектр водорода фотографируют один раз (отметка 25мм), при этом о казывается расположенным между двумя спектрами ртути.
Инструкция по фотографированию спектров дана на установке.
Обработка результатов
1.Наложить пленку на кальку с рисунком спектра ртути и добиться совмещения линий. Определить цвет сфотографированных лини й в видимой области спектра. Определить длины волн сфотографированных линий. (Увеличенная фотография спектра ртути с указанием длин дана на установке).
2.Провести на пленке (на эмульсионной стороне) в коротковолновой области спе к- тра роперную линию, как показано на рис.4.

3. Измерить миллиметровой линейкой расстояния от роперной линии до каждой линии ртутного спектра и результаты занести в таблицу.
Аналогичные измерения проделать для четырех линий водородного спектра. Пользуясь данными ртутного спектра построить крупно на миллиметровой бума-
ге график дисперсии, как показано на рис.5.
4.По построенному графику дисперсии определить длины волн первых четырех водородных линий: H , H , H , Н .
5.Используя полученные значения длин волн спектральных ли ний водорода вычислить постоянную Ридберга по формуле (2) для каждого значения длины во л- ны и соответствующего ему главного квантового числа n. Найти среднее значение Rэксп.
6.Оценить погрешность измерений сравнив полученное экспериментальное знач е- ние постоянной Ридберга с табличным:
|
|
|
|
R |
эксп Rтабл |
100% |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
Rтабл |
|
|
|
|
||
|
|
Таблица измерений и вычислений |
|
|
||||||||
Спектр ртути |
|
|
|
|
|
Спектр водорода |
|
Постоян- |
||||
Цвет линии |
Длина |
Расстояние |
от ропер- |
|
Линия |
|
Длина |
ная Рид- |
||||
|
волны |
ной линии |
|
|
|
волны |
берга |
|||||
оранжевая |
|
|
|
|
|
|
|
|
|
|
|
|
желтая |
|
|
|
|
|
|
|
|
|
|
|
|
зеленая |
|
|
|
|
|
|
|
|
|
|
|
|
голубая |
|
|
|
|
|
|
|
|
|
|
|
|
синяя |
|
|
|
|
|
|
|
|
|
|
|
|
фиолетовая |
|
|
|
|
|
|
|
|
|
|
|
|
Контрольные вопросы
1.Сформулируйте постулаты Бора.
2.Трудности планетарной модели атома.
3.Как объяснить линейчатый спектр испускания?
4.Выведите формулы боровских орбит.
5.Почему каждый элемент имеет свои характерные линии ?
6.Объясните принцип действия спектрографа.
7.В какой области спектра данный спектрограф обладает большей разрешающей способностью?
Литература
Т.И. Трофимова «Курс физики», 1997 г., гл. 27, § 208-212, стр. 386-393
