
- •Содержание
- •Библиографический список
- •Лабораторная работа № 1
- •Универсальный индикатор
- •Лабораторная работа № 2 Коррозия металлов
- •Лабораторная работа № 3 Влияние ионов хлора на коррозию металлов
- •Лабораторная работа № 4 Катодная и анодная защита.
- •Лабораторная работа № 5 Определение содержания различных форм углекислоты в воде
- •Лабораторная работа № 6 Оксидирование и пассивация железа.
- •Материаловедение
- •169300, Республика Коми, г. Ухта, ул. Первомайская, д. 13.
- •169300, Республика Коми, г. Ухта, ул. Октябрьская, д. 13.
Лабораторная работа № 5 Определение содержания различных форм углекислоты в воде
Угольная кислота и ее соли – постоянные компоненты природных вод. Содержание свободной угольной кислоты Н2СО3 зависит от концентрации растворенной двуокиси углерода. Так как в форме угольной кислоты находится лишь незначительная часть растворенной СO2 (около 1 %), то содержание свободной углекислоты в воде характеризуется суммой: Н2СО3 + СO2. При этом расчет ведут не на кислоту, а на СO2. Угольная кислота диссоциирует в водном растворе:
Н2СО3>Н+ + НСO3-;
НСO3- > Н+ + СО32-
Константы диссоциации для I и II ступени:
К1
=
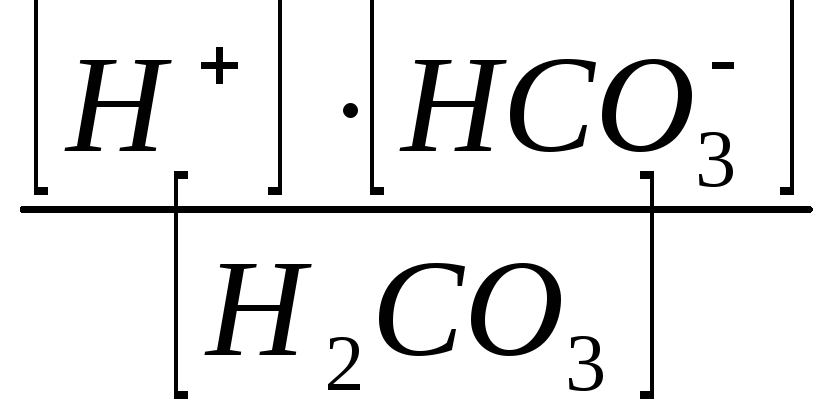 ,
К2
=
,
К2
=
 .
.
Из уравнений следует, что концентрация свободной угольной кислоты находите прямой зависимости от концентрации водородных ионов, а концентрация карбонатных ионов - в обратной. При рН< 4,2 в природных водах содержится только свободная углекислота и ионы НСО3-, причем с возрастанием рН увеличивается концентрация НСО3- ионов и понижается концентрация свободной угольной кислоты. При рН=8,4 в воде присутствуют практически только гидрокарбонаты (99,7%). При дальнейшем увеличен рН в воде наряду с НСО3-- ионами появляются СO32- ионы, которые при рН > 10 становятся преобладающими.
Связанной считается углекислота в форме карбонатов. В форме гидрокарбонатов она состоит из связанной и полусвязанной кислоты (поровну), так как при кипячении половина гидрокарбонатов переходит в свободную углекислоту:
2НСO3- = СO2 + СО32- + Н2O.
Определение свободной углекислоты
Объемное определение свободной углекислоты СO2 проводят методом нейтрализации. К исследуемой воде прибавляют NaOH, при этом СO2 переходит в гидрокарбонат:
СO2 + NaOH ↔ NaHCO3
Точка эквивалентности соответствует такому значению рН, при котором в воде находятся гидрокарбонаты (8,4). Индикатор - фенолфталеин (розовая окраска появляется при рН > 8,3). Вследствие того, что окраска титруемого раствора изменяется постепенно, конец реакции определяют, сравнивая полученную окраску с интенсивностью окраски раствора-«свидетеля». В качестве «свидетеля» применяют раствор, приготовляемый следующем образом. Вначале 2 г СuСl2·6Н2O и 2 г CuSO4·5H2O растворяют в мерной колбе емкостью 200 мл, прибавляют 2 мл концентрированной НСl и доводят до метки дистиллированной водой. Затем, разбавляя 20 мл приготовленного раствора до 200 мл исследуемой водой, получают для сравнения раствор - «свидетель». Чтобы не было потерь СO2, титруют в колбе, закрытой резиновой пробкой с отверстием, через которое и ведут титрование.
Реактивы:
1. 0,02н NaOH;
2. фенолфталеин (0,1 %).
Ход работы
В коническую колбу на 250 мл осторожно отмерить пипеткой с сифоном 100 мл исследуемой воды. Внести 2-3 капли фенолфталеина, закрыть пробкой и перемешать. Через отверстие в пробке опустить в колбу кончик бюретки с рабочим 0,02н раствором NaOH и титровать пробу до появления розового окрашивания, не исчезающего 3 мин. (сравнить с окраской «свидетеля»),
Расчет:
ХCO2
=
![]() ,
,
где ХCO2 – содержание свободной двуокиси углерода, мг/л;
V1 – объем рабочего раствора NaOH, пошедший на титрование пробы, мл;
N – нормальность рабочего раствора NaOH;
Э – эквивалент СО2 в данной реакции (44);
V2 – объем исследуемой воды, мл.
Опыт повторить три раза. Результаты записывать в виде таблицы:
|
Объем NaOH, пошедший на титрование пробы, V1, мл |
Объем исследуемой воды, V2, мл |
Содержание СО2, мг/л |
Определение карбонатов и гидрокарбонатов
При одновременном присутствии в воде ионов НСО3- и СО32- определение ведут в одной пробе, нейтрализуя рабочим раствором соляной кислоты щелочность, создаваемую этими ионами. Определение основано на изменении содержания различных форм углекислоты в зависимости от рН. В присутствии кислоты ионы НСО32- и СО32- переходят в свободную форму. Карбонаты с соляной кислотой взаимодействуют в две стадии. На первой стадии карбонаты переходят в гидрокарбонаты.
Na2CO3 +HCl ↔ NaHCO3 + NaCl
СО32- + Н+ ↔ НСО3-
Образовавшиеся гидрокарбонаты на второй стадии переходят в свободную углекислоту
Na2HCO3 + HCl ↔ Н2O + СO2 + NaCl
НСО3-+ Н+ ↔ Н2O +СO2
Таким образом, можно считать, что объем кислоты, затраченный на перевод СО32- в НСО3-, соответствует половине содержащихся в воде карбонатов. Индикатор - фенолфталеин. Проба, оттитрованная рабочим раствором кислоты в присутствии фенолфталеина, содержит гидрокарбонаты, ранее находившиеся в воде, и гидрокарбонаты, образовавшиеся из карбонатов. Гидрокарбонаты переводят в свободную углекислоту последующим титрованием пробы кислотой в присутствии метилового оранжевого.
При расчете на содержание СO32- ионов объем соляной кислоты, израсходованный на титрование пробы воды с фенолфталеином, соответственно удваивается. А при расчете количества гидрокарбонатов из объема кислоты, израсходованный на титрование воды в присутствии метилоранжа, вычитается объем пошедший на титрование с фенолфталеином.
Карбонат ионы содержатся в щелочных водах. Обычно питьевая вода не содержит карбонатов. На это указывает отсутствие розовой окраски от прибавления к пробе фенолфталеина. В этом случае в воде определяют только гидрокарбонаты титрованием кислотой в присутствии метилоранжа.
Реактивы:
1. Щелочная вода;
2. 0,1н HCl;
3. Фенолфталеин (0,1%);
4. Метилоранж (0,02%).
Ход работы
В коническую колбу на 250 мл пипеткой отмерить 100 мл исследуемой щелочной воды. Внести 2-3 капли фенолфталеина. Оттитровать 0,1н соляной кислотой до исчезновения розовой окраски. Записать объем кислоты на титрование.
К оттитрованной пробе прибавить 2-3 капли метилоранжа и титровать 0,1н HCl до появления оранжевой окраски. Объем кислоты на титрование записать.
Повторить определение с водопроводной водой.
Содержание карбонатов:
![]() ,
,
где V1 – объем 0,1н НС1, израсходованный на титрование пробы, мл;
N – нормальность раствора НСl;
Э – эквивалент СО32- (30);
V3 – объем пробы, мл.
Содержание гидрокарбонатов:
![]() ,
,
где V1 – объем 0,1н НСl, израсходованный на титрование пробы воды в присутствии метилоранжа, мл;
Э – эквивалент НСO3- (61,018).
При наличии в исследуемой воде только гидрокарбонатов, расчет ведут по формуле:
![]() ,
,
Результаты проведенных опытов записывают в виде таблицы:
|
Объем НСl, израсходованный на титрование с фенолфталеином, V1, мл |
Объем НСl, израсходованный на титрование с метилоранжем, V2, мл |
Объем пробы воды, V3, мл |
Содержание карбонатов XСO32-, мг/л |
Содержание гидрокарбонатов, XНСО3-, мг/л |
Вопросы
В каких формах содержится углекислота в воде?
От каких факторов зависит форма нахождения углекислоты в воде?
Напишите уравнения 1 и 2-й ступени диссоциации угольной кислоты.
Напишите константы диссоциации для 1 и 2-й ступени диссоциации угольной кислоты.
Каким методом проводят определение свободной углекислоты?
Какой индикатор применяют при определении свободной углекислоты?
На чем основано определение карбонатов и гидрокарбонатов в воде?
Напишите уравнения реакций карбонатов с соляной кислотой.
Объясните необходимость использования индикаторов фенолфталеина и метилоранжа при определении карбонатов и гидрокарбонатов.
Почему питьевая вода не содержит карбонатов?
