
- •Содержание
- •Библиографический список
- •Лабораторная работа № 1
- •Универсальный индикатор
- •Лабораторная работа № 2 Коррозия металлов
- •Лабораторная работа № 3 Влияние ионов хлора на коррозию металлов
- •Лабораторная работа № 4 Катодная и анодная защита.
- •Лабораторная работа № 5 Определение содержания различных форм углекислоты в воде
- •Лабораторная работа № 6 Оксидирование и пассивация железа.
- •Материаловедение
- •169300, Республика Коми, г. Ухта, ул. Первомайская, д. 13.
- •169300, Республика Коми, г. Ухта, ул. Октябрьская, д. 13.
Лабораторная работа № 3 Влияние ионов хлора на коррозию металлов
В системах подготовки и транспорта воды, используемой для хоз.-питьевых и промышленных нужд применяют наряду с железобетонными стальные и чугунные конструкции (трубы, оборудование). Вода, транспортируемая по трубам, в зависимости от ее химического состава, может являться причиной коррозионного разрушения материала труб и в то же время загрязняется продуктами коррозии.
В основном коррозия внутренней поверхности труб происходит в результате образования гальванических пар, вызванных неоднородностью металла. Неоднородность металла, в свою очередь, обусловлена различием его химического состава, плотности на различных участках, деформации и внутренних напряжений, наличием или отсутствием защитных пленок.
 В
В![]() сякое
воздействие, способствующее снятию с
металла защитной пленки или ее разрыхлению,
усиливает коррозию. Одним из наиболееэнергичных
стимуляторов коррозии является ион
хлора, действием которого обусловлено
активное разрушение металла морской
водой. Присутствие в воде
растворенного кислорода ускоряет
процесс коррозии за счет связывания ее
первичных продуктов. Присутствие в воде
хлорид-ионов, как правило, приводит
к развитию питтинговой коррозии (рис.
1) на поверхности труб и оборудования.
сякое
воздействие, способствующее снятию с
металла защитной пленки или ее разрыхлению,
усиливает коррозию. Одним из наиболееэнергичных
стимуляторов коррозии является ион
хлора, действием которого обусловлено
активное разрушение металла морской
водой. Присутствие в воде
растворенного кислорода ускоряет
процесс коррозии за счет связывания ее
первичных продуктов. Присутствие в воде
хлорид-ионов, как правило, приводит
к развитию питтинговой коррозии (рис.
1) на поверхности труб и оборудования.
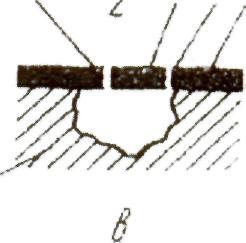
Рисунок 1 – Характерные виды питтингов: а — открытый, с защитным слоем на окружающей поверхности; б — закрытый, без окружающего защитного слоя; в — закрытый, с окружающим защитным слоем; 1 — металл; 2 — раствор; 3 — защитный слой; 4 — пористые продукты коррозии и отложения; 5 — крышка над питтингом; 6 — отверстия в крышке.
При слиянии нескольких точек и относительно небольшой их глубине наблюдается язвенная коррозия. Форма питтинга изменяется от неправильной формы (если разрушение стали происходит около неметаллических включений) до почти правильной геометрической формы. Форма питтинга и его глубина зависят от механизма коррозионного процесса и области пассивации, в некоторых случаях возможно образование сквозного питтинга (перфорации) стенок емкостей и трубопроводов.
Основные легирующие элементы (хром, никель, молибден), технологические добавки (кремний, марганец, бор, титан, алюминий, ниобий), а также примеси (углерод, азот, сера, фосфор) по-разному влияют на вероятность образования питтинга на поверхности металла. Такие элементы как углерод, азот, фосфор, бор, марганец способствуют развитию питтинговой коррозии, а молибден, никель, титан, ниобий ингибируют ее появление. Кремний, хром могут оказывать как положительное, так и отрицательное влияние на скорость питтинговой коррозии в зависимости от их концентрации в материале стали и от потенциала коррозионной среды.
Причиной возникновения питтинговой коррозии является взаимодействие локально обнаженной поверхности металла с агрессивными анионами (хлор-ионом). Для повышения стойкости против питтинговой коррозии необходима тщательная обработка поверхности металла, контактирующего с агрессивной средой (шлифование, механическое или электрохимическое полирование) и пассивация последней.
Стали, используемые в промышленности, подвергаются также межкристаллитному растрескиванию в хлоридных средах. В основе гипотезы коррозионного растрескивания лежат те или иные процессы местного механического или электрохимического нарушения целостности защитного пассивного слоя на поверхности стали с последующим активным локализованным растворением незащищенного металла.
Зарождение трещины при умеренных напряжениях, не вызывающих разрыв оксидной пленки, рассматривается как электрохимический процесс локального нарушения целостности пассивного слоя с участием адсорбированного иона – активатора, приводящего к образованию первичных растворимых и вторичных малорастворимых продуктов коррозии. Растягивающие напряжения, возникающие в процессе коррозионного растрескивания, активируют и ориентируют растворение металла. Свободная энергия наиболее напряженных участков повышается, ускоряется образование растворимых комплексов металла с хлором за счет увеличения дефектности и диффузионной проницаемости защитной пленки.
Неоднородное строение сплава способствует упругому взаимодействию защитной пленки с поверхностью металла, которое приводит к неравномерному растяжению пленки и образованию в ней точечных, линейных или объемных дефектов. Повышенная дефектность пленки способствует локализации сорбции ионов хлора, его ускоренной миграции в пленке и активному взаимодействию с металлом. Зародыши трещин ориентируются перпендикулярно оси растягивающих напряжений в металле. В первичном зародыше трещины происходит гидролиз первичных продуктов коррозии с образованием оксидов и гидроксидов железа, что приводит к повышению кислотности и содержания ионов хлора во внутреннем микрообъеме зародыша.
Растягивающие напряжения на стадии распространения трещины способствуют острой локализации растворения у острия зародыша. В эффективно растущей трещине устанавливается отрицательная обратная связь между степенью локализации коррозии и агрессивностью внутренней микросреды. Регулятором связи между агрессивностью внутренней среды трещины и локализацией растворения является ион водорода, изменение концентрации которого может приводить как к пассивации, так и активации боковых поверхностей трещины или ее острия. Схема стабильно растущей трещины приведена на рис. 2
Хлоридное коррозионное растрескивание в нейтральных средах эффективно протекает в присутствии кислорода или других окислителей. Помимо кислорода коррозионному растрескиванию способствуют ионы Fe3+, Cu2+, перекиси водорода.
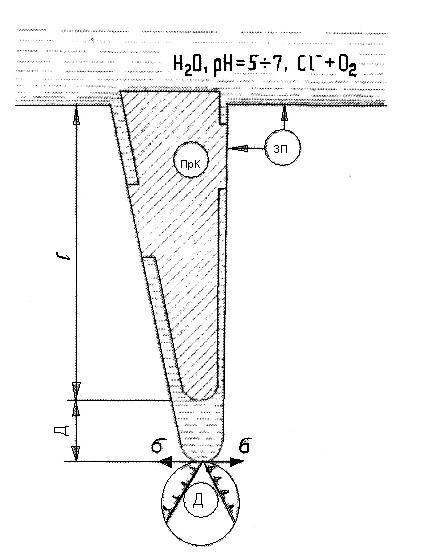
Рисунок 2 – Схема стабильно растущей трещины: ПрК— продукты коррозии, 3П — защитная пленка, Д— дислокации.
Ход работы
В одну пробирку налить раствор CuSО4, в другую СuСl2. В каждую пробирку опустить стружку алюминия. Вытеснение меди в первой пробирке происходит очень медленно, а во второй – быстро. Объяснить наблюдаемое различие с учетом наличия на алюминии защитной пленки оксида Аl2О3.
Вопросы
Напишите уравнения реакций взаимодействия алюминия и окиси алюминия с сульфатом меди. Объясните механизм протекания каждой реакции.
Напишите уравнения реакций взаимодействия алюминия и окиси алюминия с хлоридом меди. Объясните механизм протекания каждой реакции.
Объясните влияние кислорода на процесс коррозии металлов в нейтральной среде в присутствии ионов хлора.
Объясните влияние концентрации ионов водорода на образование трещины в теле металла.
Дайте понятие легирующих элементов и технологических добавок.
Влияние примесей в составе стали на скорость коррозии.
