
Лекции Дет. модели. Часть 2
.pdf
кинетическое уравнение автокаталитической реакции можно переписать в виде:
dx(t) dt k(CA0 x(t)) CB0 x(t) .
Итак, математической моделью автокаталитической реакции является система уравнений
dx(t) |
x(t)) CB0 x(t) , x(0) 0, |
||
|
|
k(CA0 |
|
|
|||
|
dt |
|
|
CA t CA0 x(t),
|
CB t CB0 x(t). |
|
|
|
|
3.Решение математической модели средствами универсальной технической компьютерной системы Mathematica. Прилагается рас-
печатанный вариант файла «Лаб. работа 5.4.nb».
4.Анализ полученных результатов. В соответствии с принципами химической кинетики получено аналитическое решение прямой кинетической задачи для простейшей автокаталитической реакции. Это решение представлено также и графически в файле «Лаб. работа 5.4.nb».
Проанализируем полученные результаты. Кинетическая кривая для
вещества A монотонно убывает, а кинетическая кривая для вещества B монотонно возрастает на промежутке 0; . Обе кинетические кривые
имеют единственную точку перегиба на этом промежутке, а именно,
|
ln CA0 /CB0 |
|
|
|
|
|
tchange |
|
. Значения CA t |
и CB t при t tchange |
совпадают и |
||
k CA0 CB0 |
||||||
равны |
половине исходной |
концентрации CA0 CB0 реагирующих |
ве- |
|||
ществ. |
Если предположить, |
что CB0 |
значительно меньше, |
чем CA0 , |
то |
|
t tchange примерно соответствует периоду полупревращения исходного
реагента A. В точке перегиба графиков обеих функций скорость расходования вещества A минимальна (в абсолютном смысле – максимальна), а скорость изменения текущей концентрации CB t максимальна.
Замечание 1. Важно подчеркнуть, что вещество B все же не является катализатором в полном соответствии со значением этого термина. Здесь наблюдается накопление этого вещества в довольно значительных количествах, что не характерно для явлений обычного «классического» катализа.
Замечание 2. Следует обратить внимание на своеобразные формы графиков кинетических кривых для реагента и промежуточного продукта с наличием перегиба на каждой из кривых. Такая форма характерна для
118
графика так называемой логистической кривой, который имеет весьма характерную форму с пологим начальным участком, а также с участками быстрого роста функции и выходом ее на предельное значение. Уравнение логистической кривой встречается во многих отраслях естествознания. Логистическому росту подчиняются многие процессы и явления: распространение информационных потоков в науке, зарождение и медленное пробивание в жизнь новых идей с их более или менее бурным развитием и т. д. По аналогии кинетическую кривую для реагента можно назвать кривой логистического спада.
5.2. КИНЕТИЧЕСКИЕ МОДЕЛИ РЕАКЦИЙ, ПРОТЕКАЮЩИХ В ОТКРЫТЫХ СИСТЕМАХ
В задании 5.1 рассматривались кинетические модели реакций, протекающих в закрытых системах. В таких системах исключен обмен веществом с окружающей средой (реактор периодического действия). На практике многие реакции проводят в открытых системах, с осуществлением непрерывного режима подачи реагирующих веществ в реактор и вывода из него образующихся продуктов. В данном задании рассмотрим кинетические модели реакторов непрерывного действия, а именно, реакторов идеального смешения (РИС). В РИС реакционная смесь перемешивается таким образом, что текущая концентрация каждого участника реакции в любой момент времени действия реактора одинакова во всех точках реакционного пространства.
5.2.1. Простая реакция первого порядка
вреакторе идеального смешения
1.Постановка задачи. В РИС протекает простая реакция первого
порядка, кинетическая схема которой такова: A k B, причем, имеет место соответствие кинетической и стехиометрической схем реакции. Раствор реагента A концентрацией CA0 моль/л непрерывно подается
на вход реактора с постоянной скоростью v л/c . С такой же скоростью реакционная смесь выводится из реактора. В этих условиях объем реакционного пространства остается постоянным и составляет V л . Получите аналитическое решение прямой кинетической задачи, т. е. аналитическую зависимость между текущей концентрацией CA t реагента A и временем t, отсчитываемым от начала процесса, в реакторе идеального
119

смешения. Представьте полученное решение графически. Проанализируйте результаты с химической точки зрения.
2. Математическая модель. Будем считать, что началу процесса соответствует момент времени t 0. Обозначим через nA(t) количество реагента A в РИС в момент времени t t 0 (текущее количество реагента A в РИС). Мгновенная скорость изменения количества реагента A в РИС в момент времени t t 0 равна разности мгновенной скорости поступления реагента в реактор и мгновенной скорости его расходования. Расходуется реагент в ходе простой реакции первого порядка, а также из-за вывода реакционной смеси из реактора, содержащей некоторое количество непрореагировавшего реагента A. Математически это можно записать следующим образом:
dnA(t) vCA0 kCA(t)V vCA(t). dt
Разделив обе части уравнения на положительное число V , приходим к математической модели простой реакции первого порядка в РИС:
dCA(t) kCA(t) v CA0 CA(t) ,CA(0) CA0 . dt V
В отличие от математической модели простой реакции первого порядка в реакторе периодического действия, в этом случае дифференциальное уравнение содержит параметры, характеризующие геометрические размеры реактора и скорость подачи (вывода) вещества в реактор (из реактора).
3.Решение математической модели средствами универсальной технической компьютерной системы Mathematica. Прилагается рас-
печатанный вариант файла «Лаб. работа 5.5.1.nb».
4.Анализ полученных результатов. В соответствии с принципами химической кинетики получено аналитическое решение прямой кинетической задачи, сформулированной в условии. Это решение представлено
также и графически в файле «Лаб. работа 5.5.1.nb». В РИС аналитическая зависимость между текущей концентрацией CA t реагента A и време-
нем |
t, |
отсчитываемым от начала процесса, имеет вид: |
||
CA(t) |
|
CA0 |
|
v kVe k v/V t . Эта формула показывает, что текущая кон- |
|
|
|
||
|
|
kV v |
||
центрация реагента A довольно сложным образом зависит как от кине- |
||||
тических, так и от макроскопических параметров системы. Она является строго убывающей функцией от времени, график которой является вогнутым на промежутке 0; . Последнее обстоятельство указывает на
120
то, что CA t , являясь отрицательной для любого значения t 0, строго возрастает, стремясь при t к нулю. Тогда в абсолютном смысле скорость рассматриваемого процесса убывает, стремясь при t к нулю. В связи с этим, кинетическая кривая исходного реагента имеет характерную особенность: с течением времени концентрация реагента A становится практически не зависящей от времени. С подобным ходом кривой мы встречались при анализе обратимых реакций, однако в этом случае стабилизация концентрации во времени не имеет никакого отношения к установлению состояния химического равновесия. Здесь мы имеем дело со стационарным режимом протекания процесса – состоянием, при котором убыль реагирующего вещества компенсируется его прибылью за счет поступлений новых порций реагента в реактор. В файле «Лаб. работа 5.5.1.nb» получено выражение для так называемой ста-
ционарной концентрации вещества A: C |
Ast |
|
CA0v |
. |
|
||||
|
|
kV v |
||
5.2.2.Переходный режим в системе из двух проточных реакторов идеального смешения
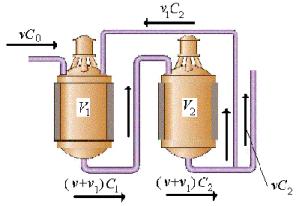
1. Постановка задачи. Имеется система из двух проточных РИС объемами V1 и V2 л соответственно, в которой движется реакционная смесь. Схема потоков реакционной смеси для каждого реактора показана на рисунке.
Считают, что началу процесса соответствует момент времени t 0 и что при t 0 концентрации реагента A в реакторах 1 и 2 одинаковы и равны C0 моль/л . Пусть в каждом из реакторов протекает простая реакция первого порядка, кинетическая схема которой такова: A ki B i 1,2 , причем, в каждом случае имеет место соответствие кинетической и стехиометрической схем реакции (разница констант ско-
121
рости реакции может быть обусловлена различными температурными условиями в реакторах). Обозначим текущие концентрации реагента A в первом и втором РИС через C1 t и C2 t соответственно. Первый реак-
тор имеет два входа: на первый подается vC0 моль/c реагента A извне, на второй – v1C2 моль/c из второго реактора. Поток вещества A на выходе из реактора 1 и на входе в реактор 2 равен v v1 C1 моль/c. На выходе из второго реактора имеем поток вещества v v1 C2 моль/c, который затем разделяется: часть возвращается в реактор 1 v1C2 моль/c , а vC2 моль/c непрореагировавшего вещества A выводится из системы. Здесь v и v1 – это постоянные скорости. Получите решение прямой кинетической задачи, т. е. зависимость между текущей концентрацией реагента A в каждом из реакторов и временем t, отсчитываемым от начала процесса. Представьте полученное решение графически. Проанализируйте результаты с химической точки зрения.
2. Математическая модель. Обозначим через ni (t),i 1,2, количе-
ство реагента A в i-том РИС в момент времени t t 0 (текущее количество реагента A в i-том РИС). Рассуждая аналогично тому, как в пункте 5.2.1, получаем систему дифференциальных уравнений:
|
|
|
|
dn1(t) |
|
|
vC v C (t) v v C (t) k C (t)V , |
|
||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
dt |
|
0 |
1 |
2 |
|
1 |
1 |
1 |
1 |
1 |
|
|||||
|
|
|
|
dn2(t) |
v v1 C1(t) v v1 C2(t) k2C2(t)V2. |
|
||||||||||||||||
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Разделив первое уравнение на положительное число V1, а второе – на V2 , |
||||||||||||||||||||||
приходим к математической модели исследуемого процесса: |
|
|||||||||||||||||||||
|
dC1(t) |
|
|
vC0 v1C2(t) v v1 C1(t) |
k C (t), |
C (0) C |
, |
|||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
dt |
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
1 1 |
|
1 |
0 |
|
|
|
|
|
(t) |
|
|
|
v v |
|
|
(t) |
|
|
|
|
. |
|||||||
|
|
dC |
2 |
|
|
|
C (t) C |
2 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
1 |
1 |
|
|
k2C2(t), |
C2 |
(0) C0. |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
dt |
|
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
3.Решение математической модели средствами универсальной технической компьютерной системы Mathematica. Прилагается рас-
печатанный вариант файла «Лаб. работа 5.5.2.nb».
4.Анализ полученных результатов. В качестве упражнения сфор-
мулируйте анализ полученных результатов самостоятельно по аналогии
сразобранным случаем 5.2.1.
122

5.2.3.ПРИМЕР КИНЕТИЧЕСКОГО МОДЕЛИРОВАНИЯ
СИСПОЛЬЗОВАНИЕМ КУСОЧНО-НЕПРЕРЫВНОЙ ФУНКЦИИ
1.Постановка задачи. Вещество A с начальной концентрацией CA0 моль/л в результате химической реакции превращается в конечный
продукт B, который является нестабильным и под действием света снова разлагается с образованием исходного вещества A. Если реакцию проводят в темноте, то она протекает в полном соответствии с кинетическими закономерностями простой реакции первого порядка (константу скорости реакции обозначим через k ). Если же реакционную смесь подвергают действию света, то поведение системы становится более сложным: распад вещества A осложняется его накоплением за счет протекания обратного процесса, кинетические закономерности которого определяются интенсивностью светового излучения.
Пусть в течение половины минуты реакция протекает в полной темноте, после чего на полторы минуты систему подвергают воздействию светового потока, а затем снижают интенсивность этого потока на определенное количество процентов и далее поддерживают постоянной. Пусть аддитивный вклад светового воздействия в кинетическую модель процесса описывается посредством кусочно-постоянной функции
|
0,0 t 0,5; |
|
f t |
1,0,5 t 2; |
|
|
|
|
|
|
0,2,t 2. |
|
|
|
Получите аналитическое решение прямой кинетической задачи для данной реакции, осложненной фотохимическим превращением. Представьте полученное решение графически. Проанализируйте результаты с химической точки зрения.
2. Математическая модель. Будем считать, что началу процесса соответствует момент времени t 0. Обозначим через CA(t) текущую концентрацию реагента A. В соответствии с условием задачи математической моделью реакции, осложненной фотохимическим превращением, является задача Коши:
dCA(t) kCA(t) f (t),CA(0) CA0 . dt
В отличие от всех ранее рассматриваемых математических моделей эта модель содержит в себе разрывную кусочно-постоянную функцию f (t). Продемонстрируем возможности аналитического решения задач
123
такого типа при помощи универсальной технической компьютерной сис-
темы Mathematica.
3. Решение математической модели средствами универсальной технической компьютерной системы Mathematica. Прилагается рас-
печатанный вариант файла «Лаб. работа 5.6.nb».
4. Анализ полученных результатов. В соответствии с принципами химической кинетики получено аналитическое решение прямой кинетической задачи, сформулированной в условии. Это решение представлено также и графически в файле «Лаб. работа 5.6.nb». Заметим, что хотя в математической модели реакции, осложненной фотохимическим превращением, присутствует разрывная функция, кинетическая кривая для исходного реагента A есть функция непрерывная. В файле «Лаб. работа 5.6.nb» демонстрируется ход ее графика при конкретных числовых значениях констант CA0 и k , который достаточно сложен. Он отражает про-
цессы возрастания и убывания текущей концентрации исходного реагента A, точки локального экстремума, промежутки выпуклости и вогнутости, а также точки перегиба графика рассматриваемой функции. В качестве упражнения остановитесь на этих аспектах более подробно и дайте их химическую интерпретацию.
124
