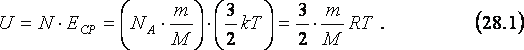- •Вопросы к экзамену по физике (пгс) I часть
- •15. Удар абсолютно упругих и неупругих тел.
- •21. Постулаты специальной теории относительности.
- •28. Давление газа с точки зрения молекулярно-кинетической теории. Уравнение состояния идеального газа.
- •34. Средняя кинетическая энергия молекул. Молекулярно-кинетическое толкование абсолютной температуры.
- •Внутренняя энергия
- •35. Работа газа. Количество теплоты 37. Теплоемкость.
- •30. Закон Максвелла для распределения молекул идеального газа по скоростям и энергиям их теплового движения. Средние скорости теплового движения частиц.
- •33. Число степеней свободы. Закон равномерного распределения энергии по степеням свободы.
- •29. Барометрическая формула. Распределение Больцмана.
- •31. Принцип детального равновесия. Среднее число столкновений и средняя длина свободного пробега молекул. Вакуум.
- •32. Молекулярно-кинетическая теория явлений переноса в неравновесной системе.
- •35. Работа газа при изменении его объема. Внутренняя энергия термодинамической системы.
- •36. Количество теплоты. Первое начало термодинамики. Применение первого начала к изопроцессам.
- •37. Теплоемкость. Удельная и молярная теплоемкости. Зависимость теплоемкости идеального газа от вида процесса. Недостаточность классической теории теплоемкости.
- •40. Термодинамическая вероятность. Определение энтропии неравновесной системы через термодинамическую вероятность состояния.
- •41. Силы и потенциальная энергия межмолекулярного взаимодействия. Эффективный диаметр молекул.
- •42. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и их анализ.
- •42. Метастабильные состояния. Критическая точка.
- •43. Внутренняя энергия реальных газов.
- •44. Понятие фазы, фазового равновесия и превращения. Правило фаз Гиббса.
34. Средняя кинетическая энергия молекул. Молекулярно-кинетическое толкование абсолютной температуры.

С точки зрения молекулярно-кинетической теории абсолютная температура есть величина, пропорциональная средней энергии поступательного движения молекулы. < пост>=3/2kT.
Внутренняя энергия
Пусть газ одноатомный, т.е. состоит из отдельных атомов, а не молекул, например, любой из инертных газов. Тогда кинетическая энергия атомов этого газа равна кинетической энергии их поступательного движения, так как вращательное отсутствует. Поэтому для вычисления внутренней энергии, U одноатомного газа массыm необходимо умножить среднюю кинетическую энергию, ЕСР его атома (см. 23.6) на общее количество, N атомов в газе (см. 19.1 и 19.2):
|
| |
|
|
|
Как следует из (28.1), внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре и не зависит от других макроскопических параметров газа – его давления и объёма. Таким образом, сжимая газ в изотермических условиях, мы не изменяем его внутренней энергии.
35. Работа газа. Количество теплоты 37. Теплоемкость.
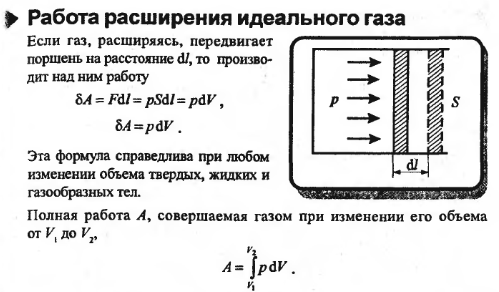
Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин.


![]()
![]()
![]()
![]()
![]()

30. Закон Максвелла для распределения молекул идеального газа по скоростям и энергиям их теплового движения. Средние скорости теплового движения частиц.

Флуктуация (от лат. fluctuatio — колебание) — термин, характеризующий любое колебание или любое периодическое изменение. В квантовой механике — случайные отклонения от среднего значения физических величин, характеризующих систему из большого числа частиц; вызываются тепловым движением частиц или квантовомеханическими эффектами.
Примером термодинамических флуктуаций являются флуктуации плотности вещества в окрестностях критических точек, приводящих, в частности, к сильному рассеянию света веществом и потере прозрачности.
флуктуация определяется как отклонение от наиболее вероятного состояния, причём вероятность этого отклонения ничтожно мала

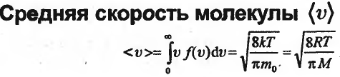
33. Число степеней свободы. Закон равномерного распределения энергии по степеням свободы.


29. Барометрическая формула. Распределение Больцмана.

31. Принцип детального равновесия. Среднее число столкновений и средняя длина свободного пробега молекул. Вакуум.
ДЕТАЛЬНОГО
РАВНОВЕСИЯ ПРИНЦИП (детального
баланса принцип) - общий принцип квантовой
механики и статистич.физики,
согласно к-рому для изолиров. системы
вероятность ![]() прямого
перехода
прямого
перехода ![]() между
квантовыми состояниями п и травна
вероятности обратного перехода
между
квантовыми состояниями п и травна
вероятности обратного перехода ![]() ,
,
Таким
обpазом, окончательная формула для числа
столкновений пpинимает вид:
![]()

Вакуум
- В
технике и прикладной физике под вакуумом
понимают среду, содержащую газ при давлениии значительно
ниже атмосферного.
Вакуум характеризуется соотношением
между длиной
свободного пробега молекул
газа λ и
характерным размером среды d.
Под d может
приниматься расстояние между
стенками вакуумной
камеры,
диаметр вакуумного трубопровода и т. д.
В зависимости от величины
соотношения λ/d различают
низкий (![]() ),
средний (
),
средний (![]() )
и высокий (
)
и высокий (![]() )
вакуум.
)
вакуум.