
- •СОДЕРЖАНИЕ
- •ВВЕДЕНИЕ
- •1. Природа сил химической связи
- •1.1 Методы анализа сложных молекул
- •1.1.1 Метод валентных связей
- •1.1.2 Метод молекулярных орбиталей
- •1.1.3 Заключение
- •2. Структура энергетических уровней молекул
- •2.1 Потенциальные кривые электронных состояний молекул
- •2.2 Колебательные уровни энергии молекул
- •2.3 Вращательные уровни энергии молекул
- •2.4 Заключение
- •3. Молекулярные спектры
- •3.1 Общие характеристики молекулярных спектров
- •3.1.1 Вращательные спектры молекулы.
- •3.1.2 Колебательно-вращательные спектры молекулы
- •3.1.3 Электронные спектры молекулы.
- •3.2 Спектр поглощения двухатомной молекулы йода
- •4. Экспериментальная часть
- •4.1 Описание установки
- •4.2 Обработка результатов. Задание.
- •4.3 Вопросы к отчету
- •Литература
2. Структура энергетических уровней молекул
Как уже отмечалось, молекула более сложное образование, чем атом. В ней появляются новые (по сравнению с атомом) степени свободы движения частиц молекулы, что отражается на структуре ее энергетических уровней и характере ее спектра. У молекулы кроме движения электронов относительно ядер ее атомов возможны еще два рода движения ее частиц, кото-
E |
|
|
|
|
рые не имели место в атоме: |
|
|
|
|
|
|
|
|||
|
|
|
|
– атомы молекулы могут колебаться относительно |
|||
|
Ea |
|
|
|
|||
|
|
|
|
положения равновесия; |
|
||
|
|
|
|
|
|
||
|
R0 |
|
R |
|
– молекула может вращаться как целое вокруг ее |
||
|
|
|
2E0 |
центра тяжести. |
|
||
|
|
|
|
|
Этим трем движениям в молекуле – электронно- |
||
|
Es |
|
|
|
му, колебательному и вращательному – соответствуют |
||
|
Ec |
|
|
три типа квантовых состояний и уровней энергии. Та- |
|||
|
|
|
|
||||
|
|
|
|
|
ким образом, полная энергия молекулы с хорошей сте- |
||
|
|
|
|
|
пенью приближения может быть представлена как |
||
Рис.4 Зависимость энергии Es |
|||||||
сумма квантовых значений энергии электронного Eэл , |
|||||||
|
и Ea молекулы водорода |
колебательного Eкол и вращательного Eвр движений: |
|||||
|
от расстояния между |
|
|
|
|
||
|
протонами. |
|
|
E= Eэл + Eкол +Eвр |
2.1 |
||
Частицы в молекуле сильно различаются по массам. Поэтому движения ядер (колебательное, вращательное) в молекуле много медленнее по сравнению с движением электронов. Это обуславливает различный порядок величин энергий движения. Простые оценки дают следующее отношение этих величин:
Eэл : Eкол : Eвр = 1 : (m/M)1/2 : m/M |
2.2 |
где m – масса электрона; M – масса ядер атомов, входящих в молекулу.
Оценим качественно характер структуры энергетических уровней молекулы и порядки величин энергий уровней, причем для простоты ограничимся случаем двухатомной молекулы.
2.1 Потенциальные кривые электронных состояний молекул
Как уже отмечалось выше, что в зависимости от ориентации спинов электронов в молекулярной орбитали, возможны два состояния молекулы водорода H2 , которые описываются симметричной и антисимметричной волновыми функциями ψ s и ψ a соответственно. При этом оказывается, что возможны два значения энергии Es и Ea :
Es = 2E0 |
+ |
C + A |
|
2.3 |
|
1 + S2 |
|
||||
|
|
|
|
||
Ea = 2E0 |
+ |
C − A |
, |
2.4 |
|
1 − S2 |
|||||
|
|
|
|
где E0 – энергия атома водорода в основном состоянии; A – обменная энергия ( обменный интеграл ); C – кулоновская энергия ( кулоновский интеграл ), т.е. энергия взаимодействия электронов с протонами; S – интеграл перекрытия. Величины A,C и S являются функциями расстояния между ядрами.
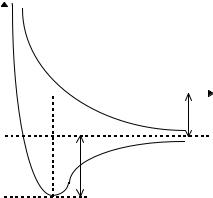
На рис.4 представлены рассчитанные по формулам (2.3) и (2.4) зависимости энергий Es и Ea от межъядерного расстояния для симметричного и антисимметричного состояний.
8
На нем верхняя кривая изображает зависимость энергии молекулы от R – расстояния между протонами в состоянии, описываемом антисимметричной волновой функцией ψa ( два электрона с параллельными спинами ); Как видно из рисунка, в этом случае связь не возникает. Нижняя кривая изображает Es = f(R) в состоянии с симметричной волновой функцией ψs (спины у электронов антипараллельны). Она при R0 = 0,86 Å имеет минимум (экспериментальное значение R0 = 0,74 Å). То есть в состоянии ψs возникает связь, причем расчет для энергии связи Ec дает значение Ec =3,14 эВ (экспериментальное значение Ec = 4,72 эВ ). Обе потенциальные кривые обладают рядом общих свойств. При небольших расстояниях R между атомами потенциальные кривые стремятся к бесконечности при R→ 0 ( при R→ 0 между атомами действуют силы отталкивания, превосходящие все остальные ). Если R велико (R→
∞), то обе кривые асимптотически приближаются к значению 2E0 , поскольку на больших расстояниях взаимодействие атомов исчезает, и энергия равна сумме энергий изо-
лированных атомов.
Если рассматривать молекулы состоящие из более сложных атомов, у которых кроме внешней незаполненной электронной оболочки имеются еще и внутренние заполненные оболочки, то в этом случае электронные потенциальные кривые для таких молекул отличаются от кривых для молекулы водорода H2 тем, что при R→ 0 эти
кривые более круче стремятся к бесконечности. Это объясняется тем, что при тесном сближении атомов происходит перекрытие волновых функций электронов расположенных во внутренних оболочках. Но, поскольку все внутренние оболочки у обоих атомов заполнены, то такое перекрытие, как известно, приводит к образованию разрыхляющих молекулярных орбиталей, т.е. к появлению сил отталкивания между атомами, которые быстро возрастают с уменьшением расстояния R между атомами.
В заключение следует отметить, что молекулы могут иметь кроме основного электронного состояния и возбужденные электронные состояния. Электронные возбуждения молекулы приводят к изменению ее размеров, а часто и ее формы, т.к. при возбуждении один или оба электрона ( по одному от каждого атома) переходят с низшей оболочки на одну из верхних. При этом каждому электронному состоянию соответствует своя потенциальная кривая, которая расположена тем выше, чем больше энергия возбуждения. Экспериментальные данные дают для молекул электронные энергии возбуждения порядка нескольких электронвольт.
2.2 Колебательные уровни энергии молекул
Наличие минимума на электронной потенциальной кривой (см. рис.5 ) означает, что всякое отклонение межъядерного расстояния от R0 приводит к увеличению энергии молекулы. Так как всякая механическая система всегда стремится занять минимально возможное значение энергии, то при отклонении межъядерного расстояния R от R0 в молекуле будет возникать сила, под действием которой ядра будут возвращаться в положение соответствующее минимуму энергии. Поэтому расстояние R0 называется равновесным расстоянием, а ядра, под действием этой квазиупругой силы, будут совершать колебательное движение.
9
В разделе 1.1 отмечалось, что при адиабатическом приближении уравнение (1.1) разбивается на два, при чем, второе уравнение описывает колебательное движение ядер. Это уравнение имеет вид:
d 2ψ |
+ |
8π2 |
µ |
|
E − U |
( |
x |
) |
ψ = 0 , |
2.5 |
|
|
|
|
|||||||
dx2 |
h2 |
|
( |
|
|
) |
|
|||
|
|
|
|
|
|
|||||
где µ = M1M2/(M1+M2) – приведенная масса
U(x) |
|
6 |
|
|
6 |
|
|
|
|
|
|||
|
|
|
|
|
||
|
|
5 |
|
|
|
|
|
|
|
|
5 ∆E=hν0 |
||
|
|
|
|
|
||
|
|
4 |
|
4 |
Гармонический |
|
|
|
3 |
|
3 |
осциллятор |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
2 |
|
2 |
|
|
|
|
1 |
1 |
∆E=hν0{1-2ξ(n+1)} |
||
|
|
Ангармонический |
||||
|
|
0 |
0 |
осциллятор |
||
|
|
|
|
|
|
x |
|
|
|
|
|
|
|
Рис.6 Колебательные энергетические уровни двухатомной молекулы
α = E0 , β = (∂E / ∂R)R=R0 , γ = (∂2 E / ∂R2 )R=R0
двух ядер молекулы; U(x) – потенциальная энергия ядер, которая равна энергии электронов молекулы E(R).
Для нахождения вида потенциала U(R) разложим функцию E(R) в ряд по степеням малой величины x = R– R0 :
E(R) = E0 |
|
∂E |
x + |
1 |
|
∂2 E |
|
2 |
|
||
+ |
|
|
|
|
|
|
x |
|
+L |
||
|
|
|
|
||||||||
|
|
∂R R =R0 |
|
2 |
|
∂R2 R =R0 |
2.6 |
|
|||
|
|
|
|
|
|
|
|
|
|
||
В случае малых x = R–R0 (малых колебаний) можно ограничиться первыми тремя членами в (2.6)
E(R)=α + βx + |
γ x2 |
, где |
2.7 |
|
2 |
|
|
причем, очевидно, что коэффициенты α и γ
различны для различных состояний молекулы. Поскольку β = 0 (условие равновесия) то (2.7) примет вид:
E(R) = α + |
γx2 |
, |
2.8 |
|
2 |
||||
|
|
|
что соответствует потенциальной энергии гармонического осциллятора.
Решение уравнения (2.5) с потенциалом (2.8) дает следующие собственные значения для энергии колебания ядер молекулы:
|
|
|
1 |
|
|
|
Eкол |
=hν0 |
n+ |
|
|
, |
2.9 |
|
||||||
|
|
|
2 |
|
|
|
где колебательное квантовое число n = 0,1,2,3, ... ; ν0 – собственная частота гармонического осциллятора.
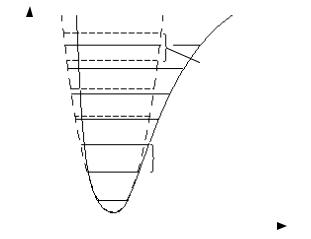
На рис.6 изображены колебательные уровни молекулы. Из рисунка видно, что в случае гармонических колебаний эти уровни эквидистантны, т.е. расположены на одинаковом расстоянии друг от друга, равном hν0 . Как следует из (2.9), уровень в низшем колебательном состоянии n = 0 должен быть выше минимума на hν0/2 .
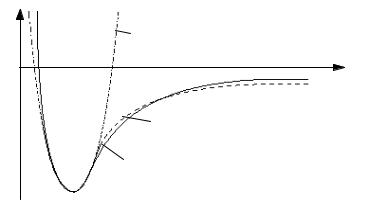
Как видно из рис.5, параболическая кривая лишь возле самого минимума хорошо аппроксимирует реальную потенциальную кривую молекулы. Поэтому высоко расположенные колебательные состояния двухатомной молекулы не описывается соотношением (2.9). Хорошим приближением к реальной потенциальной кривой молекулы является потенциал Морзе (см. рис.5)
( |
) |
( |
− e−αx |
) |
2 |
|
U x |
|
= D 1 |
|
2.10 |
1 0
где D и α – постоянные; x = R – R0 . Как видно из (2.10), U(∞) – U(0) = D ; отсюда следует, что параметр D представляет собой энергию диссоциации.
Значительно более точное выражение для колебательной энергии двухатомной молекулы получается при подстановке в уравнение Шредингера (2.5) вместо функции (2.8) потенциал Морзе (2.10). В этом случае колебания молекулы не являются гармоническими (ангармонический осциллятор) и решение уравнения Шредингера дает следующее соотношение для колебательных энергетических уровней:
|
|
|
1 |
|
|
|
1 |
2 |
|
|
||
|
Eкол = |
n+ |
|
hν0 |
− |
n+ |
|
|
|
hν0ξ, |
2.11 |
|
|
2 |
2 |
||||||||||
|
|
|
|
где |
ξ = |
|
hν0 |
|
|
|||
|
|
|
|
|
4D |
|
||||||
x |
Центр масс |
|
|
|
2.12 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||
M1 |
Молекулярная ось |
|
0 |
M2 |
z |
Параметр ξ называется постоянной ангармонич-
ности. Как видно из (2.11), уровни ангармоничного осциллятора не являются равноотстоящими, промежутки между соседними уровнями равны
|
r1 |
|
|
|
r2 |
|
∆E = E |
n+1 |
− E |
n |
= hν |
0 |
− 2hν |
0 |
ξ |
n + 1 |
2.13 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
R0 |
|
|
|
|
|
|
|
( |
) |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Рис.7 Двухатомная молекула: M1 и M2 - |
т.е. убывают с увеличением квантового числа n |
||||||||||||||||
массы атомов; R0 - равновесное |
(см. рис.6). |
|
|
|
|
|
|
|
|
|
|||||||
расстояние
В заключение следует отметить, что согласно формулы (2.2), при характерном для двухатомных молекул отношением масс электрона и ядра атома m/M ~ 10-3 - 10-5 и при характерной энергии электронного движения в несколько электронвольт, для энергии колебательного движения получается характерная величина Eкол
≈ hν0 ≈ 10-1- 10-2 эВ.
2.3 Вращательные уровни энергии молекул
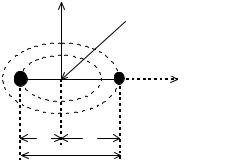
Вращение молекулы как целого вокруг ее центра масс вносит вклад в энергетическое состояние молекулы и проявляется в ряде свойств веществ (теплоемкость газов, структура молекулярных спектров и др.). Движение двухатомной молекулы рассматривается как движение жесткого ротатора со свободной осью проходящей через центр масс перпендикулярно межъядерной оси (см. рис.7)
Кинетическая энергия вращения двухатомной молекулы
TJ = |
M1υ1 |
+ |
M2 υ2 |
+ |
ω2 |
(M1r12 |
+ M2 r22 ), |
2.14 |
|
2 |
2 |
2 |
|||||||
|
|
|
|
|
|
где ω – угловая скорость вращения молекулы. Поскольку r1 и r2 – расстояние от атомов до центра масс, то должно выполняться условие M1r1 = M2r2 . Учитывая, что r1+r2=R0 , то момент инерции молекулы будет равен:
I = M r 2 |
+ M r 2 |
= |
M1M2 |
R2 |
= µR2 |
, |
2.15 |
||
|
|||||||||
1 |
1 |
2 |
2 |
|
0 |
0 |
|
|
|
|
|
|
|
|
M1 + M2 |
|
|
|
|
где µ – приведенная масса. Тогда выражение (2.14) можно переписать в виде:
T = |
Iω2 |
= |
M2 |
, |
2.16 |
|
|
||||
J |
2 |
|
2I |
|
|
|
|
|
|
здесь M = Iω – момент количества движения. Но с другой стороны согласно квантовой механике момент количества движения не может быть произвольным, он по своей природе квантован и равен
1 1
