- •Методическая разработка по проведению практических и лабораторных занятий для студентов по учебной дисциплине «Химия»
- •Занятие №1
- •Форма протокола лабораторной работы.
- •Занятие №2
- •Занятие №3
- •Опыт №1. Зависимость скорости реакции от концентрации.
- •Сразу после выпадения осадка быстро вымыть пробирки!!!
- •Опыт №4. Изучение явлений плазмолиза и гемолиза эритроцитов.
- •Занятие №4
- •Опыт № 1. Приготовление буферных смесей с различными значениями рН.
- •Опыт №2. Влияние разбавления на рН буферной смеси.
- •Опыт№3. Определение буферной емкости раствора по кислоте.
- •Занятие №5
- •Опыт № 1. Определение общей жесткости воды.
- •Опыт №2. Определение содержания перекиси водорода перманганатометрическим титрованием.
- •Занятие №6
- •Занятие №7
- •Занятие №8
- •Занятие №9
- •Занятие №10
- •Занятие №11
- •Занятие №12
- •Опыт №1. Изучение влияния электролитов на величину набухания вмс.
- •Занятие №13
- •Билет №
Форма протокола лабораторной работы.
Дата. Тема занятия
Лабораторная работа № ___
Название лабораторной работы или опыта
Цель.
Оборудование и реактивы
Задание.
Методика эксперимента.
Химизм процессов.
Наблюдения, результаты и расчеты.
Вывод.
Ответы на вопросы к защите работы.
Лабораторная работа оформляется в отдельной тетради. Протокол каждой работы начинают с новой страницы. Лабораторная работа считается зачтенной после ее личного практического выполнения и защиты (знание химизма, ответов на вопросы). Частью лабораторной работы может являться выполнение эксперимента с элементами исследовательской работы (УИРС).
Занятие №2
Тема: Строение вещества. Элементы химической термодинамики и биоэнергетики.
Значение темы: Изучение темы будет способствовать формированию способности анализировать социально-значимые проблемы и процессы, использовать на практике методы естественнонаучных, медико-биологических наук в различных видах профессиональной и социальной деятельности, способности реализовать этические и деонтологические аспекты врачебной деятельности в общении с коллегами, способности выявлять естественнонаучную сущность проблем, возникающих в ходе профессиональной деятельности, использовать для их решения соответствующий физико-химический и математический аппарат, способности к формированию системного подхода к анализу медицинской информации, основанной на поиске решений с использованием теоретических знаний и практических умений в целях совершенствования профессиональной деятельности.
Цель занятия: Студент должен
Знать:
правила техники безопасности и работы в химических лабораториях с реактивами, приборами.
физико-химическую сущность процессов, происходящих в живом организме на молекулярном, клеточном, тканевом, органном уровнях;
Уметь:
пользоваться физическим, химическим оборудованием;
прогнозировать направление и результат физико-химических процессов и химических превращений биологически важных веществ;
выполнять термохимические расчеты, необходимые для составления энергоменю, для изучения основ рационального питания;
Вопросы для изучения темы
Термодинамика, основные понятия и задачи. Параметры состояния (экстенсивные и интенсивные) и функции состояния системы.
Понятие внутренней энергии. Работа и теплота – две формы передачи энергии. Первое начало термодинамики. Изохорные и изобарные процессы. Тепловой эффект химической реакции. Энтальпия как функция состояния системы. Эндотермические и экзотермические процессы.
Первое начало термодинамики для изобарных процессов. Закон Гесса. Термохимические расчеты и их использование для энергетической характеристики химических и биохимических процессов. Стандартные энтальпии образования и сгорания. Следствия из закона Гесса.
Энергетическая ценность пищевых продуктов, обоснование рационов питания, основные задачи биоэнергетики.
Второе начало термодинамики, вклад С. Карно и Р. Клаузиуса. Энтропия как функция состояния системы. Критерии самопроизвольно протекающих процессов в изолированных системах. Связь энтропии с вероятностью состояния системы.
Применение первого и второго начала термодинамики к живым организмам. Математическое выражение второго начала термодинамики для открытых систем. Энергия Гиббса как функция состояния системы и критерий направленности процессов. Условия возможности протекания реакций в прямом направлении. Математическое выражение, связывающее изменение энергии Гиббса с изменениями энтальпии и энтропии. Расчет изменения энергии Гиббса по следствиям закона Гесса.
Экзергонические и эндергонические реакции. Понятие о сопряженных процессах. Коэффициент полезного действия биохимических процессов.
Вопросы для самоконтроля знаний
Дополните фразы:
Химическая термодинамика изучает….
Открытой системой называют такую систему, которая……..
Экстенсивными называют параметры термодинамической системы, величина которых………….
Функциями состояния называют такие величины, которые……….
Интенсивными являются параметры:………………
Формы обмена энергией между системой и окружающей средой - …………
Процессы, протекающие при постоянной температуре, называются………
Процессы, протекающие при постоянном давлении, называются………
Внутренняя энергия системы – это…………
Закон, отражающий связь между работой, теплотой и внутренней энергией - ………….
Тепловой эффект реакции, протекающий при постоянном объеме, называется изменением………
Энтропия реакции – это………….
Химические процессы, при протекании которых происходит уменьшение энтальпии системы и во внешнюю среду выделяется теплота, называются…………
Процесс называют эндотермическим, если………..
Закон Гесса имеет следующую формулировку:………….
При окислении 1г улеводов выделяется………ккал, белков……..ккал, жиров…….ккал.
Функцией состояния, характеризующей тенденцию системы к достижению вероятного состояния, является………….
Критерием направленности процесса в изолированной системе является………..
Математическое выражение 2-го начала термодинамики для изолированных систем:……….
Ситуационные задачи
Пероксид водорода используется в медицине для обработки ран в виде раствора с массовой долей 3%. Докажите, что процесс разложения пероксида водорода в присутствии фермента каталазы является самопроизвольным, используя при этом значения: S0298(Н2О2) = 110 Дж/моль·К, S0298(Н2О) = 70 Дж/моль·К, S0298(О2) = 205 Дж/моль·К.
На испарение 1 моля воды требуется 40 кДж. Сколько теплоты будет потеряно за день при выделении через кожу 720 г воды?
Рассчитайте стандартную энергию Гиббса для процесса окисления глюкозы по следующим данным: ∆Н0обр(С6Н12О6) = -1264,4 кДж/моль, ∆Н0обр(СО2) = -393 кДж/моль, ∆Н0обр(Н2О) = -286 кДж/моль. Изменение энтропии всей реагирующей системы равно 0,259 кДж/моль.
Рассчитайте стандартную энтропию реакции: глицин + глицин = глицилглицин. Если S0298(глицилглицина) = 231 Дж/моль·К, S0298(глицина) = 159 Дж/моль·К, S0298(Н2О) = 70 Дж/моль·К.
Почему реакция окисления глюкозы до глюкозы-6-фосфат, являясь эндергонической, протекает в организме в прямом направлении?
В организме человека реакция окисления этилового спирта протекает в две стадии. Первая – окисление этилового спирта до уксусного альдегида с участием фермента алкогольдегидрогеназы протекает по уравнению: С2Н5ОН + 1/2О2 = СН3СОН + Н2О. Рассчитайте ΔНр-ии, используя первое следствие закона Гесса.
Найти изменение внутренней энергии при испарении 90 г воды при температуре ее кипения. Теплота парообразования воды равна 40714 Дж/моль, Удельный объем жидкого пара 1,699 л/г. Давление нормальное.
Теплота сгорания углеводов, белков и жиров составляет 17; 17 и 39 кДж/г. Среднесуточная потребность в белках, жирах и углеводах для студентов – мужчин составляет 113; 106 и 451 г. Какова суточная потребность студентов – мужчин в энергии?
Почему процесс денатурации белка трипсина при 500С является самопроизвольным, хотя тепловой эффект реакции равен 2725 Дж/моль? Изменение энтропии для данной реакции 8,8 Дж/моль·К.
Теплота сгорания глюкозы равна -2810 кДж/моль, теплота сгорания этилового спирта равна -1366 кДж/моль. На основании этих данных вычислите тепловой эффект биохимического процесса брожения глюкозы: С6Н12О6 = 2С2Н5ОН + 2СО2.
Константа равновесия разложения лекарственного вещества в автоклаве при 413 К равна 0,396·105 Па, а при 443 К – 1,286·105 Па. Вычислить тепловой эффект реакции.
Лабораторная работа №2. «Определение теплоты реакций нейтрализации».
Цель. Приобрести навыки калориметрического определения теплот химических реакций и обработки, данных эксперимента. Проверить зависимость теплот реакций нейтрализации от природы реагирующих кислот и оснований.
Оборудование. Калориметр, мерные цилиндры, термометр, воронка, мешалка.
Реактивы. Растворы соляной кислоты, азотной кислоты, уксусной кислоты, гидроксида калия с концентрацией 1 моль/л.
Задание. Определить теплоту реакции нейтрализации кислоты раствором гидроксида калия для следующих пар кислота – основание: соляная кислота – гидроксид калия, азотная кислота – гидроксид калия, уксусная кислота – гидроксид калия.
Методика. Подготовьте для работы калориметр: проведите внешний осмотр его, чтобы убедиться в исправности всех деталей; ополосните дистиллированной водой стакан; проверьте работу мешалки и настройте ее. Запишите в лабораторном журнале исходные данные:
Масса внутреннего стакана калориметра m1, г
Объемы растворов реагирующих веществ V, мл
Концентрация растворов с, моль/л
Плотность растворов р, г/мл
Удельная теплоемкость растворов (воды) Ст(Н20) = 4,184 Дж/(г·К)
Удельная теплоемкость стекла Ст(ст) = 0,753 Дж/(г-К)
Мерными цилиндрами отмерьте равные объемы растворов кислоты и основания (0,03-0,10 л, по указанию преподавателя). Температуру одного из растворов, например основания, измерьте непосредственно в цилиндре термометром, вынутым из калориметра. После этого термометр ополосните дистиллированной водой и снова вставьте в калориметр. Раствор кислоты перелейте через воронку, в стакан калориметра и также запишите его температуру. Раствор щелочи быстро прилейте в калориметр к раствору кислоты, перемешайте в течение нескольких секунд и наблюдайте за столбиком ртути термометра. Запишите самое высокое показание. Повторите опыт с этой же парой кислоты и основания. Затем проведите по два параллельных опыта с другими парами кислота – основание. Полученные экспериментальные данные запишите в таблицу по форме:
|
Измеренные и вычисленные величины |
Реагирующие вещества | ||
|
HCl + KOH |
HNO3 + KOH |
CH3COOH + KOH | |
|
Температура раствора кислоты Тк |
|
|
|
|
Температура раствора основания Tо |
|
|
|
|
Начальная температура опыта Т1= 0,5(Тк+То) |
|
|
|
|
Наивысшая температура после смешения Т2 |
|
|
|
|
ΔT=T2 - T1 |
|
|
|
|
Q, кДж |
|
|
|
|
ΔНр, кДж/моль |
|
|
|
Анализ результатов. Для вычисления по экспериментальным данным теплоты реакции нейтрализации сначала рассчитайте общую теплоемкость калориметра Cm, учитывая теплоемкость раствора и теплоемкость стакана:
Cm = Cm(cm)·m(cm) + Cm(H2O)·m(р-р)
где m(р-р) - масса раствора в калориметре, вычисляемая по объему раствора и плотности. Плотность может быть принята равной 1 г/мл.
Затем вычислите выделившуюся в калориметре теплоту Q = Cm·ΔT
Эта теплота постепенно по мере выравнивания температуры передается в окружающую среду и может быть принята равной по абсолютному значению изменению энтальпии системы (калориметра): ΔHк = -Q
Для расчета теплоты реакции ΔHр-я найденное значение теплоты необходимо пересчитать на 1 моль реагирующей кислоты или основания, что соответствует 1 моль образующейся воды:
|
ΔHр-я = |
ΔHк |
= |
ΔHк |
|
n |
cV |
где n(x) - количество одного из веществ, участвующих в реакции
Рассчитайте теоретическое значение стандартной энтальпии изученных реакций, используя термодинамические свойства веществ и сравните с полученными значениями. Найдите отклонения найденных значений от расчетных. Объясните вероятные причины отклонений. Укажите зависимость теплоты реакции от природы реагирующих кислот и оснований.
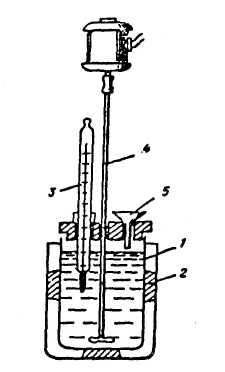
Рисунок 1. Схема калориметра.
|
|
|
| |
| |
| |
|
Таблица 1. Термодинамические свойства некоторых веществ, применяемых в медицине
|
Вещество или ион |
Состояние |
ΔH°298 |
ΔG°298 |
S°298 |
|
НСl |
aq |
-167 |
-131 |
55 |
|
Н2О |
ж |
-286 |
-238 |
70 |
|
К+ |
aq |
-251 |
-282 . |
103 |
|
KI |
aq |
-307 |
-334 |
212 |
|
NH3 |
aq |
-80,7 |
-26,6 |
110 |
|
HNO3 |
ж |
-173 |
-80 |
156 |
|
NO3- |
aq |
-207 |
-114 |
146 |
ΔH°298 - стандартная теплота образования вещества, кДж/моль
ΔG°298 - стандартное изменение энергии Гиббса при образовании сложного вещества из простых веществ, кДж/моль
S°298 - стандартная энтропия вещества, Дж/(моль∙К)
Сокращения, принятые в табл.: к - кристаллическое состояние, ж - жидкое, г - газообразной, aq -вещество (ион) в водном растворе.
Вопросы к защите работы.
Каковы основные источники ошибок в проведении эксперимента?
На какие промежуточные стадии можно разделить процесс нейтрализации слабой кислоты сильным основанием?
Чем объясняется постоянство стандартных теплот реакций нейтрализации для разных сильных кислот и оснований?
Основная литература: 1-7.
Дополнительная литература: 1-24.