
- •Організація, управління та економіка фармації
- •Перелік лікарських засобів, що підлягають предметно-кількісному обліку в закладах охорони здоров’я
- •Форма вимоги-замовлення
- •Перелік лікарських засобів (за міжнародними непатентованими назвами), на які не дозволяється виписувати Рецепти
- •1. Загальні положення
- •2. Загальні вимоги до приміщень та устаткування аптечних закладів
- •3. Загальні санітарно-гігієнічні вимоги до прибирання приміщень, догляду за устаткуванням аптечних закладів
- •4. Вимоги до особистої гігієни персоналу аптечних закладів, що не здійснюють виробництво (виготовлення) лікарських засобів
- •5. Вимоги до приміщень, устаткування аптечних закладів та санітарно-гігієнічні вимоги при виробництві (виготовленні) ліків в умовах аптеки
- •6. Вимоги до особистої гігієни персоналу аптечних закладів, що здійснюють виробництво (виготовлення) лікарських засобів
- •7. Санітарно-гігієнічні вимоги при виготовленні нестерильних лікарських форм
- •8. Порядок контролю за дотриманням санітарно-протиепідемічного режиму в аптечних закладах
- •Технологія лікарських форм
- •Приймання рецептів, виготовлення і відпуск лікарських засобів
- •Фармацевтична хімія
- •Журнал Реєстрації контролю якості води очищеної
Журнал Реєстрації контролю якості води очищеної
|
Дата отримання води |
Дата контролю |
№ аналізу |
№ балону |
Результати на відсутність домішок |
Заключення |
Підпис | |||||
|
Cl |
SO4 |
Ca2+ |
Відновлюючі речовини |
NH3 |
CO2 | ||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аналіз води очищеної
Зовнішній вигляд: прозора рідина без запаху, смаку і кольору,
рН=5,0-6,8
Хлориди – до 10 мл води очищеної додають 0,5 мл розведеної азотної кислоти і 0,5 мл розчину срібла нітрату. Розчин не повинен змінюватись впродовж не менш як 15 хв.
Сульфати – до 10 мл води очищеної додають 0,5 мл розведеної соляної кислоти, додають 1 мл розчину хлориду барію. Розчин не повинен змінюватись впродовж 1 години.
Солі кальцію – до 10 мл води очищеної додають по 1 мл розчинів аміаку, хлориду амонію і оксалату амонію. Розчин повинен залишатися прозорим впродовж 10 хвилин.
Відновлюючі речовини – до 100 мл води очищеної додають 10 мл кислоти сірчаної розведеної і 0,2 мл 0,01М розчину калію перманганату. Кип'ятять на протязі 5 хвилин. Розчин повинен залишатися світло-рожевим.
Аміак - до 10 мл. води очищеної додають З краплі реактиву Неслера. На протязі 5 хвилин не повинно спостерігається забарвлення, або змучення чи слабо жовтувате забарвлення.
Зберігання: закрита тара.
1) Rp.: Acidi hydrochloridi 1% 100 ml
Pepsini 2,0
D. S.
Тотожність:
До 2 крапель розчину додаємо 2 краплі розчину нітрату срібла.
![]()
Спостереженя: Випадає білий творожистий осад.
Синій лакмусовий папірець змочують аналізуючим розчином.
Спостереження: папірець набуває червоного кольору.
До 2 мл аналізованого розчину додаємо 2 мл розчину таніну.
Спостереження: Утворюється білий студенистий осад (реакція на пепсин).
Кількісне визначення:
До 1 мл розчину додаємо 1 краплю метилового оранжевого і титруємо 0,1 н розчином гідроксиду натрію до жовтого забарвлення.
![]()
![]() =0,27
мл
=0,27
мл
![]()
![]()
Висновок: Дана лікарська форма виготовлена задовільно.
2) Rp.: Calcii chloridi 3,0
Kalii iodidi 2,0
Aquae purificati ad 100 ml
D. S.:
Тотожність:
Катіон кальцію визначають реакцією з оксалатом амонію
Ca![]() + (NH4)2C2O4
+ (NH4)2C2O4
![]() CaC2O4
CaC2O4![]() + NH4
+ NH4![]()
Білий кристалічний осад
Катіон калію ідентифікують з гексанітрокобальтатом натрію
2К![]() +
+
![]()
![]() + 2Na
+ 2Na![]()
оранжево – червоний осад
Хлориди і йодиди визначають з розчином нітриту срібла:
![]()
![]()
Кількісне визначення.
І. Роздільний кількісний аналіз обох компонентів можна провести методом меркурометрії в одній наважці.
Для визначення калію йодиду 2 мл мікстури титрують 0,1М розчином нітрату окисної ртуті до появи незникаючого червоного помутніння (Vмл) Е = 2М. м.
![]()
Вміст калію йодиду розраховують за формулою :
![]() ,
де
,
де
Т – титр
![]() - загальний
об’єм лікарської форми;
- загальний
об’єм лікарської форми;
![]() - об’єм
лікарської форми, взятий на визначення,
мл.
- об’єм
лікарської форми, взятий на визначення,
мл.
Для
визначення кальцію хлориду до від
титрованої рідини додають 5 – 7 крапель
дифенілкарбазону, 1 – 2 краплі розведеної
азотної кислоти і титрують 0,1М розчином
окисної ртуті до фіолетового забарвлення
(![]() )
Е = 1/2М. м.
)
Е = 1/2М. м.
Вміст кальцію хлориду розраховують за формулою:
![]()
![]()
ІІ. Кальцію хлорид визначають комплексонометрично. До 2 мл мікстури додають 4 – 5 мл аміачного буферного розчину, 0,1г індикаторної суміші кислотного хром і титрують 0,05М розчином трилону Б до синьо – фіолетового забарвлення. Е = М. м.
Розрахунок проводять за формулою:
![]()
Метод кількісного визначення калію йодиду – аргентометрія по Фаянсу. 2 мл мікстури титрують 0,1М розчином нітрату окисної ртуті до появи незникаючого червоного помутніння.
![]()
Розраховуємо титр:
![]()
![]()
Розраховуємо вміст калію йодиду:
![]()
![]()
Висновок: Дана лікарська форма виготовлена задовільно.
3) Rp.: Natrii tetraboratis
Natrii hydrocarbonatis ana 0,1
Aquae purificatae 10 ml
D. S.:
Органолептичний контроль. Безбарвна прозора рідина без запаху, без механічних включень.
Ідентифікація.
Іон натрію визначають за забарвленням полум’я у жовтий колір.
Натрію гідрокарбонат. При додаванні до 5 крапель лікарської форми 1 мл НСІ виділяються бульбашки газу:
![]()
Натрію тетраборат. 0,2 мл випарюють у фарфоровій чашці досуха, додають 2–3 краплі конц. сірчаної кислоти та 2–3 мл спирту і запалюють. Суміш горить полум’ям із зеленою облямівкою (утворення борно метилового ефіру).
На куркумовий папірець наносять 2 краплі підкисленого розчину, змочують 1 – 2 краплями спирту і підсушують. Куркумовий папірець забарвлюється в рожевий або червоно - бурий колір.
Після змочування розчином аміаку забарвлення переходить в зеленкувато – чорне.
Кількісне визначення.
Визначають суму обох інгредієнтів. До точного об’єму аналізуючи крапель додають 1 краплю розчину метилового оранжевого та титрують суму обох компонентів до рожевого забарвлення (V).
![]()
М(е) = ½
М. м. =
![]()
![]() 1
мл 0,1М розчину НСІ відповідає 0,01907г
натрію тетраборату.
1
мл 0,1М розчину НСІ відповідає 0,01907г
натрію тетраборату.
![]()
М(е) = М. м. = 84,01
![]()
1 мл 0,1М розчину НСІ відповідає 0,0084г натрію гідрокарбонату.
Отриманий розчин кип’ятять 2 – 3 хв для видалення вуглекислоти, охолоджують, додають 10 мл нейтралізованого за фенолфталеїном гліцерину (для перетворення борної кислоти, що утворилась при титруванні натрію тетраборату в гліцероборну), 5 крапель розчину фенолфталеїну та титрують 0,1М розчином їдкого натру (V1).
Еквівалент натрію тетраборату дорівнює ¼ М. м., оскільки із однієї молекули натрію тетраборату при титруванні НСІ виділяється 4 молекули борної кислоти.
М(е) =
1/4М. м. =
![]()
![]()
1 мл NaOH відповідає 0,009534г натрію тетраборату.
Вміст натрію тетраборату (Х) та натрію гідрокарбонату (Х1) розраховують за формулою:
![]()
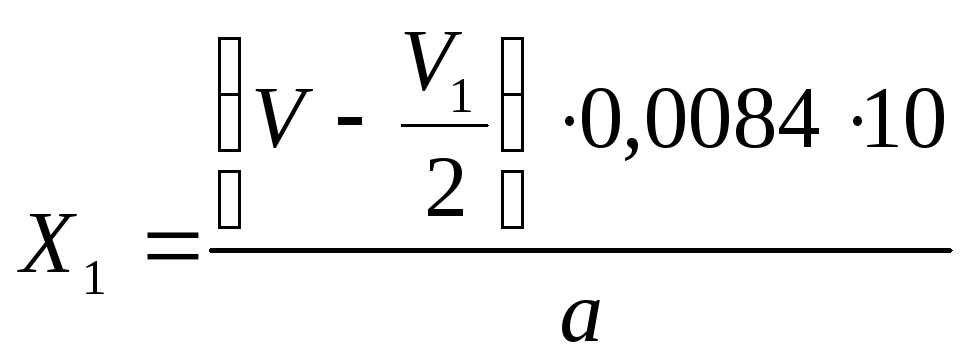
V1- об’єм 0,1М NaOH;
V – об’єм 0,1М НСІ в суміші компонентів.
4) Rp.: Sol. Furacyllini 1:5000 200 ml
D. S.:
Розчин фурациліну 1:5000 – 200 мл
Натрію хлориду – 0,09
Ідентифікація.
До 0,5 мл розчину додають три краплі 10% натрію гідроксиду. З’являється оранжево – червоне забарвлення
Реакція супроводжується розривом фуранового циклу. Аміак визначають по зміні забарвлення вологого червоного лакмусового папірця.
Краплю розчину вносять в безбарвне полум’я; полум’я забарвлюється в жовтий колір (натрій іон);
До краплі розчину додають краплю розведеної азотної кислоти, розчин нітрату срібла; з’являється сирнистий білий осад, розчинний в розчині аміаку (іон хлору).
![]()
Кількісне визначення.
Йодометрія в лужному середовищі, зворотне титрування, індикатор – крохмаль, Е = ¼ М. м. У лужному середовищі йод знаходиться у вигляді йодиду та гіпойодиту:
![]()
Після підкислення йод, що виділився, відтитровують розчином натрію тіосульфату з мікробюретки:
![]()
![]()
Паралельно
проводять контрольний дослід. До 3 мл
розчину йоду додають 1 мл 10% розчину
натрію гідроксиду, 10 мл лікарської
форми, збовтують 2 – 3 хвилини і додають
2 мл
![]() розведеної,
титрують 0,01М розчином
розведеної,
титрують 0,01М розчином![]() -
-![]() .
Індикатор – крохмаль, додають у кінці
титрування.
.
Індикатор – крохмаль, додають у кінці
титрування.
![]()
![]()
1 мл 0,01М розчину натрію тіосульфату відповідає 0,00049535г фурациліну.
Вміст фурациліну в г в лікарській формі розраховують за формулою:
![]()
![]() -
об’єм 0,01М розчину натрію тіосульфату,
витрачений на титрування у контрольному
досліді.
-
об’єм 0,01М розчину натрію тіосульфату,
витрачений на титрування у контрольному
досліді.
![]()
В 2 мл лікарської форми 0,04458г фурациліну.
![]() визначають
методом меркуриметрії.
визначають
методом меркуриметрії.
Висновок: Дана лікарська форма виготовлена задовільно.
5) Rp.: Butadioni 0,1
Sacchari 0,1
D. S.:
Тотожність.
Реакція з сульфатом міді. Для отримання натрієвої солі збовтують з 0,1М розчином гідроксиду натрію, який беруть у меншій кількості, ніж це необхідно для розчинення бутадіону, з тим, щоб попередити у подальшому можливе утворення гідроксиду міді.
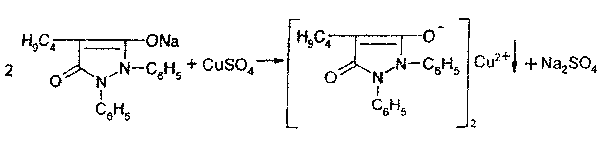
При окисленні розчином нітриту натрію в концентрованій сірчаній кислоті виникає оранжеве забарвлення, яке переходить у вишневе. Одночасно спостерігається виділення бульбашок газу.
Кількісне визначення.
Наважку порошку розчиняють у нейтралізованому за фенолфталеїном спирті або ацетоні і титрують 0,1М розчином їдкого натру ( індикатор - фенолфталеїн).
![]()
1 мл натрію гідроксиду відповідає 0,03084г бутадіону.
Вміст бутадіону в лікарській формі (г) розраховують за формулою.
![]()
В – маса порошку за прописом;
а – маса лікарської форми, що взята на визначення, г.
![]()
![]()
Висновок: лікарська форма виготовлена задовільно.
6) Rp.: Sol. Natrii bromidi 20% 1000 ml
D. S.:
Органолептичний контроль: прозора рідина без кольору без інородних включень.
Тотожність:
5мл препарату випарюємо до 1 мл. Дає-позитивну реакцію на натрій. Змочений в розчині металевий дріт вносять в безбарвне полум'я
Спостереження: полум'я забарвлюється в жовтий колір.
До 1 мл. розчину броміду додаємо 1 мл. розведеної хлористоводневої кислоти; 0,5 мл. розчину хлораміну і 1 мл. розчину хлороформу іінтенсивно збовтуємо.
Спостереження: хлороформна фракція забарвлюється в жовто-бурий колір.
Кількісний аналіз:
Метод рефрактометрії: на призму рефрактометру наносимо декілька крапель води очищеної і по шкалі знаходимо показник заломлення. Потім витираємо призму насухо і наносимо декілька крапель препарату, після чого знаходимо показник заломлення по шкалі.
![]()
F=0,00135
n0 = 1.333
![]()
200,2-200 =0,2
0,2/200×100=1%
Припустиме відхилення +/- 2%
Відхилення в межах норми
Висновок: лікарська форма виготовлена. задовільно.
7) Rp.: Solutio Sulfacili natrii 20% 10 ml
D. S.
Тотожність:
До 0,5 мл препарату додають 1 мл розчину сульфату міді.
Спостереження: Утворюється осад блакитно-зеленого кольору, який не змінюється при стоянні.
Кількісне визначення
Рефрактометрія
Дані рефрактометричного визначення:
n=1,3722
n0=1,3330
F=0,00196
![]()
2) 1 мл
аналізованого розчину розводимо в
мірній колбі до 50 мл водою. До 10 мл
одержаного розчину додаємо 2 краплі
змішаного індикатора і титрують 0,1 н
розчином
![]() до яскраво-фіолетового забарвлення.
до яскраво-фіолетового забарвлення.
За даними титрування:
V = 1,58
T = 0,02542
P = 5
![]()
Висновок: Дана лікарська форма виготовлена задовільно.
1 При використанні сірки як хімічного тесту додавати барвник недоцільно через те, що при плавленні речовини не відбувається його змішування з барвником.
2 "+" - температурний параметр, для контролю якого використовують хімічне з'єднання.
3 Використовують будь-який із барвників, перелічених у рецептурі 2.
4
