
- •7. Термодинаміка
- •7.1. Загальні поняття та визначення фізичних величин
- •7.2. Термодинамічний метод дослідження
- •7.3. Енергообмін між термодинамічними системами
- •7.4. Термодинамічні стани та процеси
- •7.5. Ідеальний газ. Термодинамічні процеси в ідеальному газі
- •7.6. Поняття внутрішньої енергії
- •7.7. Робота термодинамічної системи
- •7.8. Перший закон (начало) термодинаміки
- •7.9. Адіабатичний процес
- •7.10. Теплоємність ідеального газу
- •7.11. Теплові двигуни та холодильні машини
- •7.12. Цикл Карно
- •7.13. Ентропія
- •7.13.1. Ентропія s системи за Клаузіусом
- •7.13.2. Ентропія за Больцманом.
- •7.14. Другий закон (начало) термодинаміки
- •7.15. Третій закон (начало) термодинаміки
- •7.16. Контрольні питання
7.13. Ентропія
7.13.1. Ентропія s системи за Клаузіусом
є функція стану системи, диференціал якої в елементарному оборотному процесі дорівнює відношенню нескінченно малої кількості тепла Q, переданого системі, до її абсолютної температури
![]() .
(1)
.
(1)
Для ідеального газу
![]() ,
,
тому
![]()
![]() ,
(2)
,
(2)
а зважаючи на те що
![]()
![]()
маємо
![]() ,
,
![]() .
(3)
.
(3)
Аналогічно можна одержати ще й такий вираз для ентропії
![]() ,
,
![]() .
(4)
.
(4)
Для одноатомних газів CP та CV не залежать від Т і після інтегрування (2-4) одержимо три вирази для ентропії
![]() ,
,
 ,
,
![]() ,
,
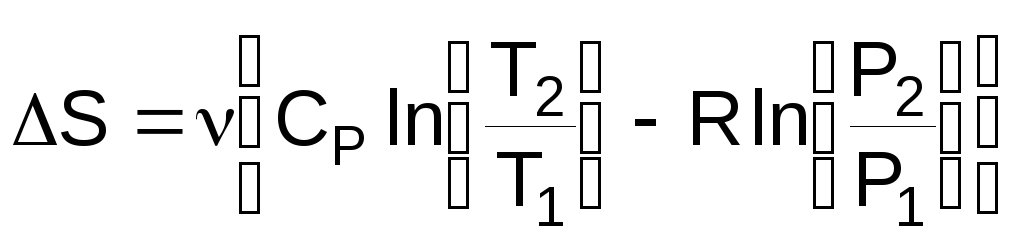 ,
,
![]() ,
,
 ,
,
де
![]() стала інтегрування. Фізичний зміст має
приріст ентропії у термодинамічному
процесі
стала інтегрування. Фізичний зміст має
приріст ентропії у термодинамічному
процесі![]() S,
а тому величина
S,
а тому величина
![]() є не суттєвою.
є не суттєвою.
Для адіабатичного оборотного процесу
Q=0, dS=0, S=const
і тому цей процес називають ще й ізоентропійним.
При ізотермічному
оборотному процесі
![]() і
і
![]()
при
ізобаричному
процесі
![]() і
і
![]()
при
ізохоричному
процесі
![]() і
і
![]() .
.
Якщо в циклі Карно записати роботу через теплоту, то для коефіцієнта корисної дії одержимо такі співвідношення
![]() ,
,
з яких випливає, що за цикл
![]() .
.
Останній вираз визначає приведену теплоту циклу Карно. Тепер для ентропії за цикл маємо
![]()
і остаточно
![]() ,
,
![]() .
.
Якщо цикл відбувається за необоротними процесами 1-1' i 2-2', то не вся теплота переходить у роботу i Q1+Q2>А в циклі Карно, тобто
![]() ,
,
і
![]() .
.
В загальному випадкові маємо
![]() ,
,
де знак рівності відноситься до циклу з оборотними процесами, а знак >0 відноситься до циклу з необоротних процесів. Для довільного елементарного термодинамічного процесу
![]() .
.
7.13.2. Ентропія за Больцманом.
Поняття ентропії з
молекулярно-кінетичної точки зору
розглянув Больцман. Увівши термодинамічну
ймовірність макроскопічного стану
системи
![]() ,
Больцман визначив ентропію системи так
,
Больцман визначив ентропію системи так
![]() ,
,
де S0 - деяка константа, k - стала Больцмана..
Термодинамічною ймовірністю
називається число можливих мікростанів
системи, які створюють даний макростан,
тобто
показує скількома способами на мікрорівні
може бути реалізовано заданий кількісний
розподіл частинок системи, наприклад,
по об'єму та швидкостям, причому
![]() .
Розглянемо це визначення докладніше
на такому прикладі. Нехай система
складається з 4 пронумерованих частинок.
Для визначення макростану системи,
зокрема, розташування частинок у її
об'ємі V, поділеному навпіл, задамо
кількість частинок у лівій і правій
його половинках, як це показано в таблиці.
Кожний з макростанів може реалізуватися
певним розташуванням пронумерованих
частинок. Кількість цих реалізацій і
є термодинамічною ймовірністю. З таблиці
видно, що
зростає при переході системи до
рівноважного стану (однакове число
частинок в обох половинках) і має максимум
у ньому. Це означає, що ентропія системи
є сталою для рівноважних процесів і
зростає для всіх інших, тобто для
довільного елементарного термодинамічного
процесу
.
Розглянемо це визначення докладніше
на такому прикладі. Нехай система
складається з 4 пронумерованих частинок.
Для визначення макростану системи,
зокрема, розташування частинок у її
об'ємі V, поділеному навпіл, задамо
кількість частинок у лівій і правій
його половинках, як це показано в таблиці.
Кожний з макростанів може реалізуватися
певним розташуванням пронумерованих
частинок. Кількість цих реалізацій і
є термодинамічною ймовірністю. З таблиці
видно, що
зростає при переході системи до
рівноважного стану (однакове число
частинок в обох половинках) і має максимум
у ньому. Це означає, що ентропія системи
є сталою для рівноважних процесів і
зростає для всіх інших, тобто для
довільного елементарного термодинамічного
процесу
![]() .
.
В загальному випадку з визначення ентропії за Больцманом, можна одержати усі співвідношення, які випливають із визначення ентропії за Клаузіусом.
Таблиця 4. Визначення
термодинамічної ймовірності
![]()
|
№ п/п |
Макростан (указує кількість частинок) |
Мікростан (указує, де і які саме частинки за номерами там знаходяться) |
| ||
|
|
ліворуч |
праворуч |
ліворуч |
праворуч |
|
|
1 |
0 |
4 |
- |
1,2,3,4 |
1 |
|
2 |
1 |
3 |
1 2 3 4 |
2,3,4 1,3,4 1,2,4 1,2,3 |
4 |
|
3 |
2 |
2 |
1,2 1,3 1,4 3,4 2,4 2,3 |
3,4 2,4 2,3 1,2 1,3 1,4 |
6 |
|
4 |
3 |
1 |
2,3,4 1,3,4 1,2,4 1,2,3 |
1 2 3 4 |
4 |
|
5 |
4 |
0 |
1,2,3,4 |
- |
1 |
