
- •7. Термодинаміка
- •7.1. Загальні поняття та визначення фізичних величин
- •7.2. Термодинамічний метод дослідження
- •7.3. Енергообмін між термодинамічними системами
- •7.4. Термодинамічні стани та процеси
- •7.5. Ідеальний газ. Термодинамічні процеси в ідеальному газі
- •7.6. Поняття внутрішньої енергії
- •7.7. Робота термодинамічної системи
- •7.8. Перший закон (начало) термодинаміки
- •7.9. Адіабатичний процес
- •7.10. Теплоємність ідеального газу
- •7.11. Теплові двигуни та холодильні машини
- •7.12. Цикл Карно
- •7.13. Ентропія
- •7.13.1. Ентропія s системи за Клаузіусом
- •7.13.2. Ентропія за Больцманом.
- •7.14. Другий закон (начало) термодинаміки
- •7.15. Третій закон (начало) термодинаміки
- •7.16. Контрольні питання
7.8. Перший закон (начало) термодинаміки
Перший закон (начало)
термодинаміки
передане системі тепло
![]() ,
створює приріст внутрішньої енергії
системи dU та йде на виконання нею
елементарної роботи
,
створює приріст внутрішньої енергії
системи dU та йде на виконання нею
елементарної роботи![]()
![]()
(нагадаємо, що символом
![]() позначаються елементарні величини, які
не є функціями стану системи).
позначаються елементарні величини, які
не є функціями стану системи).
Перший закон термодинаміки виражає загальний закон збереження та перетворення енергії і не визначає напрямок протікання процесу теплопередачі, а також умов, за яких відбувається теплопередача. Це питання врегульовується другим законом термодинаміки.
7.9. Адіабатичний процес
Адіабатичним називається термодинамічний процес, що переводить термодинамічну систему в різні рівноважні стани без теплообміну із зовнішнім середовищем, тобто коли Q=0. Для ідеального газу справджується рівняння адіабати
![]() ,
(1)
,
(1)
де
=![]()
стала адіабати, що залежить від структури
складових газу. Разом із тим рівноважні
стани описуються одночасно і рівнянням
Клапейрона - Менделєєва
стала адіабати, що залежить від структури
складових газу. Разом із тим рівноважні
стани описуються одночасно і рівнянням
Клапейрона - Менделєєва
![]() .
.
Щоб одержати рівняння (1), запишемо перший закон термодинаміки у вигляді
![]()
![]() .
(2)
.
(2)
Узявши диференціал по P,V,T
у рівнянні стану
![]() ,
матимемо
,
матимемо
![]() ,
(3)
,
(3)
і після підстановки в перший закон термодинаміки одержимо
![]()
![]() .
(4)
.
(4)
Поділивши ліву частину (4)
на
![]() PV,
одержимо
PV,
одержимо
![]()
![]()
![]()
![]() ,
,
що й треба було довести.
Користуючись об'єднаним
газовим законом
![]() ,
одержане рівняння адіабати можна
записати в таких видах
,
одержане рівняння адіабати можна
записати в таких видах
![]() ,
,
![]() .
(5)
.
(5)
Робота розширення
газу від
![]() до
до![]() при адіабатичному
процесі може бути
одержана з першого начала Q=dU+A=0,
а саме
при адіабатичному
процесі може бути
одержана з першого начала Q=dU+A=0,
а саме
A=-dU. (6)
В інших виразах роботу можна знайти прямим обчисленням
 .
(7)
.
(7)
Таблиця 3. Характеристики ізопроцесів.
|
Назва процесу |
Рівняння процесу |
Зв'язок між параметрами стану |
Робота в процесі |
Тепло, передане в процесі |
|
Ізохорний |
V = const |
|
A = 0, A = 0 |
Q = CVdT, Q=CV(T2 - T1) |
|
Ізобарний |
Р = const |
|
A = РdV, A = Р(V2 - V1) |
Q = CpdT, Q=Cp(T2 - T1) |
|
Ізотермічний |
T = const |
РV = const |
A = РdV,
A = RTln(
A = RTln( |
Q = A, Q = A |
|
Адіабатний |
Q = 0 |
PV = const
TV(- 1)=const |
A = pdV = - dU A = - U = CV(T1 - T2)
|
Q = 0, Q = 0 |
7.10. Теплоємність ідеального газу
Теплоємністю С термодинамічної
системи називається
відношення елементарного тепла
![]() ,
переданого системі, до відповідної
величини зміни температури тіла dT
,
переданого системі, до відповідної
величини зміни температури тіла dT
![]() (1)
(1)
![]() (2)
(2)
і вона чисельно дорівнює
теплоті, необхідній для збільшення
температури тіла на 1К. Питома теплоємність
с
теплоємність одиниці маси речовини с
= С/m, а молярна
![]() .
.
Теплоємність при сталому
об'ємі позначається
як
![]() (система не виконує
роботи pdV=0)
і може бути обчислена з (2)
(система не виконує
роботи pdV=0)
і може бути обчислена з (2)
![]() .
(3)
.
(3)
Внутрішню
енергію газу можна записати через
![]()
![]() .
(4)
.
(4)
Теплоємність при сталому
тискові позначається
як
![]() і може бути обчислена з (2) при врахуванні
(3) так
і може бути обчислена з (2) при врахуванні
(3) так
![]()
![]() .
.
Ми знайшли d(pV) із рівняння Клапейрона-Менделєєва, врахувавши, що P=const,
![]()
Знайдемо
відношення
![]() до
до![]()
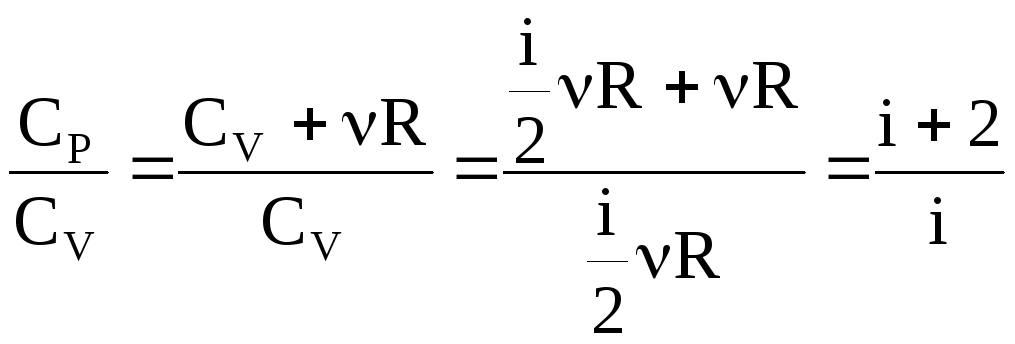 .
(5)
.
(5)
З
(5) видно, що стала адіабати
![]() може бути представлена через відношення
теплоємностей при сталому тискові і
при сталому об'ємі так
може бути представлена через відношення
теплоємностей при сталому тискові і
при сталому об'ємі так
![]() .
.
