
- •7. Термодинаміка
- •7.1. Загальні поняття та визначення фізичних величин
- •7.2. Термодинамічний метод дослідження
- •7.3. Енергообмін між термодинамічними системами
- •7.4. Термодинамічні стани та процеси
- •7.5. Ідеальний газ. Термодинамічні процеси в ідеальному газі
- •7.6. Поняття внутрішньої енергії
- •7.7. Робота термодинамічної системи
- •7.8. Перший закон (начало) термодинаміки
- •7.9. Адіабатичний процес
- •7.10. Теплоємність ідеального газу
- •7.11. Теплові двигуни та холодильні машини
- •7.12. Цикл Карно
- •7.13. Ентропія
- •7.13.1. Ентропія s системи за Клаузіусом
- •7.13.2. Ентропія за Больцманом.
- •7.14. Другий закон (начало) термодинаміки
- •7.15. Третій закон (начало) термодинаміки
- •7.16. Контрольні питання
7.5. Ідеальний газ. Термодинамічні процеси в ідеальному газі
Ізотермічний процес ідеального газу процес, що переводить термодинамічну систему в різні рівноважні стани при сталій температурі й зв'язок між термодинамічними параметрами описується законом Бойля - Маріотта
![]() ,
,
де
![]() тиск і об'єм газу після і-го ізотермічного
процесу.
тиск і об'єм газу після і-го ізотермічного
процесу.
Ізобаричний процес ідеального газу процес, що переводить термодинамічну систему в різні рівноважні стани при сталому тискові й зв'язок між термодинамічними параметрами описується законом Шарля
![]() ,
,
де
![]() температура і об'єм газу після і-го
ізобаричного процесу.
температура і об'єм газу після і-го
ізобаричного процесу.
Ізохоричний процес ідеального газу процес, що переводить термодинамічну систему в різні рівноважні стани при сталому об'ємі й зв'язок між термодинамічними параметрами описується законом Гей-Люсака
![]() ,
,
де
![]() температура і тиск газу після і-го
ізохоричного процесу.
температура і тиск газу після і-го
ізохоричного процесу.
Об’єднаний газовий закон при будь-яких переходах ідеального газу з одного рівноважного стану в інший рівноважний стан виконується співвідношення виду
![]() ,
,
де
![]() температура і об'єм газу після і-го
будь-якого процесу.
температура і об'єм газу після і-го
будь-якого процесу.
Закон Авогадро:
при однакових тисках і температурах у
рівних об'ємах різних ідеальних газів
міститься однакове число молекул або
теж саме: при однакових тисках і
температурах моль різних ідеальних
газів займає однаковий об'єм. За нормальних
умов (![]() t)
моль будь-яких ідеальних газів займає
об'єм
t)
моль будь-яких ідеальних газів займає
об'єм![]() .
.
Рівняння стану ідеального газу описується рівнянням Клапейрона - Менделєєва
![]() ,
,
де
![]() маса
газу,
маса
газу,
![]() його молярна маса, а
його молярна маса, а![]() кількість молів газу, R = 8. 31 Дж/(моль К)
- універсальна газова стала.
кількість молів газу, R = 8. 31 Дж/(моль К)
- універсальна газова стала.
З рівняння Клапейрона - Менделєєва PV = RT витікає рівняння для тиску, яке співпадає з рівнянням, обчисленим в молекулярно-кінетичній теорії,
![]()
![]()
де
![]() маса
молекули, n=N/V
- концентрація частинок.
маса
молекули, n=N/V
- концентрація частинок.
Парціальний тиск газу в суміші - тиск, який мав би цей газ, якщо б із суміші були вилучені всі інші гази, а об'єм і температура залишились би попередніми.
Закон Дальтона:
тиск суміші з N
ідеальних газів дорівнює сумі їх
парціальних тисків
![]()
![]() .
.
У випадку реальних газів існує декілька рівнянь стану, які описують його певну фізичну модель, наприклад, рівняння Ван-дер-Ваальса.
7.6. Поняття внутрішньої енергії
Внутрішня енергія U термодинамічної системи є сума:
а) кінетичної енергії хаотичного теплового руху частинок системи (молекул, атомів, іонів, вільних електронів і т. п. ),
б) потенційної енергії взаємодії цих частинок,
в) енергії взаємодії атомів чи іонів у молекулі,
г) енергії атомів та іонів,
д) енергії ядер,
е) енергії електромагнітного випромінювання.
Внутрішня енергія є однозначною функцією стану системи: її приріст U при переході зі стану І в стан ІІ не залежить від виду процесу і дорівнює U = U2 - U1. У випадку кругового процесу повна зміна внутрішньої енергії системи дорівнює нулю.
В елементарній термодинаміці ідеального газу внутрішня енергія включає лише кінетичну енергію хаотичного теплового руху частинок системи.
7.7. Робота термодинамічної системи
Умовою здійснення термодинамічною системою елементарної роботи А є переміщення взаємодіючих із нею зовнішніх тіл. При цьому елементарна робота А' зовнішніх тіл над системою А' = - А.
Р оботою
розширення газу
називається робота, що здійснюється
системою проти сил зовнішнього тиску.
При цьому елементарна робота дорівнює
оботою
розширення газу
називається робота, що здійснюється
системою проти сил зовнішнього тиску.
При цьому елементарна робота дорівнює
А = PdV і
 .
.
Наприклад, при розширенні газу в циліндрі (див. Мал. 12), газ створює тиск Р на поршень площею S і в результаті на нього діє сила F = PS. При переміщенні поршня на dx, газ виконує роботу
![]() ,
,
де dV - приріст об'єму газу.
Робота розширення
газу від об'єму V1
до об'єму V2 при
ізотермічному
процесі (![]() )
дорівнює A=
)
дорівнює A= .
З рівняння Клапейрона - Менделєєва маємо
.
З рівняння Клапейрона - Менделєєва маємо
![]() ,
,

Робота
розширення газу від V1
до V2
при ізобаричному
процесі (![]() )
)
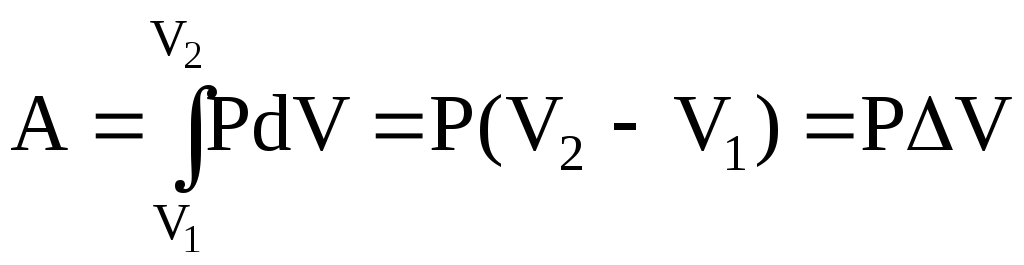 .
.
