
Kontrolnaja_rabota_ФИЗКОЛЛОИДНАЯ_
.pdfтура кипения последнего повысилась на 0,81 ºС. Из скольких атомов состоят молекулы серы в растворе? (8)
816.В 10,6 г раствора салициловой кислоты в этиловом спирте содержится 0,401 г салициловой кислоты. Повышение температуры кипения раствора равно 0,320 ºС, теплота парообразования этилового спирта составляет 906 Дж/г. Определите молярную массу салициловой кислоты. (139,1)
817.Определить температуру кипения 1 н раствора HNO3. Степень диссоциации HNO3 в данном растворе равна 0,82, плотность раствора считайте равной единице. (101 ºС)
818.При растворении 2,05 г едкого натра в 100 г воды температура кипения повысилась на 0,496 ºС. Определите кажущуюся степень диссоциации NaOH в данном растворе. (87,6 %)
819.При растворении 19,46 г сульфата натрия в 100 г воды температура кипения повысилась на 1,34 ºС. Определите кажущуюся степень диссоциации соли в данном растворе. (44,75 %)
820.Имеются растворы, содержащие в равных массах воды: первый – 0,25 моль сахара, второй – 0,13 моль хлорида кальция. Оба раствора кипят при одинаковой температуре. Определите кажущуюся степень диссоциации CaCl2 в растворе. (46,15 %)
821.Водный раствор, содержащий нелетучее растворенное вещество (неэлектролит), замерзает при температуре -2,2 ºС. Определите температуру кипения раствора и давление пара над раствором при температуре 20 ºС. Давление насыщенного пара воды при этой температуре равно 2337,8 Па. (100,61 ºС; 2290 Па)
822.Вычислите температуры кипения водных однопроцентных растворов: а) глицерина; б) глюкозы; в) свекловичного
сахара. Эбуллиоскопическая постоянная воды равна |
0,512 |
К·кг/моль. (а) 100,056 ºС; б) 100,029 ºС; в) 100,015 ºС) |
|
823.В эфире массой 100 г растворяется бензойная кислота массой 0,625 г. Вычислите повышение температуры кипения полученного раствора по сравнению с чистым эфиром. Эбуллиоскопическая постоянная эфира равна 2 К·кг/моль. (0,102 ºС)
824.Сколько граммов нафталина растворено в хлороформе массой 50 г, если полученный раствор кипит при температуре 62,234 ºС? Температура кипения хлороформа равна 61,2 ºС,
243
аэбуллиоскопическая постоянная его – 3,76 К·кг/моль. (1,76 г)
825.В каком объемном отношении нужно смешать этиловый спирт с глицерином, чтобы повышение температуры кипения полученного раствора над температурой кипения спирта было
равно 0,256 ºС? Плотности этилового спирта и глицерина соответственно равны 0,789 и 1,26 г/см3. Эбуллиоскопическая постоянная спирта равна 1,2 К·кг/моль. (81,4:1)
826.Раствор, содержащий бензальдегид массой 1,612 г в эфире массой 100 г, кипит при температуре 34,806 ºС. Температура кипения эфира равна 34,5 ºС, а эбуллиоскопическая постоянная его равна 2 К·кг/моль. Вычислите относительную молекулярную массу бензальдегида и относительную ошибку опыта в процентах по сравнению с величиной, найденной в справочнике. (105,3; 0,74 %)
827.При растворении камфоры (С10Н15О) массой 0,298 г в бензоле массой 21,2 г температура кипения повысилась на
0,236 ºС. Эбуллиоскопическая постоянная бензола |
равна |
2,6 К·кг/моль. Вычислите относительную молекулярную |
массу |
камфоры и относительную ошибку опыта в процентах по сравнению с величиной, найденной в справочнике. (154,9; 1,7 %)
828.Определите температуру кипения раствора, содержащего 0,006 моль камфоры в ацетоне массой 20 г. Температура кипения ацетона равна 56,3 ºС, а удельная теплота его испарения при этой температуре – 540,0 Дж/г. (56,8 ºС)
829.Раствор бензойной кислоты в эфире (массовой долей 2 %) кипит при такой же температуре, как и раствор, содер-
жащий неизвестное вещество массой 0,645 г в эфире массой 22,5 г. Вычислите относительную молекулярную массу неизвестного
вещества. Эбуллиоскопическая постоянная эфира равна |
2 |
К·кг/моль. (171,4) |
|
830.При растворении бензила (С14Н10О2) массой 0,374 г
вхлороформе массой 33,05 г повышение температуры кипения составило 0,202 ºС. Вычислите эбуллиоскопическую постоянную хлороформа и удельную теплоту его испарения при температуре кипения 61,2 ºС. (3,75; 248 Дж/г)
831.Раствор, содержащий азобензол (C12H10N2) массой
244
0,344 г в бензоле массой 26,42 г, кипит при температуре 80,386 ºС. Удельная теплота испарения бензола при температуре его кипения (80,2 ºС) равна 394,8 Дж/г. Вычислите относительную молекулярную массу азобензола. Полученную величину сравните с найденной в справочнике. (184)
832.Вычислите массовую долю (%) мочевины в водном растворе, если он кипит при температуре 100,128 ºС. Эбуллиоскопическая постоянная воды равна 0,512 К·кг/моль. (1,5 %)
833.Сколько граммов глюкозы нужно растворить в воде массой 100 г, чтобы повышение температуры кипения было равно 1 ºС? Считайте, что в этом случае применим закон Рауля. Эбуллиоскопическая постоянная воды равна 0,512 К·кг/моль. (35,2 г)
834.Давление пара над водным раствором глюкозы при температуре 100 ºС равно 100,9 кПа. Эбуллиоскопическая постоянная воды – 0,512 К·кг/моль. Вычислите температуру кипения раствора. (100,11 ºС)
835.Найдите давление пара над водным раствором свекловичного сахара при температуре 100 ºС, если этот раствор кипит
при 100,236 ºС. Определите температуру замерзания этого раствора. Эбуллиоскопическая постоянная воды равна 0,512 К·кг/моль, криоскопическая постоянная воды – 1,86 К·кг/моль. (1005 гПа; -0,857 ºС)
836.Раствор, содержащий хлорид аммония массой 0,75 г в воде массой 100 г, кипит при температуре 100, 128 ºС. Вычислите относительную молекулярную массу и кажущуюся степень диссоциации хлорида аммония в этом растворе. Эбуллиоскопическая постоянная воды равна 0,512 К·кг/моль. (30,16; 77,4 %)
837.Раствор, содержащий в воде массой 25 г бензойную кислоту массой 0,608 г, кипит при температуре 100,104 ºС. Эбуллиоскопическая постоянная воды равна 0,512 К·кг/моль. К слабым или сильным электролитам относится бензойная кислота? (1,9 %)
838.Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли, если раствор, содержащий в воде массой 100 г сульфат натрия массой 2,25 г, кипит при температуре 100,186 ºС Эбуллиоскопическая постоянная воды равна
245
0,512 К·кг/моль. (2,29; 64,5 %)
839.Раствор, содержащий глюкозу массой 7,252 г в воде массой 200 г, замерзает при температуре -0,378 ºС. Криоскопическая постоянная воды равна 1,86 К·кг/моль. Определите относительную молекулярную массу глюкозы и относительную ошибку в процентах по сравнению с величиной, найденной в справочнике.
840.При какой температуре замерзнет водный раствор, в 100 г которого содержится 0,022 моль мальтозы? Криоскопическая постоянная воды равна 1,86 К·кг/моль. (-0,442 ºС)
841.Определите температуру замерзания раствора, содержащего мочевину массой 0,625 г в воде массой 50 г. Криоскопическая постоянная воды равна 1,86 К·кг/моль. (-0,388 ºС)
842.Определите температуру замерзания раствора, со-
держащего 1,205·1023 молекул неэлектролита в воде объемом |
1 |
л. Криоскопическая постоянная воды равна 1,86 К·кг/моль. |
(- |
0,372 ºС) |
|
843.Вычислите, при какой температуре замерзнет водный раствор с массовой долей этиленгликоля C2H4(ОН)2 40 %. Криоскопическая постоянная воды равна 1,86 К·кг/моль. (20 ºС)
844.Определите, в каком отношении масс нужно смешать глицерин с водой, чтобы полученный раствор замерзал при температуре -10 ºС, считая, что для данного случая применим за-
кон Рауля. Криоскопическая постоянная воды равна |
1,86 |
К·кг/моль. (1:2) |
|
845.Температура замерзания бензола равна 5,5 ºС, а раствора, содержащего в бензоле массой 25,04 г неизвестное вещество массой 0,4678 г, – 4,872 ºС. Криоскопическая постоянная бензола равна 5,12 К·кг/моль. Вычислите относительную молекулярную массу неизвестного вещества. (152,3)
846.Сколько бензойной кислоты (С7Н6О2) растворено в уксусной кислоте массой 100 г, если температура замерзания последней понизилась на 0,824 ºС? Криоскопическая постоянная уксусной кислоты равна 3,9 К·кг/моль. (2,58 г)
847.Нафталин массой 0,5685 г, растворенный в толуидине (C7H9N) массой 25 г, вызвал понижение температуры замер-
246

зания на 0,942 ºС. Температура плавления чистого толуидина равна 43 ºС. Определите криоскопическую постоянную и теплоту плавления толуидина. (5,302 ºС; 157 Дж/г)
848.Какова массовая доля фруктозы в водном растворе, который замерзает при температуре -0,524 ºС? Криоскопическая постоянная воды равна 1,86 К·кг/моль. (4,83 %)
849.Температура плавления нафталина равна 80,1 ºС.
Она понижается на 0,832 ºС при растворении серы массой 3,122 г в нафталине массой 100 г. Удельная теплота плавления нафталина равна 149,5 Дж/г. Найдите молекулярную формулу серы в нафталинном растворе. (S8)
850.Температура замерзания водного раствора глицерина равна -0,5 ºС. Давление пара над чистой водой при этой температуре составляет 5,89 гПа. Криоскопическая постоянная воды – 1,86 К·кг/моль. Определите давление пара над раствором. (5,86 гПа)
851.Вычислите температуру замерзания водного раствора глюкозы, если давление пара над ним равно 98,5 % давления насыщенного пара воды при той же температуре. Криоскопическая постоянная воды равна 1,86 К·кг/моль. (-1,55 ºС)
852.Раствор, содержащий бромид натрия массой 0,933 г в воде массой 33,5 г, замерзает при температуре -0,944 ºС. Вычислите кажущуюся степень диссоциации NaBr в этом растворе. Криоскопическая постоянная воды равна 1,86 К·кг/моль. (87,7 %)
853.Температура замерзания водного раствора с массовой долей хлорида кальция 2,5 % равна -1,2 ºС. Определите кажущуюся степень диссоциации соли в этом растворе. Криоскопическая постоянная воды 1,86 К·кг/моль. (89,7 %)
854.Определите, при какой температуре замерзнет раствор хлорида цинка моляльностью 0,01 моль/кг. Кажущаяся степень диссоциации соли равна 87 %. Криоскопическая постоянная воды
1,86 К·кг/моль. (-0,051 ºС)
855.Раствор, содержащий в воде массой 100 г хлорид магния массой 2,6 г, замерзает при температуре -1,4 ºС. Вычислите
изотонический и осмотический коэффициенты К(Н2О)=1,86 К·кг/моль. (2,75; 0,905)
247
856.Сколько граммов свекловичного сахара содержится в воде массой 100 г, если этот раствор замерзает при той же температуре, что и раствор хлорида калия молярной концентрации 0,1 моль/л? Кажущаяся степень диссоциации соли равна 83 %. (6,25 г)
857.При какой температуре замерзает раствор, содержащий в воде массой 50 г нитрат кальция массой 3,35 г? Кажущаяся степень диссоциации Ca(NO3)2 равна 69,5 %. Удельная теплота плавления льда – 333,7 Дж/г. (-1,82 ºС)
858.Определите давление пара над раствором хлорида натрия, который замерзает при температуре -1 ºС. Давление насыщенного пара воды при этой температуре равно 28 гПа;
К(Н2О)=1,86 К·кг/моль. (27,7 гПа)
859.Определите температуру кипения раствора, содержащего в 1 кг воды 0,01 моль хлорида бария, если кажущаяся степень диссоциации есоли равна 87 %. Эбуллиоскопическая постоянная воды равна 0,512 К·кг/моль. (100,014 ºС)
§6. Осмотическое давление растворов.
Закон Вант-Гоффа
Осмотическим давлением называется сила на единицу площади (Па), заставляющая растворитель переходить через полупроницаемую перегородку в раствор, находящийся при том же внешнем давлении, что и растворитель, а сам этот переход называется осмосом. Разбавленные растворы хорошо подчиняются законам идеальных газов.
Закон Вант-Гоффа: осмотическое давление разбавленного
раствора равно тому газовому давлению, которое производило бы растворенное вещество, если бы оно в виде газа при той же температуре занимало тот же объем, что и раствор.
PосмV = nRT = |
mRT |
или Росм = |
nRT |
, |
|
M |
|
V |
|
а для растворов электролитов |
|
|
|
|
Росм = inRT , V
где V – объем раствора; п – химическое количество растворенного вещества; m и M – его масса и молярная масса; R – универ-
248
сальная газовая постоянная; Т – абсолютная температура; i – изотонический коэффициент.
Так как отношение n/V представляет собой молярную концентрацию раствора См, выражаемую в моль/л (кмоль/м3), можно записать:
Pосм = CмRT,
а для растворов электролитов:
Pосм = iCмRT.
Из этого уравнения следует, что осмотическое давление прямо пропорционально концентрации раствора и абсолютной температуре.
Закон Авогадро для растворов: изотоническими называ-
ются растворы, обладающие одинаковым осмотическим давлением.
Пользуясь приведенными формулами, можно рассчитать осмотическое давление раствора, если известна его концентрация и температура. Зная Pосм при заданной температуре, можно определить концентрацию растворов, а также молярную массу растворенного вещества.
Пример 1. Определите осмотическое давление водного раствора, в 1.5 л которого содержится 300 г глюкозы (C6H12O6), при
25 ºС.
Решение. Согласно закону Вант-Гоффа,
Pосм = CмRT.
Молярная концентрация глюкозы в растворе составляет:
Cм = m/(MV) = 300/(1,5·10-3·180) = 1,11·103 (моль/м3).
Следовательно,
Pосм = 1,11·103·8,314·298 = 2,753·106 (Па).
Вопросы и упражнения
1.К растворам какой концентрации применима теория ВантГоффа?
2.Что такое осмотическое давление? Как оно обнаруживается?
3.Какие перегородки называются полупроницаемыми? Приведите примеры.
4.Как измеряется осмотическое давление?
249
5.Как ведет себя вещество в растворенном состоянии? В чем его свойства аналогичны свойствам газов?
6.Каким законам подчиняется осмотическое давление? Дайте формулировки и напишите математические выражения.
7.Какие растворы называются изотоническими? Приведите примеры.
8.Одинаковым ли осмотическим давлением обладают растворы, содержащие в литре: 1) мочевину массой 10 г; 2) глюкозу массой 10 г? Если неодинаковым, то у какого из растворов большее осмотическое давление и во сколько раз? Дайте объяснение, не делая расчетов.
9.Перечислите методы определения относительной молекулярной массы растворенных веществ и укажите, в каких случаях могут быть использованы эти методы. Напишите математические выражения, применяемые для расчетов, и поясните входящие в них величины. Укажите, по какому из методов получаются более точные результаты и почему.
10.Укажите свойства растворов, зависящие от природы компонентов, а также свойства, не зависящие от природы растворенного вещества, а зависящие только от относительного числа молекул веществ, находящихся в растворе.
11.Не вычисляя осмотического давления, определите: какой раствор при одной и той же температуре обладает большим осмотическим давлением: содержащий в 1 л 3 г нафталина C10H8 или 3 г антрацена С14Н10?
12.Растворы нитрата бария и сульфата алюминия содержат одинаковое количество молей в 1 л воды. Какой из этих растворов будет обладать большим осмотическим давлением, если кажущаяся степень диссоциации той и другой соли одинакова? Дайте обоснованный ответ, не производя вычислений.
Задачи
860.При температуре 22 ºС осмотическое давление раствора тростникового сахара равно 7,3·104 Па. Каково будет осмотическое давление, если раствор разбавить в два раза, а температуру повысить на 25 ºС? (3,96·104 Па)
250
861. |
При температуре 18 ºС осмотическое давление раство- |
|
871. |
Осмотическое |
давление |
раствора, |
содержащего |
в |
|||||||||
ра глицерина равно 3,039·105 Па. Каково будет осмотическое дав- |
500 см3 |
1,55 |
г |
анилина, |
при |
температуре |
21 ºС |
равно |
|||||||||
ление, если раствор разбавить в три раза, а температуру повысить |
8,104·104 Па. Определите молярную массу анилина. (93,48) |
|
|
||||||||||||||
до 37 ºС? (1,079·105) |
|
|
|
|
872. |
Осмотическое давление раствора, содержащего |
7,5 |
г |
|||||||||
862. |
Вычислите осмотическое давление раствора сахарозы |
сахара в 625 см3 |
раствора, равно |
8,307·104 Па |
при температуре |
||||||||||||
при температуре 0 ºС, если при температуре 20 ºС осмотическое |
12 ºС. Определите молярную массу сахара. (342,2) |
|
|
||||||||||||||
давление этого же раствора равно 1,066·105 Па. (99330 Па) |
|
873. |
Определите молярную массу растворенного вещества |
||||||||||||||
863. |
Осмотическое давление раствора неэлектролита при |
(неэлектролита), если раствор, содержащий 12 г/л растворенного |
|||||||||||||||
температуре |
17 ºС равно 4,82·105 Па. Определите осмотическое |
вещества, при температуре 17 ºС |
имеет осмотическое давление |
||||||||||||||
давление этого же раствора при температуре 57 ºС. (5,487·105 Па) |
4,82·105 Па. (60,03) |
|
|
|
|
|
|
|
|||||||||
864. |
Водные растворы фенола C6H5OH и мочевины CO(NH2)2 |
|
874. |
Раствор, содержащий 9 г растворенного вещества (не- |
|||||||||||||
содержат в 1 л равные массы растворенных веществ. Температу- |
электролита) в |
250 см3 |
раствора, обладает осмотическим давле- |
||||||||||||||
ра растворов одинакова. У какого из растворов осмотическое дав- |
нием |
4,56·105 |
Па |
при температуре 0 ºС. Определите молярную |
|||||||||||||
ление больше? Во сколько раз? |
|
|
массу растворенного вещества. (179,2) |
|
|
|
|
||||||||||
865. |
Вычислите осмотическое давление водного раствора, |
|
875. |
Сколько граммов этилового спирта |
(С2Н5ОН) нужно |
||||||||||||
содержащего |
225 г |
сахара в 5 л раствора, при температуре 25 |
растворить в 200 см3 воды, чтобы осмотическое давление этого |
||||||||||||||
ºС. (3,26·105 Па) |
|
|
|
раствора при температуре 17 ºС составило 2,026·105 Па? (0,77 г) |
|
||||||||||||
866. |
Вычислите осмотическое давление водного раствора с |
|
876. |
Осмотическое давление 1 моль |
бромида калия, раство- |
||||||||||||
массовой долей тростникового сахара С12Н22О11 |
0,025 (2,5 %) при |
ренного в |
8 л |
воды, равно |
5,63·105 Па |
при температуре |
25 ºС. |
||||||||||
температуре 27 ºС . Плотность раствора примите равной единице. |
Определите кажущуюся степень диссоциации бромида калия в |
||||||||||||||||
(1,822·105 Па) |
|
|
|
|
растворе. (84,5 %) |
|
|
|
|
|
|
|
|
||||
867. |
Вычислите осмотическое давление водного раствора с |
|
877. |
Осмотическое давление |
0,05 М раствора электролита |
||||||||||||
массовой долей хлорида магния 0,005 при температуре 18 ºС. |
равно |
2,725·105 Па при температуре 0 ºС. Кажущаяся степень |
|||||||||||||||
Плотность раствора равна 1 г/см3, а кажущаяся степень диссоциа- |
диссоциации электролита в растворе составляет |
70 %. На сколько |
|||||||||||||||
ции соли в растворе – 75 %. (3,18·105 Па) |
|
|
ионов диссоциирует молекула электролита? (3) |
|
|
|
|||||||||||
868. |
Вычислите осмотическое давление |
0,01 н |
раствора |
|
878. |
Раствор, содержащий 0,4359 моль/л |
тростникового са- |
||||||||||
К2SO4 при температуре 18 ºС. Кажущаяся степень диссоциации |
хара, при температуре 18 ºС |
изотоничен с раствором хлорида на- |
|||||||||||||||
соли в растворе равна 87 %. (33150 Па) |
|
|
трия, концентрация которого |
14,616 г/л. Определите кажущуюся |
|||||||||||||
869. |
Вычислите осмотическое давление морской воды при |
степень диссоциации хлорида натрия в растворе. (74,2 %) |
|
|
|||||||||||||
температуре |
27 ºС, если ее состав (г/л): NaCI – 27,2; MgCl2 – 3,4; |
|
879. |
Сколько граммов этилового спирта |
C2H5OH должен |
||||||||||||
MgSO4 – 2,3; CaSO4 – 1,3; КС1 – 0,6. Кажущаяся степень диссо- |
содержать 1 л |
раствора, чтобы его осмотическое давление было |
|||||||||||||||
циации каждой из солей равна единице. (2,77·106 Па) |
|
таким же, как и 1-молярного раствора азотной кислоты, кажущая- |
|||||||||||||||
870. |
Вычислите молярную массу мочевины, если водный |
ся степень диссоциации которой в этом растворе равна |
80 %? |
||||||||||||||
раствор, содержащий 0,3680 г мочевины в 200 см3 раствора, при |
(82,94 г) |
|
|
|
|
|
|
|
|
|
|
||||||
температуре |
20 ºС |
имеет осмотическое давление |
74630 Па. |
|
880. |
Какова массовая доля поваренной соли в физиологиче- |
|||||||||||
(60,06) |
|
|
|
|
|
ском растворе, если этот раствор изотоничен с кровью, осмотиче- |
|||||||||||
|
|
|
251 |
|
|
|
|
|
|
|
|
252 |
|
|
|
|
|
ское давление которой равно 8,104·105 Па при нормальной температуре человеческого тела (37 ºС)? Кажущуюся степень диссоциации поваренной соли примите равной единице. (0,92 %)
881.Сколько граммов глицерина С3Н5(ОН)3 должен содержать 1 л раствора, чтобы его осмотическое давление было таким же, как и раствора, содержащего в 1 л при той же температуре 4,5 г формальдегида СН2О? (13,80 г)
882.Вычислите концентрацию водного раствора мочевины, если раствор при температуре 27 ºС изотоничен с 0,5 М раствором CaCl2. Кажущаяся степень диссоциации соли в растворе рав-
на 65,4 %. (1,154 моль/л)
883.Некоторое количество тростникового сахара растворили
в1000 г воды. Давление пара над полученным раствором при температуре 100 ºС равно 100200 Па. Вычислите температуру
кипения и осмотическое давление указанного раствора при 100 ºС. Плотность раствора примите равной 1 г/см3. (100,322 ºС; 1,59·106 Па)
884.Вычислите температуру замерзания раствора, содержащего 7,308 г хлорида натрия в 250 г воды, если при температуре
18 ºС осмотическое давление указанного раствора составляет 2,1077·106 Па. Плотность раствора равна 1 г/см3. (-1,667 ºС)
885.Какое химическое количество неэлектролита содержится в растворе объемом 1 л, если его осмотическое давление при температуре 0 ºС равно 101,3 кПа? (152,3)
886.Осмотическое давление раствора глицерина при температуре 0 ºС равно 133,3 кПа. Найдите осмотическое давление этого раствора при температуре 18 ºС. (1420 гПа)
887.При температуре 17 ºС осмотическое давление раствора мочевины равно 120 кПа. Каково будет осмотическое давление, если раствор разбавить в 3 раза, а температуру повысить до 30 ºС? (418 гПа)
888.Вычислите осмотическое давление раствора, содержащего в 5 л 0,3 моль глюкозы, при температуре 22 ºС. (1472 гПа)
889.Вычислите осмотическое давление раствора, содержащего в 250 мл воды 0,538 г фруктозы, при температуре 27
253
ºС. (298,2 гПа)
890.Определите осмотическое давление раствора с мас-
совой долей свекловичного сахара 5 % при температуре 15 ºС. Плотность раствора равна 1,019 г/см3. (3570 гПа.)
891.Какова молярная концентрация раствора мочевины, если при температуре 17 ºС он производит давление, равное 86,6
кПа? (0,036 моль/л)
892.Сколько граммов глюкозы должно содержаться в растворе объемом 1 л, чтобы его осмотическое давление при температуре 20 ºС было равным 113,3 кПа? (8,37 г)
893.При температуре 15,5 ºС осмотическое давление раствора, содержащего в 1 л воды свекловичный сахар массой
9,968 г, равно 69,8 кПа. Вычислите величину константы R. (8,3 Дж/(моль·К))
894.Сколько граммов свекловичного сахара должно содержаться в водном растворе объемом 1 л, чтобы он был изотоничен раствору, содержащему в 300 мл раствора глицерин массой 3,064 г, при той же температуре? (38)
895.При температуре 20 ºС осмотическое давление раствора, содержащего в 1 л раствора 71,19 г неизвестного вещества, равно 513,2 кПа. Вычислите относительную молекулярную массу неизвестного вещества. (37,96 г)
896.При температуре 0 ºС осмотическое давление раствора, содержащего в 100 мл его 1 г свекловичного сахара, равно 66,86 кПа. Вычислите относительную молекулярную массу свекловичного сахара и относительную ошибку (в процентах) по сравнению с величиной, найденной в справочнике. (339,5; 0,875 %)
897.Осмотическое давление раствора, содержащего в 200 мл его 0,276 г мочевины, при температуре 18 ºС равно 57,05 кПа. Вычислите относительную молекулярную массу мочевины. Полученную величину сравните с величиной, найденной в спра-
вочнике. (58,95)
898.Температура замерзания водного раствора глюкозы равна -0,184 ºС. Вычислите осмотическое давление раствора при температуре 0 ºС. Криоскопическая постоянная воды равна
254
1,86 К·кг/моль. (224 кПа)
899.Определите осмотическое давление раствора с молярной концентрацией хлорида калия 0,1 моль/л при температуре 25 ºС. Кажущаяся степень диссоциации КС1 в этом растворе равна
83 %. (4530 гПа)
900.Вычислите осмотическое давление раствора с массовой
долей хлорида магния 3,7 % при температуре 17 ºС. Плотность раствора равна 1,03 г/см3, а кажущаяся степень диссоциации соли
–70,5 %. (23·105 Па)
901.При температуре 18 ºС осмотическое давление раствора хлорида натрия молярной концентрации 0,5 моль/л равно 2,1·106 Па. Вычислите кажущуюся степень диссоциации NaCl в этом растворе. (73,6 %)
902.Найдите молярную концентрацию раствора мочевины, который изотоничен с раствором хлорида бария молярной концентрации 0,01 моль/л при температуре 20 ºС. Кажущаяся степень диссоциации ВаС12 равна 87 %. (0,027 моль/л)
903.При температуре 17 ºС осмотическое давление раствора сульфата калия молярной концентрации эквивалента 0,1 моль/л равно 300,8 кПа. Вычислите изотонический и осмотический коэффициенты. (2,5; 0,83)
Глава 5. ПЕРЕГОНКА ЖИДКИХ СМЕСЕЙ
Если имеется смесь двух летучих идеальных жидкостей А и В, то в пар переходит как одна, так и другая жидкость. При этом общее давление насыщенного пара над всякой жидкой смесью при данной температуре (пара, находящегося в равновесии с жидкостью при данной температуре) равно сумме парциальных давлений жидкости А (PA ) и жидкости В (PB ):
Робщ PA PB .
Если жидкости неограниченно растворимы друг в друге, то парциальное давление каждого компонента смеси будет меньше давления насыщенного пара его в чистом состоянии при той же температуре.
В тех случаях, когда эти жидкости образуют идеальные растворы, наблюдается линейная зависимость парциального давления
255
от молярной доли каждой жидкости в смеси, и выполняется закон Рауля:
P |
|
nА |
Pо NжPо |
и P |
nВ |
Pо NжPо , |
||
|
||||||||
А |
|
nА nВ |
А |
А А |
В |
nА nВ |
В |
В В |
где пА и пВ – химические количества жидкостей А и В в смеси
соответственно; Ро |
и |
Ро |
– давления насыщенных паров чистых |
||||||
А |
|
В |
|
|
|
|
|
|
|
жидкостей А и В при заданной температуре; |
NAж и NBж – моль- |
||||||||
ные доли жидкостей А и В в жидкой смеси. |
|
|
|||||||
Очевидно, общее давление пара над смесью жидкостей бу- |
|||||||||
дет равно: |
P N ж Pо Nж Pо . |
|
|
||||||
|
|
|
|||||||
|
|
общ |
|
|
А А |
В |
В |
|
|
Т.к. NАж NВж 1, |
то, следовательно, |
|
Робщ РАо (РВо РАо )NВж . |
||||||
Но парциальные давления веществ |
А и В в парах согласно |
||||||||
следствию из закона Дальтона составляют: |
Nг . |
||||||||
P |
P |
|
Nг |
и P |
P |
||||
A |
общ |
|
A |
B |
|
общ |
|
B |
|
Сопоставив приведенные выше соотношения, можно получить уравнения, позволяющие определять химические количества компонентов А и В в парах над идеальными жидкими смесями любого состава при заданных температурах:
|
|
Po |
|
|
|
Po |
|
NAг |
NAж |
A |
и |
NBг |
NBж |
B |
. |
P |
P |
||||||
|
|
общ |
|
|
|
общ |
|
Количества парообразной и жидкой фаз при заданной температуре определяют по фазовым диаграммам, используя правило рычага (см. тему «Фазовое равновесие»).
В большинстве случаев, в особенности для реальных растворов, зависимость давления паров жидких смесей из двух растворимых друг в друге компонентов от их состава отличается от линейной. Часто на этих кривых появляются максимумы или минимумы. В общем случае для определения состава жидкой смеси и пара над ней пользуются фазовыми диаграммами и законами Коновалова для перегонки жидких смесей.
Первый закон Коновалова: насыщенный пар по сравне-
нию с равновесным раствором более обогащен тем компонентом, прибавление которого к жидкой смеси повышает общее давление пара над ней.
256
Второй закон Коновалова: точки максимума и миниму-
ма на кривой зависимости общего давления пара от состава раствора соответствуют смесям, состав которых одинаков с составом равновесного с ними пара. Эти смеси называются азеотропными или нераздельно кипящими.
Если на кривой зависимости общего давления от состава раствора имеется максимум или минимум, то при перегонке смесь разделяется на один из компонентов и азеотропную смесь.
С помощью фазовых диаграмм (диаграмм кипения) решаются вопросы, связанных с определением температуры кипения смесей, состава пара и состава жидкой смеси. На оси абсцисс откладывается состав жидких смесей и состав пара, а на оси ординат – температуры кипения. Нижняя кривая называется кривой жидкости или кривой кипения, верхняя – кривой пара или кривой конденсации.
Если жидкости практически не растворяются друг в друге, то при любом составе смеси парциальные давления каждого из компонентов над смесью равны давлениям их паров в чистом со-
стоянии при той же температуре ( PAo и PBo ):
PA PAo , PB PBo , Pобщ PA PB PAo PBo .
Состав пара и конденсата для смеси практически не растворимых друг в друге жидкостей при данной температуре не зависит от состава жидкой фазы и определяется из соотношения:
n |
|
|
Po |
m |
|
|
PoM |
|
, |
|
n |
A |
Po или |
m |
A |
PoM |
A |
||||
|
|
A |
|
|
A |
|
||||
|
B |
|
B |
|
B |
|
B |
B |
|
|
где nA и nB – химические количества компонентов А и В (в парах и в конденсате); m и M – их массы и молярные массы соответственно.
Для вычисления массы пара перегоняемых жидкостей или содержания жидкостей в конденсате в массовых долях вышеприведенную формулу преобразуют:
|
|
|
|
m |
A |
|
PoM |
A |
|
, |
|||
A |
|
|
|
|
A |
|
|
||||||
m |
|
|
|
PoM |
|
PoM |
|
||||||
|
|
A |
m |
A |
B |
||||||||
|
|
|
|
|
B |
A |
|
B |
|||||
при этом ωB = 1 – ωA. Данные формулы используют в расчетах процессов перегонки веществ с водяным паром.
257
Пример 1. Рассчитайте при 30 ºС общее давление и состав пара (в молярных долях) над смесью, состоящей из 117,2 г бензола и 884,5 г толуола (смесь бензола и толуола является идеальной). При 30 ºС давление насыщенного napа чистого бензола составляет 15756 Па, а толуола – 4892 Па.
Решение. Определим химические количества бензола и толуола:
n = m/M;
nб = 117,2:78,11 =1,5 (моль), nт = 884,5:92,14 = 9,6 (моль).
Рассчитаем парциальные давления бензола и толуола в па-
рах:
P |
|
1,5 |
15756 2130(Па); |
||
|
|
||||
б |
1,5 9,6 |
|
|
||
P |
|
9,6 |
|
4892 4232(Па). |
|
|
|
|
|||
т |
|
1,5 9,6 |
|||
Общее давление паров бензола и толуола при 30 ºС над жидкой смесью заданного состава составит:
Pобщ Pб Pт 2130 4232 6362(Па).
Вычислим мольные доли жидкостей в смеси:
Nж |
1,5 |
0,1352, |
Nж |
9,6 |
0,8648. |
б |
1,5 9,6 |
|
т |
1,5 9,6 |
|
Рассчитаем мольные доли бензола и толуола в парах:
Nбг |
15756 0,1352 |
0,3351, |
Nтг |
4892 0,8648 |
0,6649. |
|
6362 |
||||
6362 |
|
|
|
||
Таким образом, по сравнению с жидкой смесью пар богаче более летучим (низкокипящим) компонентом бензолом.
Пример 2. Вода и бензол практически не смешиваются друг с другом. Давления насыщенных паров этих двух жидкостей при 68 ºС соответственно равны 28553 и 68143 Па, а при 69 ºС – 29819 и 70196 Па. Принимая, что давление пара в интервале между 68 и 69 ºС для каждого вещества растет пропорционально температуре, вычислите температуру кипения смеси воды и бензола под давлением 98642 Па и количество бензола, которое будет содержаться в отгоне (в массовых долях).
258

Решение. Определим общее давление пара над смесью воды и бензола при 68 и 69 ºC:
Pобщ РНо 2О Рбо ;
при 68 ºС Робщ = 68143+28553 = 96696 (Па); при 69 ºС Робщ = 70196+29819 = 100015 (Па).
Из полученных данных видно, что температура кипения смеси будет находиться между 68 и 69 ºC. Определим эту температуру.
При повышении температуры на 1 ºС давление пара над смесью увеличится на 100015–96696 = 3319 (Па). Давление пара при 68 ºС ниже заданного на 98642–96696=1946 (Па). Чтобы давление пара увеличилось на эту величину и тем самым достигло заданного внешнего давления (смесь при этом закипает), смесь жидкостей необходимо нагреть выше 68 ºC на t. Значение t определим из пропорции:
t |
|
1946 |
, t = 0,59 (ºC). |
1 |
|
||
3319 |
|
||
Таким образом, под давлением Ратм = 98642 Па смесь заки-
пит при температуре Тк = 68 + t = 68+0,59 = 68,59 (ºC).
Увеличение температуры на 1 ºС повышает давление паров бензола на 70196–68143=2053 (Па). Следовательно, при 68,59 ºС парциальное давление паров бензола равно:
68143+2053·0,59 = 69354,3 (Па).
Парциальное давление паров воды составит: 98642–69354=29287,7 (Па).
Значит, соотношение количеств перегоняемых жидкостей
m |
|
|
PоM |
б |
|
69354,3 78,11 |
, |
||||
|
б |
|
|
б |
|
|
|
10,27 |
|||
m |
|
Pо |
|
M |
|
|
|||||
H |
O |
O |
H O |
29287,7 18,02 |
|
||||||
|
H |
|
|
|
|
||||||
|
2 |
|
|
2 |
|
|
2 |
|
|
|
|
т.е. на каждый килограмм воды приходится 10,27 кг бензола. Содержание бензола в отгоне составит:
|
б |
|
mб |
|
|
10,27 |
|
0,9112(или 91,12%). |
m m |
|
10,27 1 |
||||||
|
|
H2O |
|
|||||
|
|
|
б |
|
|
|
||
Пример 3. По диаграмме температура кипения – состав двухкомпонентной системы A – B (см. рисунок) определите изменение составов жидкой и парообразной фаз при нагревании ис-
259
ходной жидкой смеси состава, характеризующегося точкой а, и количества парообразной и жидкой фаз при охлаждении пара состава а до температуры t2 (точка n).
Решение. Ha рисунке представлена диаграмма кипения двухкомпонентной жидкой системы, т. е. зависимость температуры кипения от состава кипящей системы при p=const.
Состав, масс.доли (%)
Рис. Диаграмма состояния жидкой двухкомпонентной системы
Компонент B имеет более низкую температуру кипения tB, компонент A – более высокую температуру кипения tA. Кривая 1 характеризует изменение температуры кипения жидких смесей A и B в зависимости от их состава. Кривая 2 соответствует составам равновесного пара при температурах кипения жидких смесей различного состава. Выше кривой 2 система находится в газообразном (парообразном) состоянии, ниже кривой 1 – в жидком состоянии. Между кривыми 1 и 2 находится гетерогенная область равновесных состояний жидкость – пар.
Жидкая смесь состава точки а (40 % B и 60 % A) закипает при температуре t1. Отходящие при этом первые порции пара имеют состав, характеризующийся точкой b (69 % B и 31 % A), т. е. при температуре t1 в пар переходит в большем количестве наиболее низкокипящий компонент B. Так как пар богаче компонентом B, то вследствие испарения жидкая фаза обедняется компонентом B и обогащается компонентом A. Изменение состава жидкой фазы на диаграмме показано стрелками (участок AC на кривой 1).
Вместе с этим меняется и состав пара, находящегося в рав-
260
новесии с жидкостью (участок ED на кривой 2). Температура кипения жидкой смеси постепенно повышается. При достижении температуры кипения t3 состав пара станет равным составу исходной смеси, а жидкая фаза вся перейдет в пар. При этой температуре закончится кипение. Состав последней капельки жидкости соответствует точке C (17 % B и 83 % A).
Для определения количеств жидкой и парообразной фаз, образующихся при охлаждении пара состава а до температуры t2 (точка n), воспользуемся правилом рычага. По этому правилу масса жидкой фазы так относится к массе пара, как плечо nm к плечу kn:
тж пт или mж·kn = mп·nm;
тп kn
mж/mп = 11/15 = 1/1,363,
т. е. на 1 кг жидкой фазы приходится 1,363 кг паров A и B.
Вопросы и упражнения
1.Какие вещества будут присутствовать в паре над следующими растворами: водный раствор сахара, водный раствор этилового спирта, водный раствор гидроксида аммония, разбавленный раствор хлористоводородной кислоты, бромная вода, водный раствор уксусной кислоты?
2.Является ли достаточной и почему для предотвращения испарения ртути защита ее поверхности слоем минерального масла? Почему щелочные металлы хранят в закрытой посуде под слоем керосина, а ртуть – просто в плотно закрытой посуде? Можно ли ртуть хранить так же, как щелочные металлы и почему?
3.Напишите математические выражения закона Рауля для парциальных давлений пара компонентов и общего давления пара смеси и поясните их. Изобразите графически зависимость парциальных давлений пара компонентов и общего давления пара идеальной смеси от ее состава.
4.Какие жидкости при смешивании образуют растворы, близкие к идеальным? Приведите несколько примеров.
261
5.Какие отклонения от идеальных растворов наблюдаются для смесей различных веществ, неограниченно растворимых друг в друге? Как объяснить эти отклонения? В чем причина положительных и отрицательных отклонений от закона Рауля?
6.Изобразите графически зависимость общего и парциальных давлений пара от состава смесей с положительными и отрицательными отклонениями от идеальных.
7.Каков состав смеси и состав равновесного с ней пара в различных системах (сравните идеальные и неидеальные системы)?
8.Докажите на основании закона Дальтона, что отношение количеств вещества компонентов А и В в парах равно отношению их парциальных давлений.
9.Сформулируйте законы Коновалова и поясните их.
10.Какие смеси называются азеотропными? Каковы их свойства? Приведите примеры.
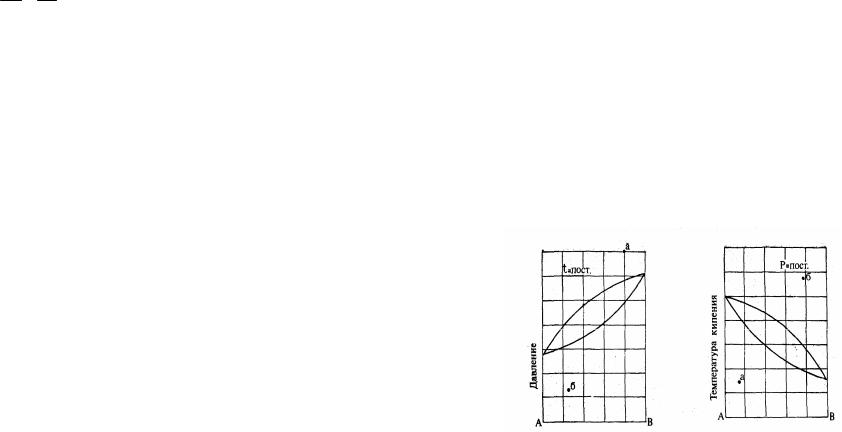
11.Назовите кривые на рисунке, укажите области пара и жидкости, какие изменения будут происходить со смесью, состояние которой (состав и давление) выражается: 1) точкой «а», если давление уменьшать при постоянной температуре; 2) точкой «б», если давление увеличивать при постоянной температуре.
12.Объясните, почему на приведенных ниже диаграммах различное расположение кривых:
262
